Содержание
- 2. характерные признаки: металлы тяжелее воды
- 3. Ga Cs Hg Большинство - твердые вещества при комнатной температуре, но есть и жидкие:
- 4. Большинство имеют металлический блеск, серые или белые Cs кристаллы Cu самородок Au самородок
- 5. КЛАССИФИКАЦИЯ МЕТАЛЛОВ 1. Черные и цветные 2. Тяжелые (ƍ≥5 г\см3) и легкие (ƍ≤5г\см3) 3. Драгоценные 4.
- 6. Черные Получено электро-лизом, чистота 99,97% Fe
- 7. Цветные Ag Bi Rb Sn Ti
- 8. Тяжелые Fe Hg Pb Bi
- 9. Тяжелые Co Sb Ni 99,99% Медленный электролиз
- 10. Легкие Li, K, Na, Rb, Cs, Fr, Be, Mg, Ca, Sr, Ba, Al, Sn Al Ca
- 11. ДРАГОЦЕННЫЕ Ag Au
- 12. Платиновые металлы Os Rh Pt
- 13. Редкоземельные La
- 14. Eu Y Sc
- 15. Металлы: s-, d-, f- элементы, а также небольшое количество p- элементов – Al, Ga, In, Tl,
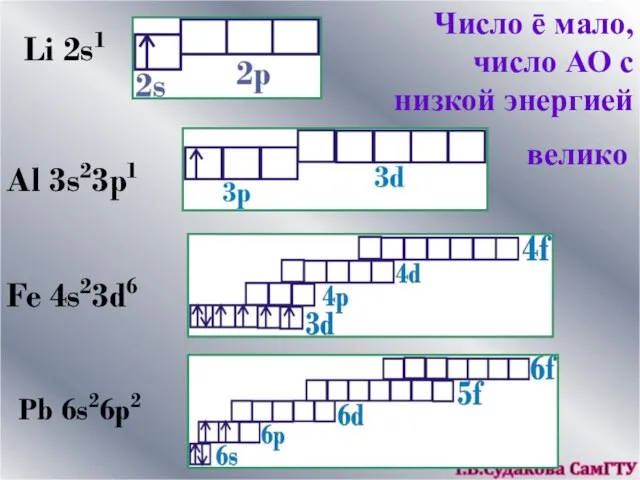
- 16. Li 2s1 Al 3s23p1 Fe 4s23d6 Pb 6s26p2 Число ē мало, число АО с низкой энергией
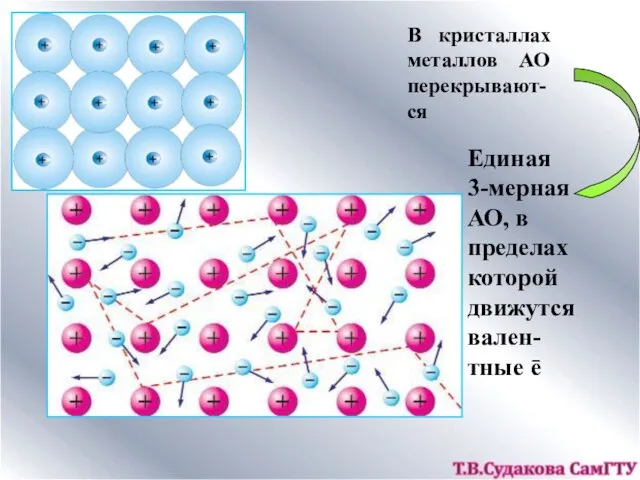
- 17. В кристаллах металлов АО перекрывают-ся Единая 3-мерная АО, в пределах которой движутся вален-тные ē
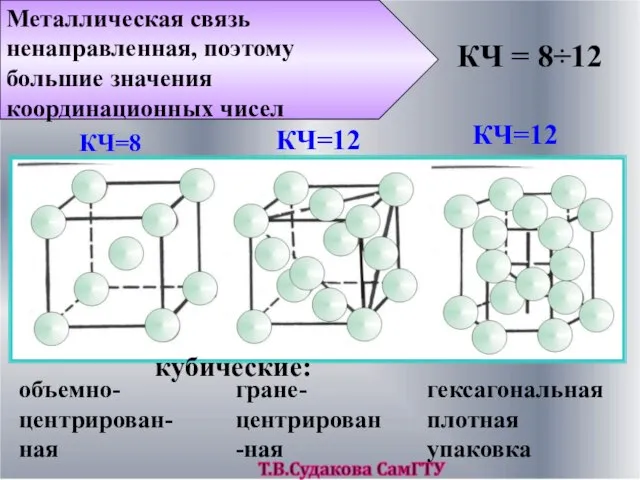
- 19. КЧ = 8÷12 Металлическая связь ненаправленная, поэтому большие значения координационных чисел объемно-центрирован-ная кубические: гране-центрирован-ная гексагональная плотная
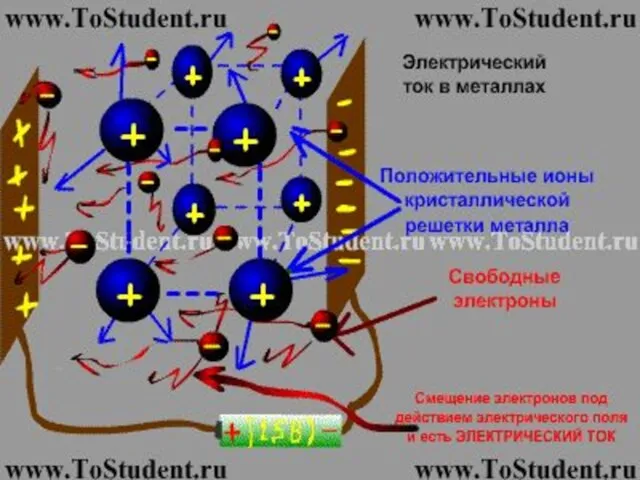
- 20. ХИМИЧЕСКИЕ СВОЙСТВА Общие: 1. Малая электроотрицательность (ЭО). 2. Ме в реакциях образуют только катионы: Me0 ─
- 21. Металлы p- и d-элементы: Низшая СО +1, +2 Основные оксиды и гидроксиды Промежуточ-ная СО +3, +4
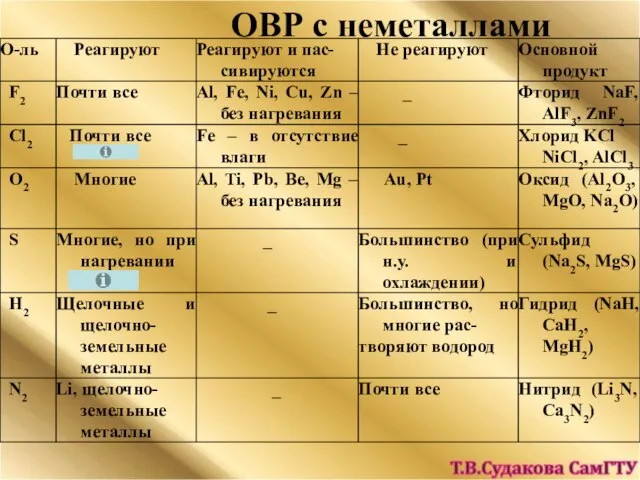
- 22. ОВР с неметаллами
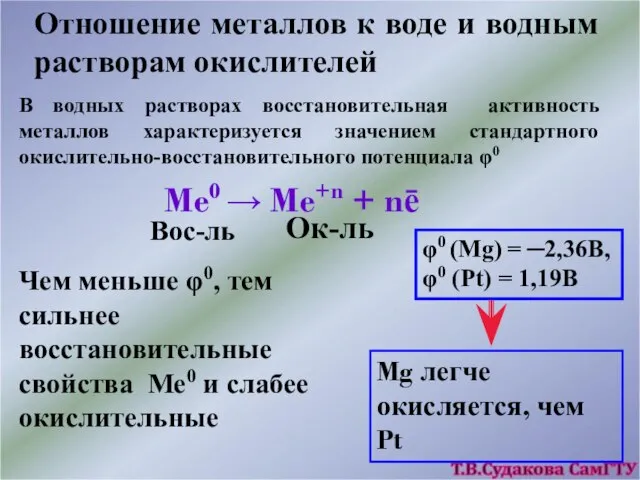
- 23. Отношение металлов к воде и водным растворам окислителей В водных растворах восстановительная активность металлов характеризуется значением
- 24. взаимодействие с водой - это ОВР, где окислитель Н+ φ(2Н+/Н2) = - 0,059•рН = 0,059•7 =
- 25. Ме0 + ОН– → МеО2– + Н2 Ме0 + Н2О + ОН– → [Ме(ОН)4]– + Н2
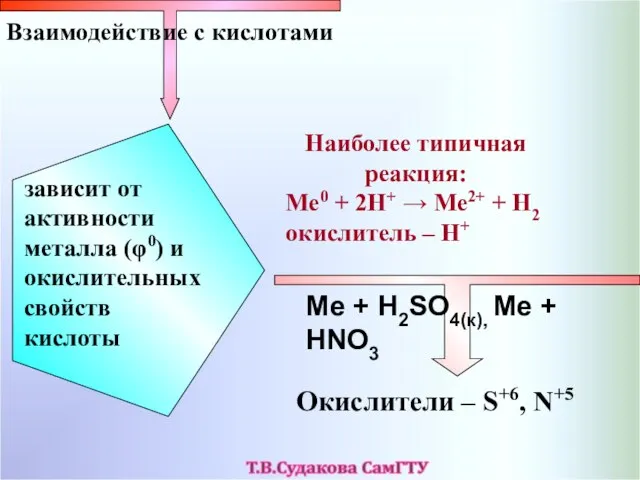
- 26. Наиболее типичная реакция: Ме0 + 2Н+ → Ме2+ + Н2 окислитель – Н+ Взаимодействие с кислотами
- 27. Оксидные: Fe2O3 - гематит, Fe2O3•H2O – гетит, Al2O3 – боксит, TiO2 – рутил, SnO2 – касситерит;
- 28. гематит Fe2O3 боксит Al2O3 касситерит SnO2
- 29. пирит FeS2 халькопирит Cu2S•FeS2
- 30. Общие методы получения: Вытеснение металла более активным металлом. Восстановление металлов неметаллами - газообразными СО и Н2
- 31. 3V2O5 (к) + 10Al(к) →5Al2O3(к) + 6V(к) TiCl4 (к) + 4Na (к) → Ti (к) +
- 32. Восстановление неметаллами - пирометаллургия -только при высоких температурах MgO + C = CO + Mg Sb2O4
- 33. электролиз водных растворов или расплавов: NaCl → Na+ + Cl─ катод─: анод+: Na+ + ē =
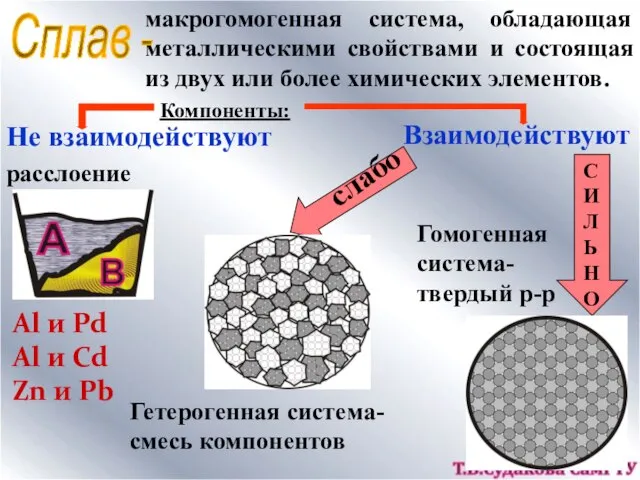
- 34. макрогомогенная система, обладающая металлическими свойствами и состоящая из двух или более химических элементов. Сплав - Компоненты:
- 35. однородное (гомогенное) кристал-лическое вещество переменного состава, в кристаллическую решетку которого входят атомы или ионы нескольких компонентов.
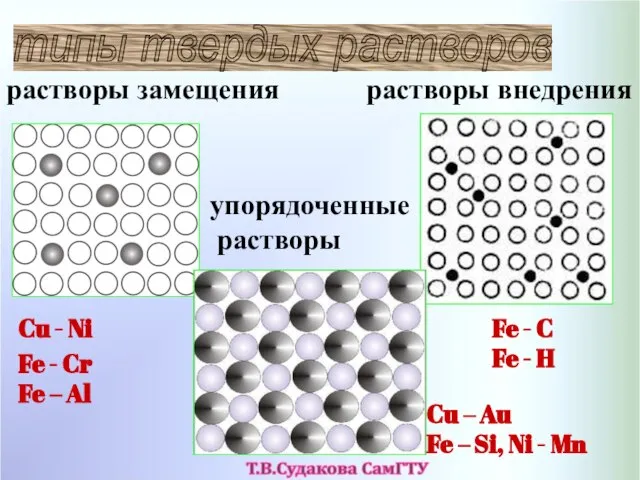
- 36. типы твердых растворов растворы замещения растворы внедрения упорядоченные растворы Cu - Ni Fe - C Fe
- 37. Очень сильное взаимодействие между атомами металлов Интерметаллические соединения (интерметаллиды)- Соединения металлов между собой и с неметаллами
- 38. Манганин – сплав 11% Mn, 2,5-3,5% Ni и 86% Cu; Примеры сплавов: Чугун – сплав Fe
- 40. сплав Fe с С (3,5-5,5%) и Mn (5-20%); На изломе – зеркальный блеск используется в произ-водстве
- 41. Обычная углеродистая нержавеющая Кровля, до 25 лет
- 42. литье Сталь 35Г Повышенная твердость и износостойкость щеки дробилок башня танка
- 43. высокое электрическое сопротивление, самые «тихие» сплавы: 70% Mn и 30% Cu демпфирование - поглощение энергии механических
- 44. Бронза: оловянная – Cu-Sn алюминиевая – Cu-Al бериллиевая – Cu-Be и т.п. Самая древняя !
- 45. Нейзильбер: Cu(50- 60%) –Ni(20-25%) –Zn(18-22%) Фехраль: Al-Cr (15-30%)-Fe (70% и более)
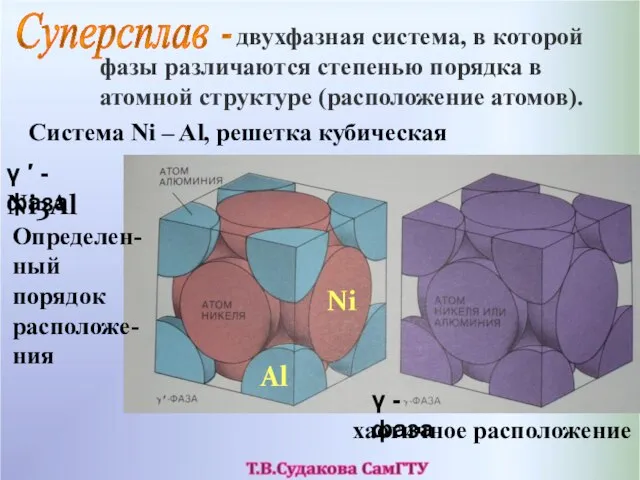
- 46. двухфазная система, в которой фазы различаются степенью порядка в атомной структуре (расположение атомов). Суперсплав - Система
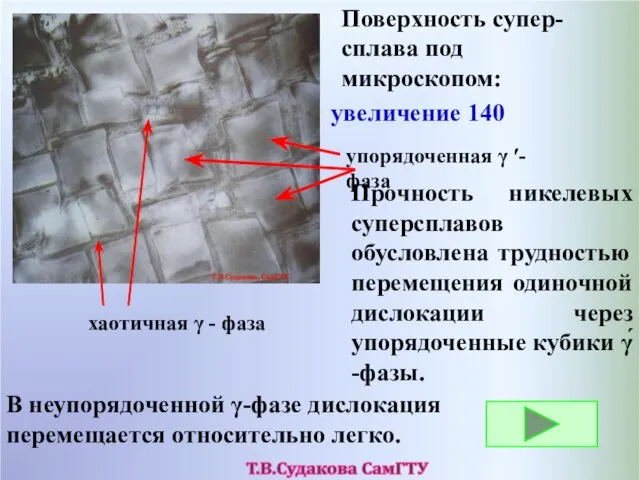
- 47. Поверхность супер-сплава под микроскопом: упорядоченная γ ′-фаза хаотичная γ - фаза Прочность никелевых суперсплавов обусловлена трудностью
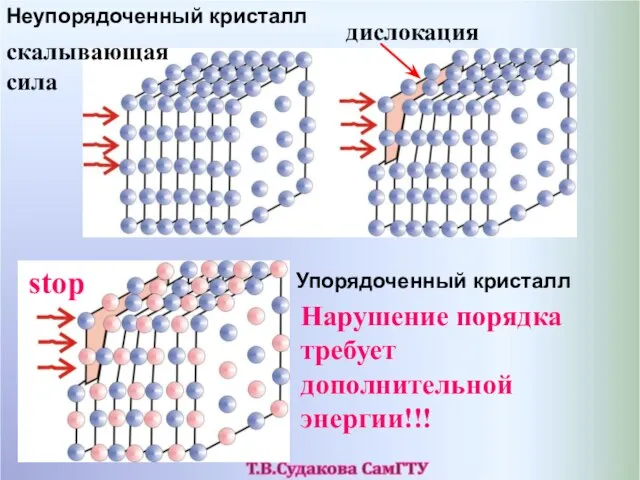
- 48. скалывающая сила дислокация stop Нарушение порядка требует дополнительной энергии!!! Неупорядоченный кристалл Упорядоченный кристалл
- 49. Сверхпластичность зерна Чем мельче зерно, тем выше скорость деформации. Причина - деформация металлических связей в контактах
- 50. Чем больше S поверхности частиц (наноразмеры), тем больше поверхностная G Сплав не устойчив! При ↑ Т
- 51. аморфные металлы Сверхбыстрое охлаждение Только ближний порядок в структуре
- 52. 1976г. - лента аморфного магнитного сплава Ni-Fe-P-B 1960г. -первый аморфный сплав Au75Si25 свойства: нет кристаллической решетки
- 53. тарелки с нагревательным контуром из тонких металлических лент: подогрев пищи прямо в тарелке. Металл для нагреватель-ного
- 55. Скачать презентацию








































 Положение о системе общественного наблюдения при проведении государственной (итоговой) аттестации обучающихся, освоивших образ
Положение о системе общественного наблюдения при проведении государственной (итоговой) аттестации обучающихся, освоивших образ Употребление многозначных глаголов в речи (6 класс)
Употребление многозначных глаголов в речи (6 класс) Методический материал к уроку русского языка в 6 классе на тему: «Фразеологизмы».
Методический материал к уроку русского языка в 6 классе на тему: «Фразеологизмы». Западная философия 20-го века
Западная философия 20-го века Лот 5, г. Хабаровск, ул. Сысоева, 21, кв. 14
Лот 5, г. Хабаровск, ул. Сысоева, 21, кв. 14 Барометрия. Задачи барометрии
Барометрия. Задачи барометрии Прямоугольный параллелепипед. Куб (5 класс)
Прямоугольный параллелепипед. Куб (5 класс) Образ современного подростка в произведениях А. Иванова «Географ глобус пропил» и «Общага-на-крови»
Образ современного подростка в произведениях А. Иванова «Географ глобус пропил» и «Общага-на-крови» Финансовая компания Автомайн
Финансовая компания Автомайн Энциклопедия термина число
Энциклопедия термина число Своя игра
Своя игра Формування системи документування господарських операцій та документообігу (Тема №6). Організація документообігу на підприємстві (Лекція
Формування системи документування господарських операцій та документообігу (Тема №6). Організація документообігу на підприємстві (Лекція Лекция №2
Лекция №2 Розроблення технології пасти із насінням соняшника з підвищеною біологічною цінністю для людей конституції типу Пітта-Доша
Розроблення технології пасти із насінням соняшника з підвищеною біологічною цінністю для людей конституції типу Пітта-Доша Удельное сопротивление
Удельное сопротивление Народная сказка: история происхождения и её герои
Народная сказка: история происхождения и её герои Описание рекламных мест
Описание рекламных мест Типология организационных культур Герта Хофстеда
Типология организационных культур Герта Хофстеда Общая физическая подготовка на занятиях по волейболу
Общая физическая подготовка на занятиях по волейболу Значение мяса в питании человека. Виды мяса. Требования к качеству
Значение мяса в питании человека. Виды мяса. Требования к качеству КАСКО – Профи
КАСКО – Профи Socialization
Socialization Презентация по обществознанию
Презентация по обществознанию Формирование функции голосообразования у младших школьников в условиях школы второго вида
Формирование функции голосообразования у младших школьников в условиях школы второго вида Общая схема МЭМС. МЭМС с 3-х аксиальными гироскопами и акселерометрами различных компаний
Общая схема МЭМС. МЭМС с 3-х аксиальными гироскопами и акселерометрами различных компаний Зарядка для глаз
Зарядка для глаз Модель внимания Сергея Леонидовича Рубинштейна
Модель внимания Сергея Леонидовича Рубинштейна Проблемы экологии в России и Великобритании в 21 веке Андрианова Н.Г.
Проблемы экологии в России и Великобритании в 21 веке Андрианова Н.Г.