Содержание
- 2. Деление на минеральные и органические вещества В начале XIX века ученые разделяли все вещества в природе
- 3. Многочисленность органических веществ В настоящее время человечеству известно более 10 млн. веществ, из них около 70%
- 4. Определение класса органических соединений Наличие тех или иных функциональных групп либо атомов элементов определяет принадлежность соединения
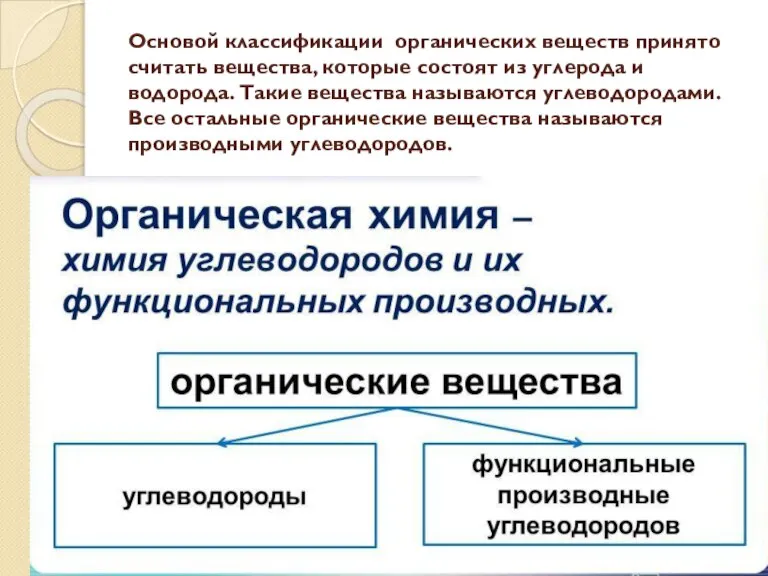
- 5. Основой классификации органических веществ принято считать вещества, которые состоят из углерода и водорода. Такие вещества называются
- 6. Классификация органических соединений Для классификации органических соединений по типам и построения их названий в молекуле органического
- 7. Углеродный скелет Углеродный скелет представляет собой последовательность химически связанных между собой атомов углерода. Функциональные группы образуют
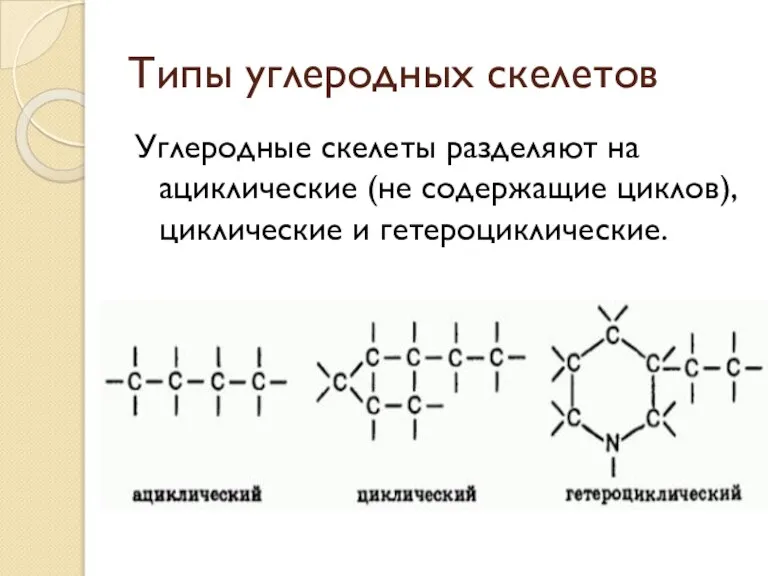
- 8. Типы углеродных скелетов Углеродные скелеты разделяют на ациклические (не содержащие циклов), циклические и гетероциклические.
- 9. Функциональные группы В большинстве органических соединений, кроме атомов углерода и водорода, содержатся атомы других элементов (не
- 10. Важнейшие функциональные группы
- 11. Номенклатура органических соединений В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная
- 12. Тривиальная (историческая) номенклатура первая номенклатура, возникшая в начале развития органической химии, когда не существовало классификации и
- 13. Рациональная номенклатура по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще
- 14. Систематическая номенклатура ИЮПАК (IUPAC — Международный союз теоретической и прикладной химии) международная единая химическая номенклатура. Систематическая
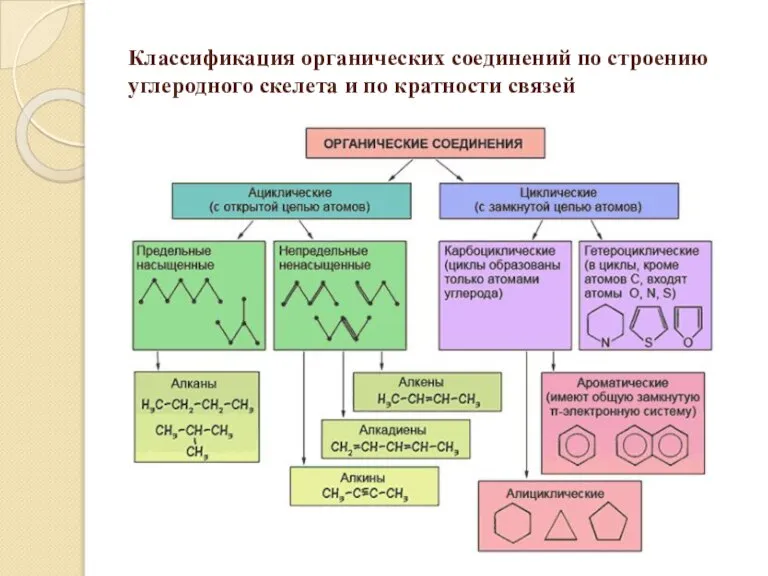
- 15. Классификация органических соединений по строению углеродного скелета и по кратности связей
- 16. Список основных классов органических веществ Алканы Алкины Алкены Бензолы Нитросоединения Нитрозопроизводные Галогенпроизводные Пероксиды Сульфиды Простые эфиры
- 17. План разбора класса органических веществ 1. Общая формула 2.Строение 3.Гомологический ряд. 4. Изомерия 5. Физические свойства
- 18. Теория химического строения Теория химического строения - учение о строении молекулы, описывающее все те её характеристики,
- 19. Основные положения теории химического строения органических соединений 1. Все атомы, образующие молекулы органических веществ, связаны в
- 20. АЛКАНЫ
- 21. Определение алканов Алканы (парафины) – алифатические (нециклические) предельные углеводороды, в которых атомы углерода связаны между собой
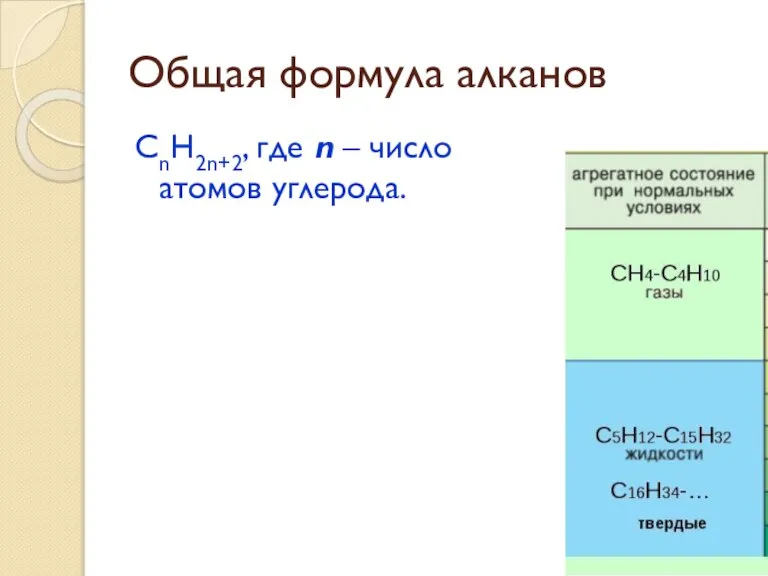
- 22. Общая формула алканов CnH2n+2, где n – число атомов углерода.
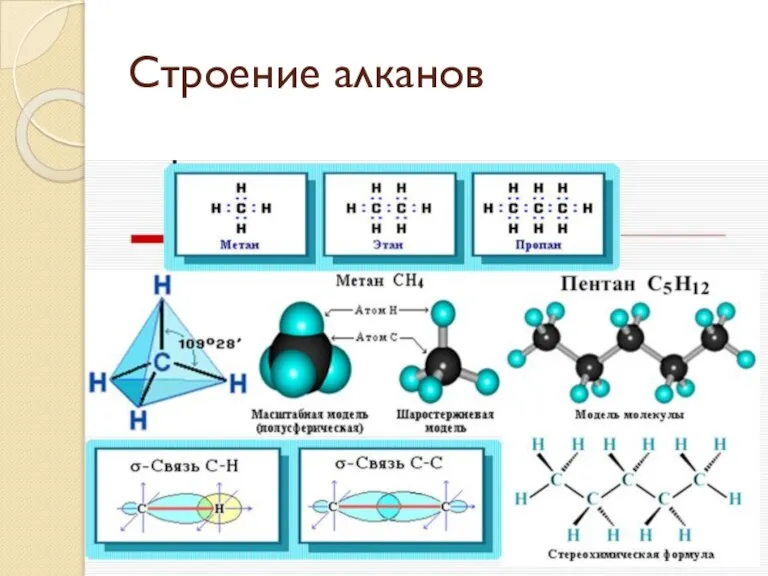
- 23. Строение алканов
- 24. Определение гомологического ряда Ряд химических соединений одного структурного типа, отличающихся друг от друга на одну или
- 25. Гомологический ряд алканов Простейший его представитель – метан СН4. Гомологами метана являются: этан C2H6; пропан C3H8;
- 26. Гомологический ряд алканов
- 27. Изомерия алканов: углеродного скелета и поворотная (конформационная) изомерия
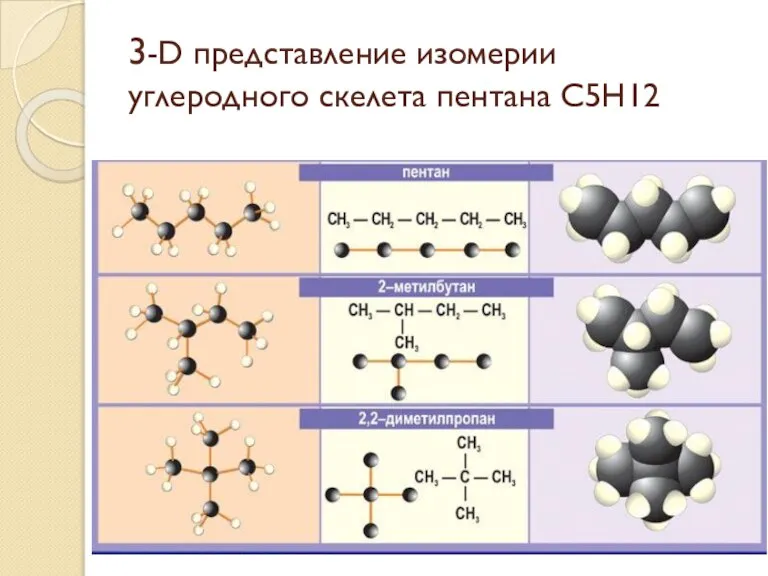
- 28. 3-D представление изомерии углеродного скелета пентана С5H12
- 30. Вопрос по таблице:
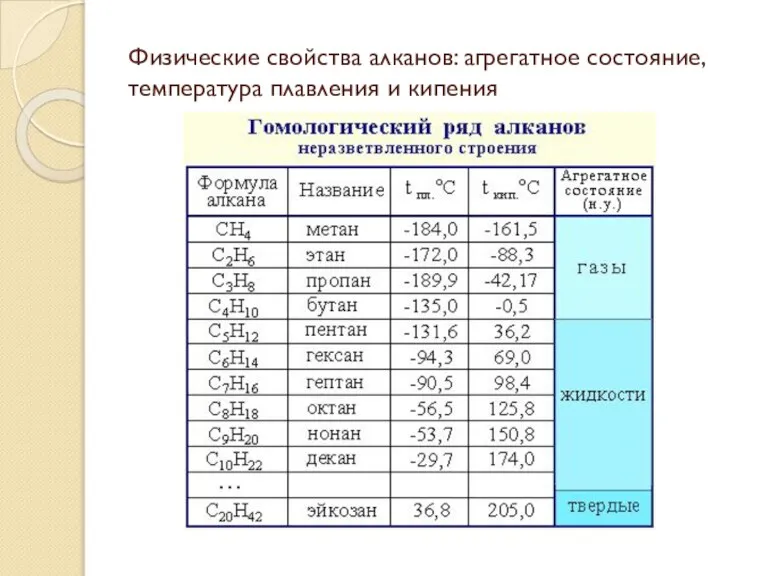
- 31. Физические свойства алканов: агрегатное состояние, температура плавления и кипения
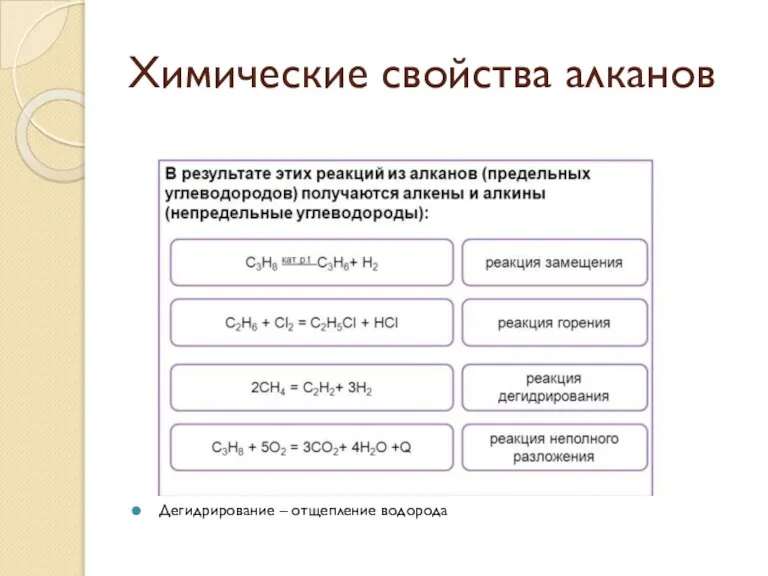
- 32. Химические свойства алканов Дегидрирование – отщепление водорода
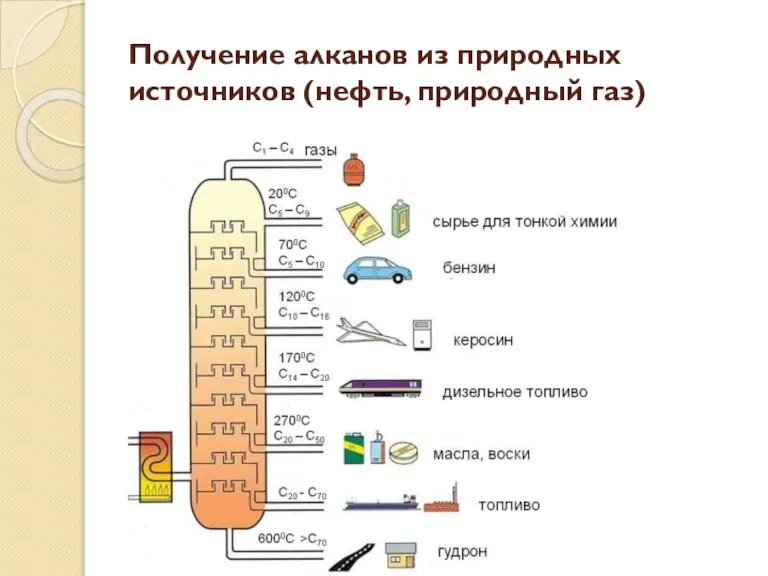
- 33. Получение алканов из природных источников (нефть, природный газ)
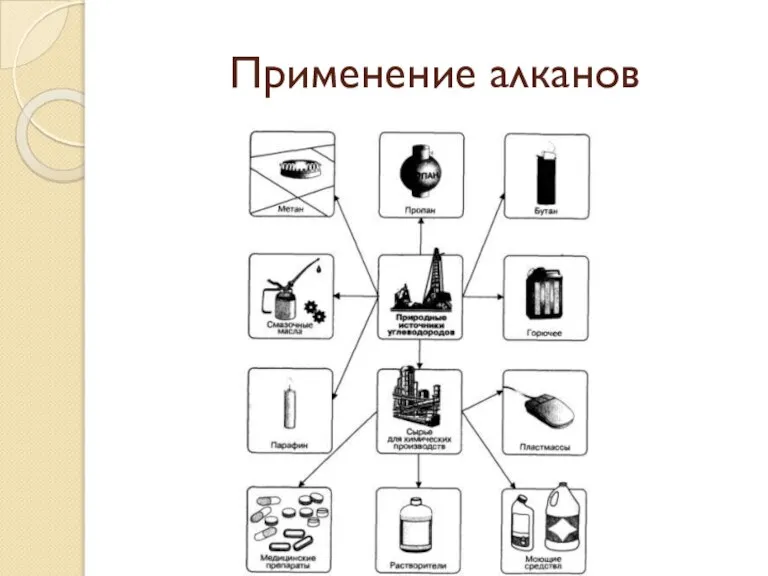
- 34. Получение и применение алканов
- 35. Применение алканов
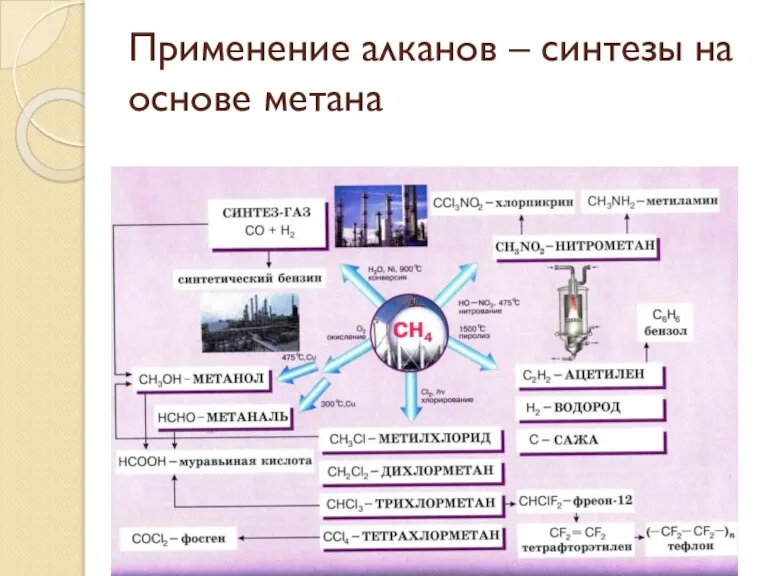
- 36. Применение алканов – синтезы на основе метана
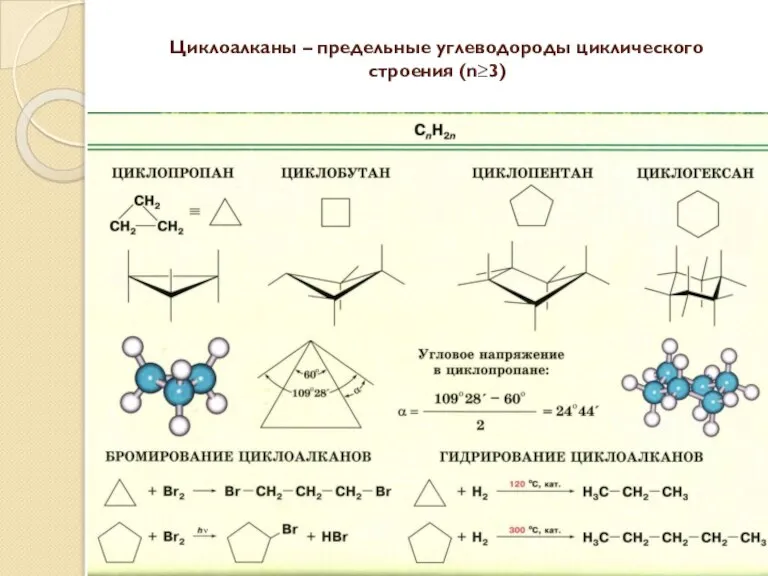
- 37. Циклоалканы – предельные углеводороды циклического строения (n≥3)
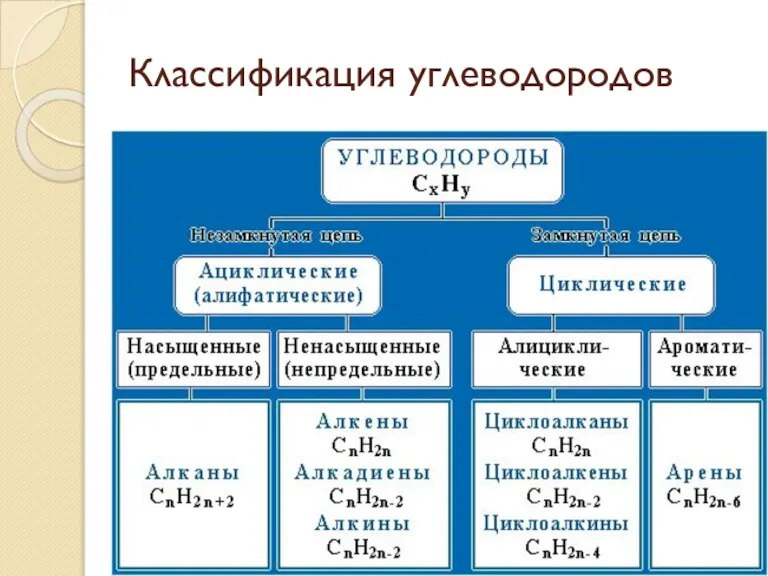
- 38. Классификация углеводородов
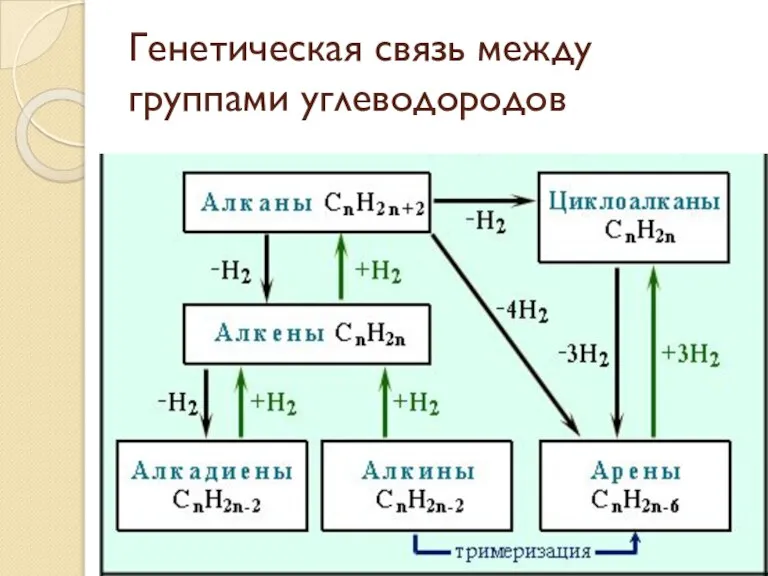
- 39. Генетическая связь между группами углеводородов
- 40. Непредельные углеводороды Непредельные углеводороды - это углеводороды, содержащие кратные связи в углеродном скелете молекулы. Кратными называются
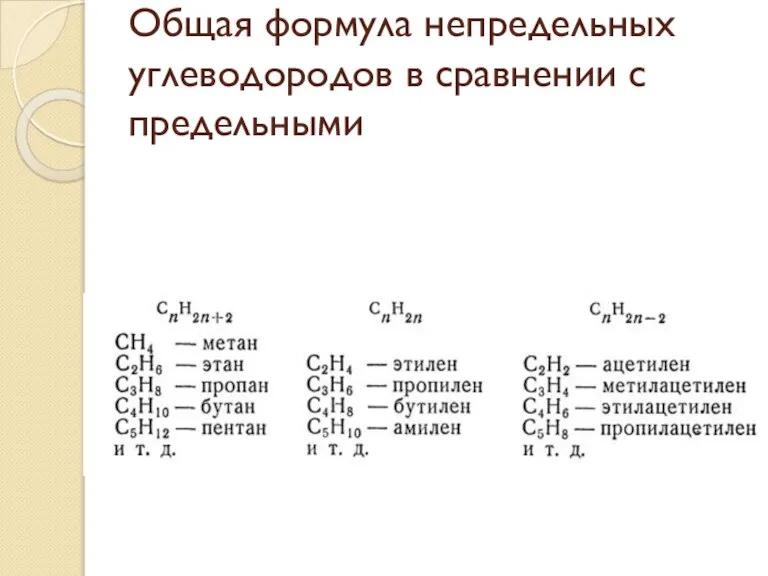
- 41. Общая формула непредельных углеводородов в сравнении с предельными
- 42. Определение алкенов Углеводородами ряда этилена, или этиленовыми углеводородами (олефинами или алкенами) называют ненасыщенные углеводороды, строение которых
- 43. Строение непредельных углеводородов Алкены CnH2n -одна двойная (- и -) связь Алкины CnH2n-2 - одна тройная
- 44. Изомерия непредельных углеводородов Структурная: изомерия углеродного скелета, изомерия положения заместителя или кратной связи. Пространственная (геометрическая или
- 45. Физические свойства алкенов С2 – С4 (газы) С5 – С18 (жидкости) С19 … – (твёрдые) Алкены
- 46. Химические свойства алкенов
- 47. Как и предельные углеводороды, алкены горят на воздухе: C2H4 + 3O2 t→ 2CO2 + 2H2O +
- 48. Получение алкенов 1. Действие спиртовых растворов едких щелочей на галогенпроизводные H3C-CH2-CH2BrH3C-CH=CH2+NaBr+H2O 2.Действие на спирты водоотнимающих средств
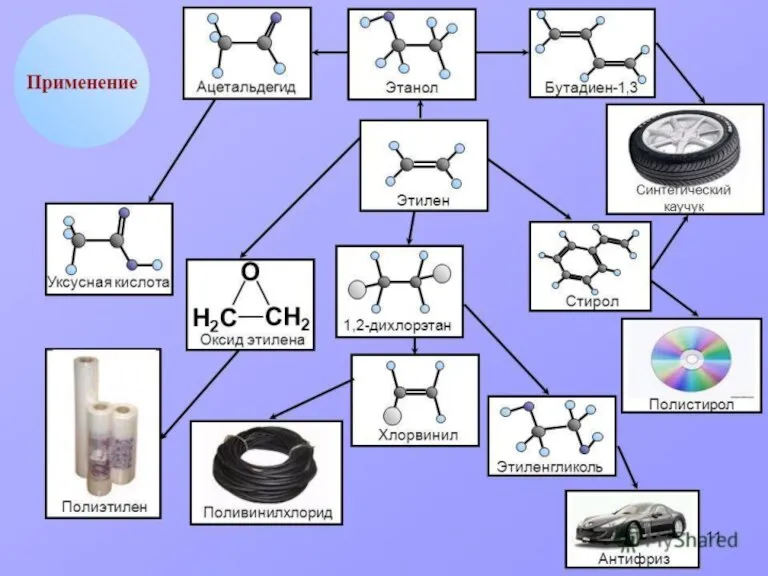
- 49. Применение этилена Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек
- 50. Применение этилена (2 часть) Этилен - исходное соединение для получения полиэтилена высокого и низкого давления и
- 51. Применение этилена (3 часть) Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта.
- 52. Применение этилена (4 часть) Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов,
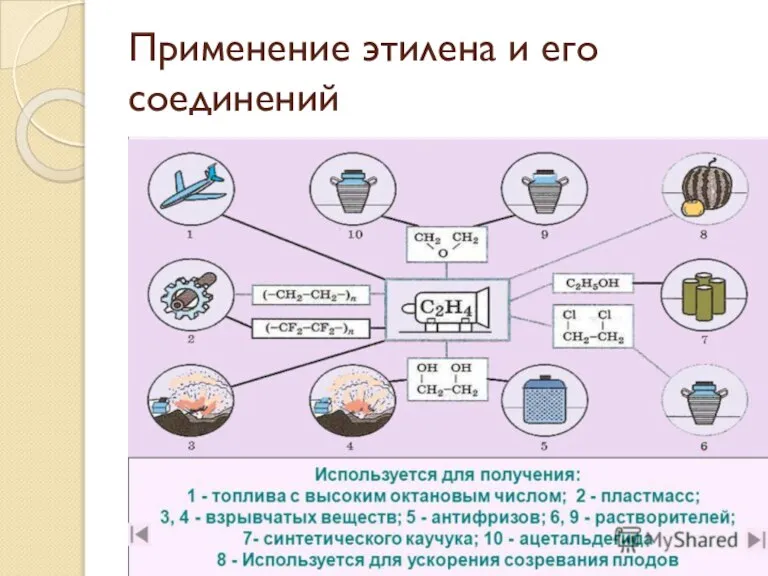
- 53. Применение этилена и его соединений
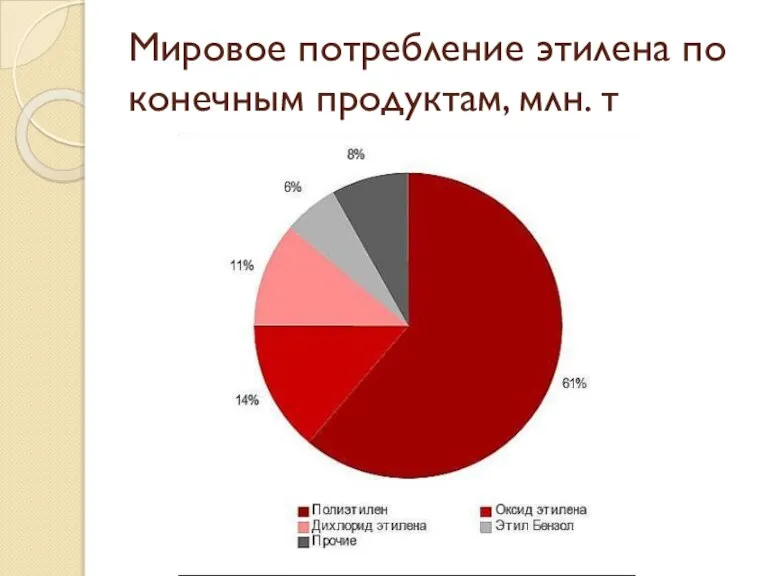
- 55. Мировое потребление этилена по конечным продуктам, млн. т
- 56. Ацетилен и ацетиленовые углеводороды (алкины)
- 57. Определение ацетиленовых углеводородов (алкинов) Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную
- 58. Ацетилен С2Н2 – Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде
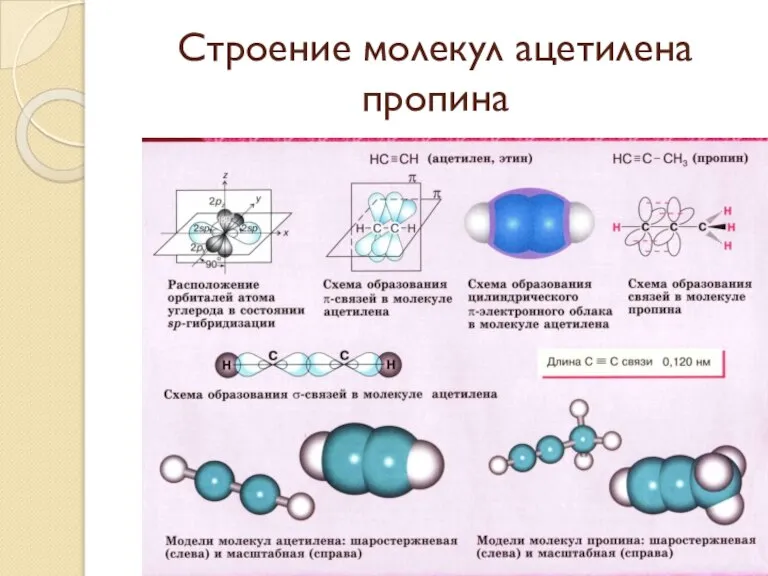
- 59. Строение молекул ацетилена пропина
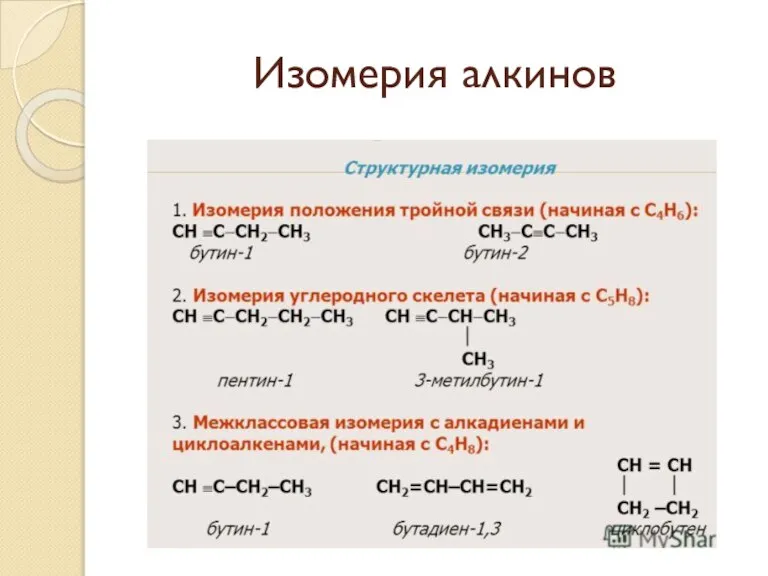
- 60. Изомерия алкинов
- 61. Физические свойства ацетилена С2Н2 – газ без цвета и почти без запаха, технический ацетилен обладает неприятным
- 62. Химические свойства алкинов 1.Присоединение галогенов 2.Присоединение водорода 3.Присоединение галогенводородов 4.Присоединение воды 5.Присоединение спиртов 6.Присоединение кислот 7.Присоединение
- 63. Свойства гомологов Свойства гомологов изменяются аналогично алкенам. По физическим свойствам алкины напоминают алкены и алканы. Температуры
- 64. Изомерия алкинов
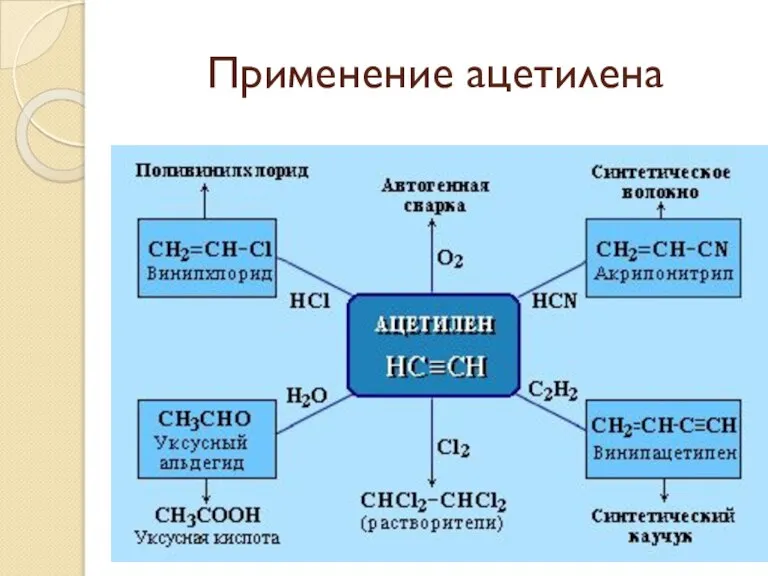
- 65. Применение ацетилена Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим
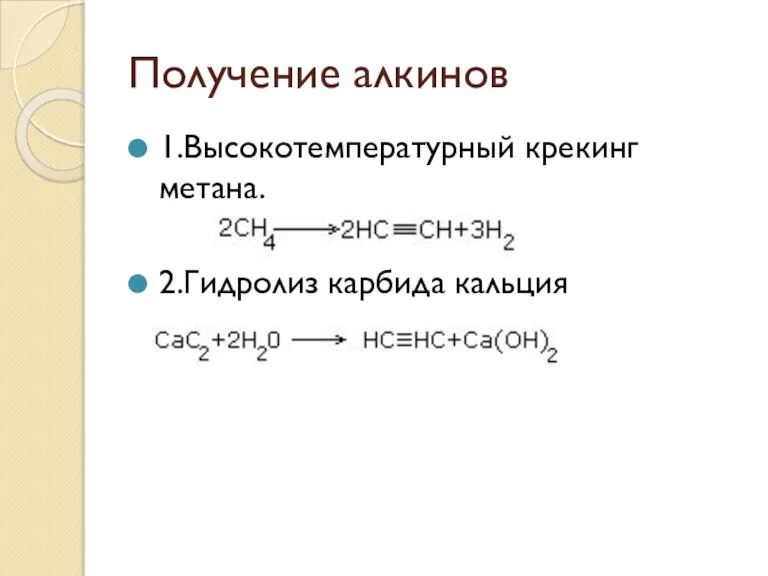
- 66. Получение алкинов 1.Высокотемпературный крекинг метана. 2.Гидролиз карбида кальция
- 67. Применение ацетилена
- 68. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ) Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод -
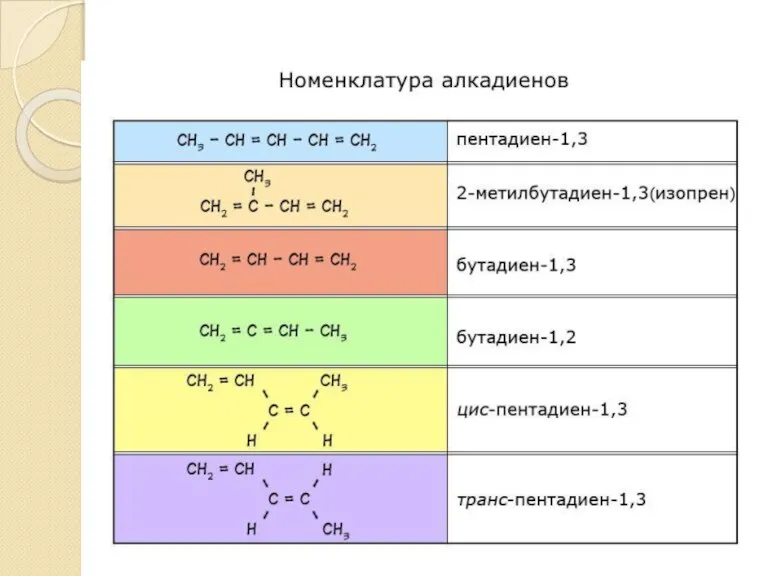
- 69. Алкадиены
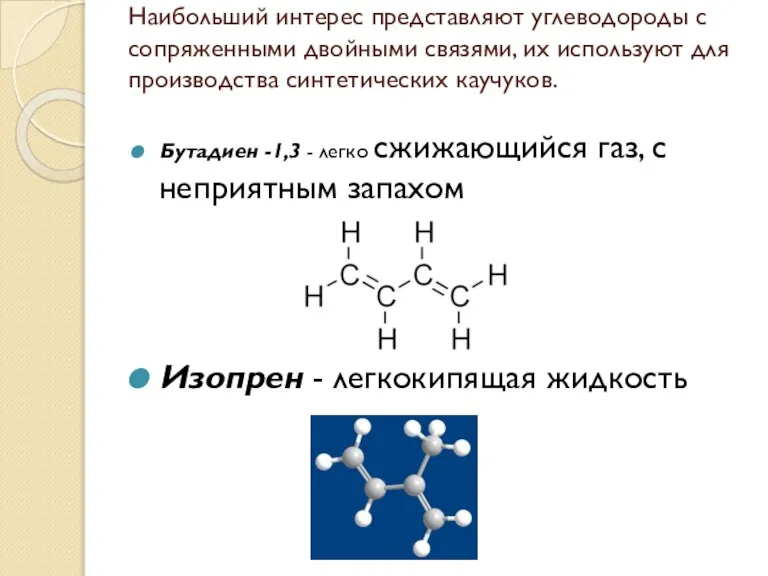
- 70. Наибольший интерес представляют углеводороды с сопряженными двойными связями, их используют для производства синтетических каучуков. Бутадиен -1,3
- 72. Физические свойства алкадиенов Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C;
- 73. Химические свойства алкадиенов
- 74. Способы получения бутадиена Известно много способов получения бутадиена, но промышленное значение имеют лишь некоторые из них.
- 75. Первый способ получения бутадиена Способ получения бутадиена, являющегося исходным веществом ( мономером) для изготовления синтетического каучука,
- 76. Получение бутадиена из этилового спирта Этот способ получения бутадиена был осуществлен в СССР в промышленном масштабе.
- 78. Скачать презентацию



















































 Гнутопропильные заготовки
Гнутопропильные заготовки Ораторсоке мастерство
Ораторсоке мастерство Федеральный закон № 185 – ФЗ О Фонде содействия реформированию жилищно-коммунального хозяйства
Федеральный закон № 185 – ФЗ О Фонде содействия реформированию жилищно-коммунального хозяйства Врожденные и приобретенные программы поведения
Врожденные и приобретенные программы поведения векторы в пространстве
векторы в пространстве Анализ документального фильма Мечты Дзиро о суши
Анализ документального фильма Мечты Дзиро о суши Работа текучих вод, ледников и ветра
Работа текучих вод, ледников и ветра луч. угол 7 класс
луч. угол 7 класс Профессия - «Бренд-менеджер»
Профессия - «Бренд-менеджер» Военные аспекты международного гуманитарного права
Военные аспекты международного гуманитарного права Концепция подготовки кадров для транспортного комплекса Российской Федерации
Концепция подготовки кадров для транспортного комплекса Российской Федерации Расчет нормативных затрат на оказание медицинских услуг – инструмент реализации Постановления Правительства РФ от 2 сентября 2010г
Расчет нормативных затрат на оказание медицинских услуг – инструмент реализации Постановления Правительства РФ от 2 сентября 2010г Регламентация малых закупок в Самарской области
Регламентация малых закупок в Самарской области CyberFarm. Состав команды
CyberFarm. Состав команды Творчество Окуджавы Булата Шалвовича
Творчество Окуджавы Булата Шалвовича Презентация на тему Интересные факты о животных
Презентация на тему Интересные факты о животных  Предложение по реализации торгового помещения
Предложение по реализации торгового помещения Порядок комплектования групп по углублённому изучению предметов на параллели 8-х классов в новом 2012-13 уч.году
Порядок комплектования групп по углублённому изучению предметов на параллели 8-х классов в новом 2012-13 уч.году Как к источнику лань, Так душа моя жаждет Лишь к Тебе, Святой Боже, Все лететь и лететь.
Как к источнику лань, Так душа моя жаждет Лишь к Тебе, Святой Боже, Все лететь и лететь. Межцивилизационные коммуникации Курс лекций для групп ДЛЭ-501мвфо, ДЛЭ-501мид, ДЛЭ-501мт осенний семестр 2011/2012 Черняк Надежда Валерьев
Межцивилизационные коммуникации Курс лекций для групп ДЛЭ-501мвфо, ДЛЭ-501мид, ДЛЭ-501мт осенний семестр 2011/2012 Черняк Надежда Валерьев Завоевание Обетованной земли
Завоевание Обетованной земли Почему англичане любят говорить о погоде
Почему англичане любят говорить о погоде Презентация на тему Сложные эфиры. Жиры
Презентация на тему Сложные эфиры. Жиры  Многообразие многоклеточных организмов
Многообразие многоклеточных организмов Мебель
Мебель Ель символ Нового Года
Ель символ Нового Года Что должен знать руководитель
Что должен знать руководитель Одноразовая посуда из осенних листьев
Одноразовая посуда из осенних листьев