Слайд 2Цель работы.
Цель работы:
Изучить процессы коррозии металлов, в зависимости от различных условий.

Провести классификацию коррозии.
Рассмотреть, какие способы защиты металлов наиболее эффективны.
Объяснить применение этого явления металлов в очень важных исторических событиях
Слайд 3 Экспериментальная часть исследовательской работы.
Цель экспериментальной части.
1) Изучить химическую сущность процесса

коррозии.
2) Исследовать какие факторы определяют протекание
коррозии,
3) Изучить действия антикоррозийных способов защиты
металлов, выяснить действие ингибитора в процессе
коррозии,
4) Выяснить влияние электролитов на процесс коррозии.
Слайд 6Выводы экспериментальной части.
скорость коррозии загрязнённого металла выше чем скорость коррозии чистого металла
на

скорость разрушения влияет однородность поверхности металла, металл с шероховатой поверхностью будет разрушаться быстрее.
в случае покрытия железа более активным металлом коррозия железа не наблюдается, а в случае покрытия менее активным металлом скорость химического процесса становится выше.
скорость коррозии зависит от активности металла.
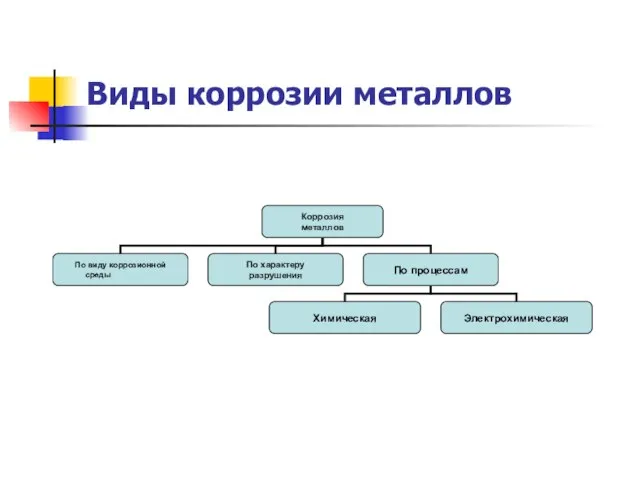
Слайд 8Электрохимическая коррозия
Это такая коррозия, в результате которой наряду с химическими процессами (отдача

электронов атомами коррозируемого металла — процесс окисления) протекают электрические (перенос электронов от одного участка изделия к другому).
Слайд 9 Химическая коррозия
Кислородная коррозия стали
связана с образованием
оксидной пленки,
состоящей

из
FeO, Fe2O3, Fe3O4.
Слайд 10Классификация коррозии по виду коррозионной среды
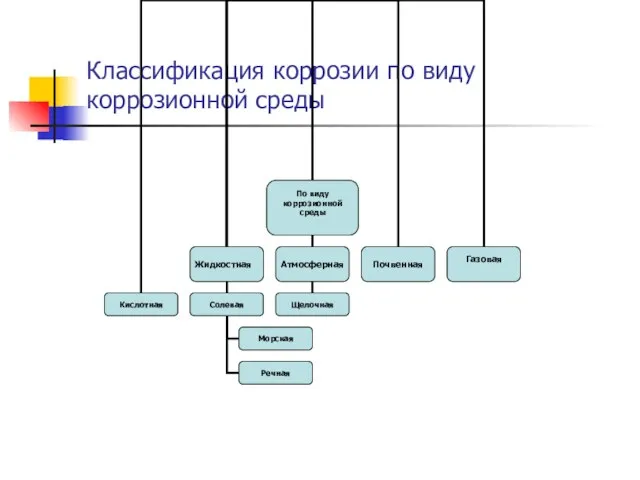
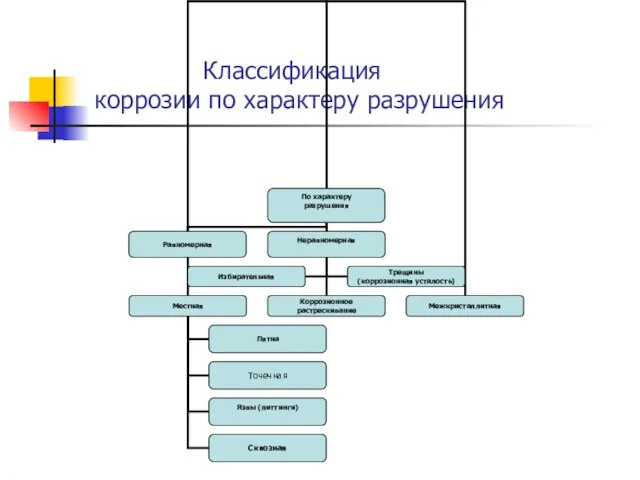
Слайд 11 Классификация
коррозии по характеру разрушения
Слайд 134. Первый коррозионист Фемистокл
500 - 449 годы до н. э.
Еще

древние столкнулись с обрастанием подводной части морских судов - отложением толстых (до 30 - 40 см) слоев, образованных поселениями водных организмов-обрастателей . Из-за обрастания корабли резко (на 30 - 40 %) теряли скорость хода. Эмпирически было найдено средство против обрастания - медная обшивка. Сейчас механизм действия такой защиты нам предельно ясен: в морскую воду переходят ионы меди, которые токсичны для большинства обрастателей.
Фемистокл предлагает способ защиты от контактной коррозии железных гвоздей в медной обшивке. По его указанию при строительстве судов гвозди предварительно погружали в расплавленный свинец. Освинцованные, они значительно лучше и надежнее держали обшивку.
350 легких греческих трирем, которые отличались быстротой хода нанесли поражение превосходящим силам противника: персидский флот насчитывал свыше 800 , значительно более тяжело вооруженных и крупных кораблей.
Слайд 14Сражение латунных трубок
31 мая 1916 г. встретились две гигантские армады Великобритании

и Германии. По грубому счету потопленных кораблей сражение закончилось «вничью». Немецкие адмиралы решили вывести свои корабли из сражения.
Все попытки англичан догнать флот противника из-за значительно большей быстроходности и маневренности немецких судов.
Британские корабли не могли развивать полной мощности — значительная часть латунных конденсаторных трубок вышла из строя из-за коррозии.
В начале XX века немецкие металлурги установили, что присадка олова замедляет обесцинкование. В 1912 г. в глубокой тайне в Германии был начат выпуск конденсаторных трубок из так называемой морской латуни.Именно этому сплаву и обязан был германский флот благополучным исходом сражения.
В 1929 г. английские коррозионисты нашли еще более эффективный способ защиты а-латуни от обесцинкования — небольшими (0,01—0,04 %) добавками мышьяка, фосфора, сурьмы; они создали новый сплав — «адмиралтейскую» латунь, содержащую 29 % цинка, 1 % олова и 0,02—0,04 % мышьяка.












 Устройства памяти компьютера
Устройства памяти компьютера Второй десяток
Второй десяток Буквальная (не)движимость в русской дигитальной поэзииE-Motions. Textual movement in Russian Digital Poetry
Буквальная (не)движимость в русской дигитальной поэзииE-Motions. Textual movement in Russian Digital Poetry Правонарушение
Правонарушение Презентация на тему Этические правила служебного поведения и проф. служебной деятельности гос. гражданских служащих РФ
Презентация на тему Этические правила служебного поведения и проф. служебной деятельности гос. гражданских служащих РФ  Проблема изменения климата - состояние научных знаний- Арктика- Климатическая доктрина РФ- Копенгагенское соглашениеКокорин
Проблема изменения климата - состояние научных знаний- Арктика- Климатическая доктрина РФ- Копенгагенское соглашениеКокорин Карл Линней
Карл Линней ПОВЕЛИТЕЛЬНОЕ НАКЛОНЕНИЕ ГЛАГОЛА
ПОВЕЛИТЕЛЬНОЕ НАКЛОНЕНИЕ ГЛАГОЛА ДЯДЯ
ДЯДЯ Метод пряника
Метод пряника Профессия 08.01.08 Мастер отделочных строительных работ
Профессия 08.01.08 Мастер отделочных строительных работ Роль жилищного микрофинансирования в повышении доступности жилья для семей с невысоким уровнем доходов
Роль жилищного микрофинансирования в повышении доступности жилья для семей с невысоким уровнем доходов Правописание безударных гласных ипарных согласных в корне слова(обобщение)
Правописание безударных гласных ипарных согласных в корне слова(обобщение) Правовое регулирование налоговых отношений
Правовое регулирование налоговых отношений АО Интертек Рус. Документы для трудоустройства
АО Интертек Рус. Документы для трудоустройства ООО «Управляющая компания«Южные ворота»Презентация промышленных зон
ООО «Управляющая компания«Южные ворота»Презентация промышленных зон Как осуществить поиск в Интернете Элективный курс 9 класс
Как осуществить поиск в Интернете Элективный курс 9 класс Occupation: Blaster
Occupation: Blaster Новогоднее поздравление
Новогоднее поздравление Стены из натуральных материалов
Стены из натуральных материалов История возникновения воротников
История возникновения воротников Презентация на тему Осенние и зимние явления в жизни растений
Презентация на тему Осенние и зимние явления в жизни растений  Интересные свойства воды
Интересные свойства воды Кораблик-водомер. Номинация Судомоделирование
Кораблик-водомер. Номинация Судомоделирование Наследственные болезни обмена веществ
Наследственные болезни обмена веществ Учитель английского языка Сидельникова Надежда Валентиновна
Учитель английского языка Сидельникова Надежда Валентиновна Презентация на тему Внешняя политика Ивана Грозного
Презентация на тему Внешняя политика Ивана Грозного  Три состояния воды
Три состояния воды