Слайд 2Коррозия
(от лат. corrodere- разъедать) –
это самопроизвольный процесс разрушение металлов, под

влиянием окружающей среды.
Слайд 4Гипотеза:
Воздействие окружающей среды является основной причиной коррозии металлов в машиностроении.

Слайд 5Цели работы:
1.Выявить основные причины процесса коррозии металлов.
2.Найти способы защиты металлов от коррозии,

применяемые в машиностроении.
Слайд 6Задачами работы являются:
1. Сформулировать представление о коррозии металлов.
2. Ознакомиться с видами

коррозии.
3. Исследовать механизм коррозийных процессов, условия их протекания, на основе эксперимента
4. Определить основные способы защиты металлов от коррозии
Слайд 7Эксперимент:
Опыт 1.
Стакан (Fe H2O): В данном случае мы наблюдаем химическую коррозию.

Слайд 8Опыт 2.
Стакан (Fe p-p NaCl): химическая коррозия. Но скорость коррозии гораздо

выше, чем в первом случае.
Слайд 9Опыт 3.
Стакан (Fe Cu p-p NaCl): железный гвоздь в контакте с медной

проволокой опущен в раствор NaCl. Скорость коррозии очень велика, образовалось много ржавчины.
Слайд 10Опыт 4.
Стакан (Fe Zn p-p NaCl): тоже наблюдается коррозия, но только не

железа, а цинка.
Слайд 11Опыт 5.
Стакан (Fe NaOH p-p NaCl): железный гвоздь опущен в р-р NaCl,

к которому добавили NaOH. Мы видим, что коррозия железа в данном случае практически отсутствует.
Слайд 13Выводы по результатам эксперимента:
железо слаба прокорродировало, в чистой воде коррозия идет

медленнее, т.к. вода слабый электролит.
NaCl увеличивает скорость коррозии.
NaCl – это сильнокоррозионная среда для железа, особенно в случае контакта с менее активным металлом – медью.
Железо в контакте с более активным металлом даже в сильнокоррозийной среде – растворе NaCl – не корродирует, остается защищенным до тех пор, пока не прокорродирует весь цинк.
NaOH замедляет коррозию, а ионы ОН¯ являются ингибиторами, т.е. замедлителями коррозии.
Мы убедились на опыте, что коррозию железа можно уменьшить с помощью NaOH и в случае с контактом Zn.
7. температурный фактор повышает риск коррозии железа.













 Реформа языка Карамзина
Реформа языка Карамзина Варианты расчета бонуса за два месяца
Варианты расчета бонуса за два месяца Эксплуатация автомобильного транспорта
Эксплуатация автомобильного транспорта Государство в политической системе
Государство в политической системе ИСТОРИЯ СПИЧЕК
ИСТОРИЯ СПИЧЕК Презентация на тему Растения-индикаторы
Презентация на тему Растения-индикаторы Мышление как психический процесс. Виды и формы мышления. 4 формата мышления
Мышление как психический процесс. Виды и формы мышления. 4 формата мышления Субъекты правовых отношений. Правовое положение лиц
Субъекты правовых отношений. Правовое положение лиц скульптура «Под одними звездами» ("Unter den gleichen Sternen")
скульптура «Под одними звездами» ("Unter den gleichen Sternen") Виды гимнастики
Виды гимнастики Hilton Hotels & Resorts
Hilton Hotels & Resorts Шар. Елка. Снеговик
Шар. Елка. Снеговик Обзор православной литературы Доброе слово для малых ребят
Обзор православной литературы Доброе слово для малых ребят Водные маршруты
Водные маршруты Презентация на тему Василий Тёркин
Презентация на тему Василий Тёркин  Технология приготовления пиццы
Технология приготовления пиццы Мир в свечах Выполнила: Плаксунова Людмила МОУ СОШ №4 Руководитель: Чуприна Т.В.
Мир в свечах Выполнила: Плаксунова Людмила МОУ СОШ №4 Руководитель: Чуприна Т.В. "Поле - чудес" по произведениям К.И. Чуковского
"Поле - чудес" по произведениям К.И. Чуковского PURE_THERAPY_Bezuprechnaya_idealno_ochischennaya_kozha
PURE_THERAPY_Bezuprechnaya_idealno_ochischennaya_kozha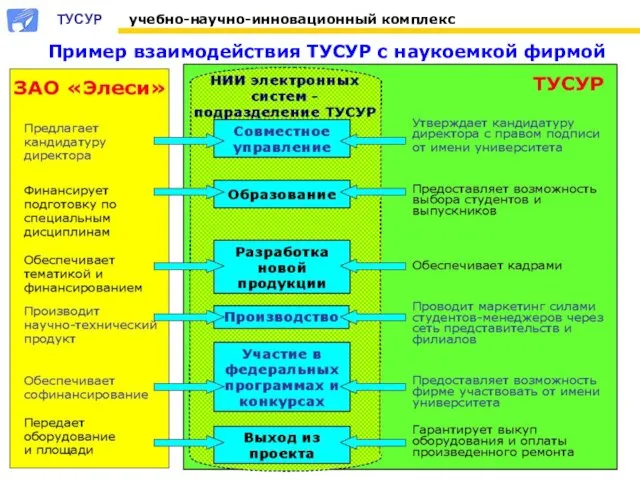 Пример взаимодействия ТУСУР с наукоемкой фирмой
Пример взаимодействия ТУСУР с наукоемкой фирмой Введение в менеджмент
Введение в менеджмент Австралия
Австралия Who should be the first ?
Who should be the first ? Велосипедный туризм
Велосипедный туризм Музей восстания машин
Музей восстания машин Презентация "Художники пореформенной России" - скачать презентации по МХК
Презентация "Художники пореформенной России" - скачать презентации по МХК Хочу отдыхать
Хочу отдыхать Сенситивные периоды человека (методика Марии Монтессори)
Сенситивные периоды человека (методика Марии Монтессори)