Содержание
- 2. Цель: Рассмотреть формы существования кремния как химического элемента: атомы, простые вещества и важнейшие соединения. Сравнить с
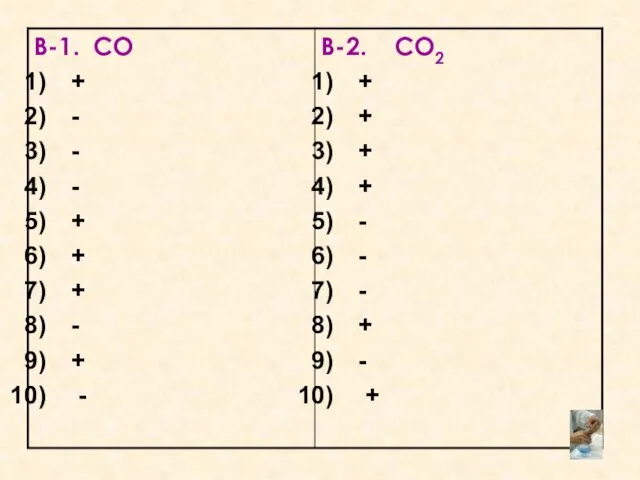
- 3. Графический диктант. Взаимопроверка. Оценка «5» - 10 правильных ответов. Оценка «4» - 8,9 правильных ответов. Оценка
- 5. Оглавление: Кремний – химический элемент (характеристика элемента по положению в ПСХЭ). Кремний – простое вещество (аллотропные
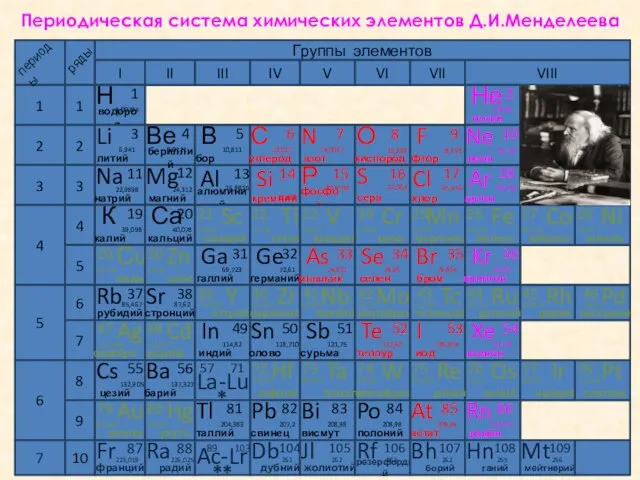
- 6. Периодическая система химических элементов Д.И.Менделеева Группы элементов I II III IV V VI 1 1 2
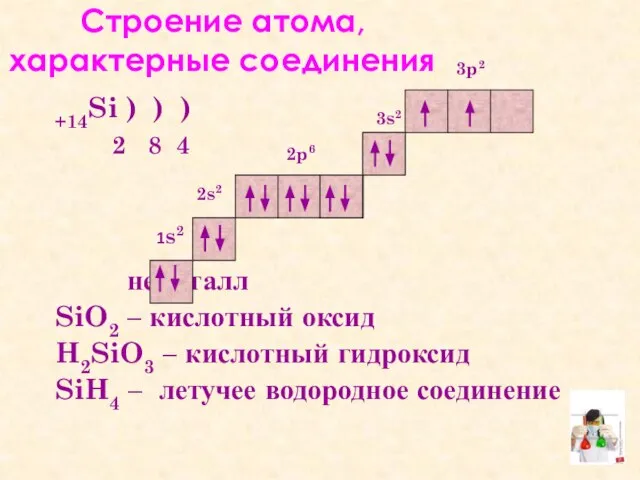
- 7. Cтроение атома, характерные соединения +14Si ) ) ) 2 8 4 неметалл SiO2 – кислотный оксид
- 8. Аллотропные модификации Аморфный Кристаллический бурый порошок, кристаллическая не имеет определенной решетка – атомная, температуры плавления. аналогична
- 9. Химические свойства кремния: 1) Реагирует с неметаллами (О2, F2, С) Si + O2 → SiO2 ;
- 10. Si – 27,6% в земной коре (2 место после кислорода) Кремнезем – SiO2 (песок, кварц; опалы
- 11. Сравнение оксида углерода (IV) и оксида кремния.
- 12. Сравнение оксида углерода (IV) и оксида кремния.
- 13. Кремниевая кислота – Н2SiO3 (Н2SiO3)n 1. Является полимером, структурные звенья которой имеют тетраэдрическое строение. 2. Не
- 15. 1. Вещества, с которыми реагирует оксид кремния: а) HCl, б)C, в)HF, г)K2CO3, д)CaO, е)H2O, ж)NaOH. 2.
- 16. 1. Вещества, с которыми реагирует оксид кремния: а) HCl, б)C, в)HF, г)K2CO3, д)CaO, е)H2O, ж)NaOH. 2.
- 17. 1. Вещества, с которыми реагирует оксид кремния: а) HCl, б)C, в)HF, г)K2CO3, д)CaO, е)H2O, ж)NaOH. 2.
- 18. 1. Вещества, с которыми реагирует оксид кремния: а) HCl, б)C, в)HF, г)K2CO3, д)CaO, е)H2O, ж)NaOH. 2.
- 19. 9 класс Выполните тренировочный тест:
- 20. Оксид серы (IV) называют: а) серным ангидридом, б) сернистым газом, в) триоксидом серы, г) сернистым ангидридом,
- 21. 3. Оксид серы (IV) в воде: а) мало растворяется, б) хорошо растворяется, в) плохо растворяется. 4.
- 22. 6. При н.у. сернистый ангидрид является: а) твердым веществом, б) жидким веществом, в) газообразным веществом. 7.
- 23. 9. Соль NaHSO3 называют: а) сульфитом натрия, б) сульфатом натрия, в) гидросульфитом натрия, г) гидросульфатом натрия.
- 24. 11. Сильной кислотой является: а) сернистая кислота, б) сероводородная, в) серная кислота. 12. Серная кислота проявляет:
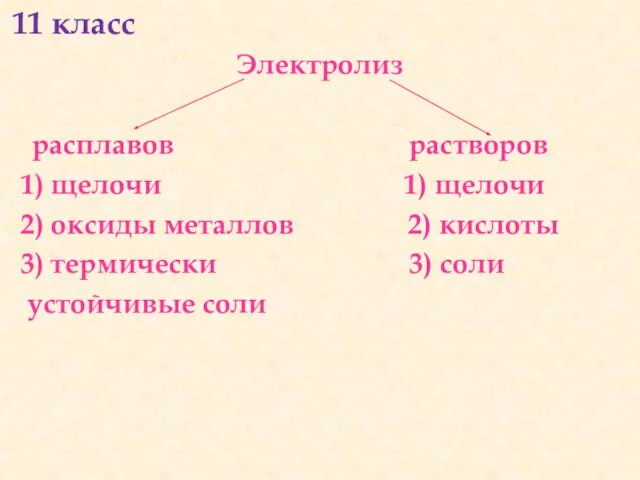
- 25. 11 класс Электролиз расплавов растворов 1) щелочи 1) щелочи 2) оксиды металлов 2) кислоты 3) термически
- 26. Порядок разрядки анионов(на аноде): 1. Бескислородные анионы: S2-, I-, Br-, Cl-, и анионы органических кислот 2RCOO-
- 27. Порядок разрядки катионов (на катоде): 1. Катионы металлов, расположенных в ряду напряжений металлов после Н2. 2.
- 29. Скачать презентацию






















 webp
webp Пьеса На Дне
Пьеса На Дне Моя история tatto
Моя история tatto Безударная гласная
Безударная гласная Классицизм в архитектуре, искусстве, литературе, музыке
Классицизм в архитектуре, искусстве, литературе, музыке Роль налогов в жизни людей
Роль налогов в жизни людей Контроль качества уборки номеров в гостинице
Контроль качества уборки номеров в гостинице Peter Piper
Peter Piper «Общественное движение людей с инвалидностью как фактор модификации публичной сферы (на примере социокультурных проектов РООИ «
«Общественное движение людей с инвалидностью как фактор модификации публичной сферы (на примере социокультурных проектов РООИ « Профессиональные стандарты педагогических работников: изменения и нововведения
Профессиональные стандарты педагогических работников: изменения и нововведения Биосфера — живая оболочка Земли
Биосфера — живая оболочка Земли Tribes and small nations
Tribes and small nations OKiR_Lektsia_5
OKiR_Lektsia_5 Презентация на тему День космонавтики 12 апреля
Презентация на тему День космонавтики 12 апреля Классификация способов сварки давлением
Классификация способов сварки давлением ЭЛЕКТРОННАЯ ШКОЛА
ЭЛЕКТРОННАЯ ШКОЛА Презентация на тему Планирование классного руководителя
Презентация на тему Планирование классного руководителя Служба войск и ее задачи
Служба войск и ее задачи НОУ Школа карвинга
НОУ Школа карвинга Презентация на тему УПРАВЛЕНИЕ ТАМОЖЕННЫМ ДЕЛОМ В ТАМОЖЕННОМ СОЮЗЕ: ТЕОРЕТИКО-ПРАВОВОЙ АСПЕКТ
Презентация на тему УПРАВЛЕНИЕ ТАМОЖЕННЫМ ДЕЛОМ В ТАМОЖЕННОМ СОЮЗЕ: ТЕОРЕТИКО-ПРАВОВОЙ АСПЕКТ  Product placement в кинематографе
Product placement в кинематографе Сделки в гражданском праве
Сделки в гражданском праве Поля листа
Поля листа The museum. Информация о студии
The museum. Информация о студии Кальцимилк молочные конфеты, обогащенные кальцием, магнием, витаминами С и D 3.
Кальцимилк молочные конфеты, обогащенные кальцием, магнием, витаминами С и D 3. Мораль как форма общественного сознания Подготовила: Студентка группы Т-114с Климушина Юлия
Мораль как форма общественного сознания Подготовила: Студентка группы Т-114с Климушина Юлия Лыжные гонки. Зимние виды спорта
Лыжные гонки. Зимние виды спорта Падежи имени существительного
Падежи имени существительного