Содержание
- 2. Квантовые числа Главное квантовое число n определяет энергетические уровни электрона в атоме. n = 1,2,3,… L
- 3. Орбитальное квантовое число Принимает значения l = 0, 1, 2,…(n - 1) Определяет величину момента импульса
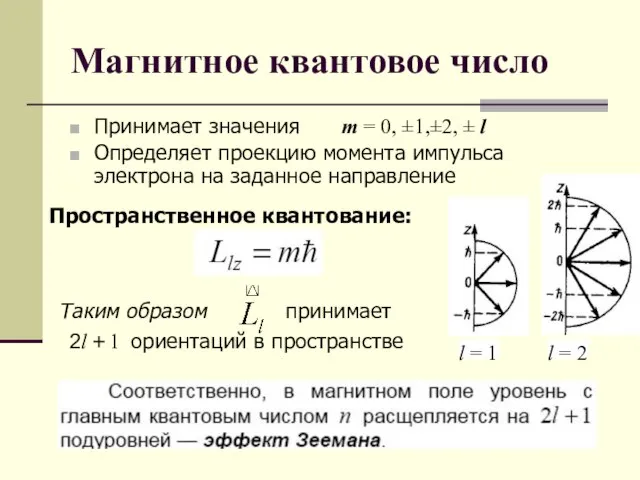
- 4. Магнитное квантовое число Принимает значения m = 0, ±1,±2, ± l Определяет проекцию момента импульса электрона
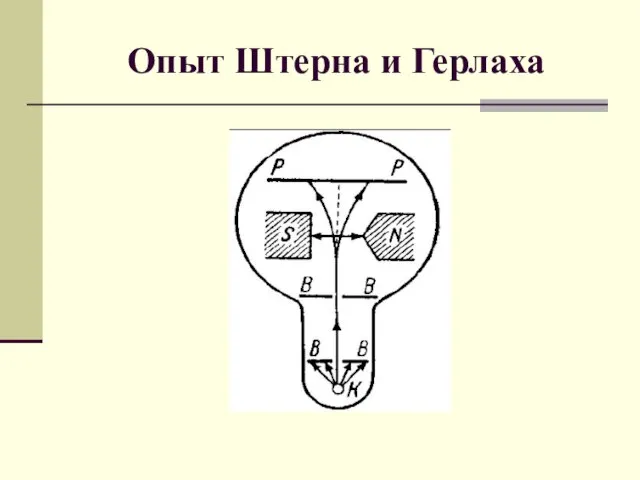
- 5. Опыт Штерна и Герлаха
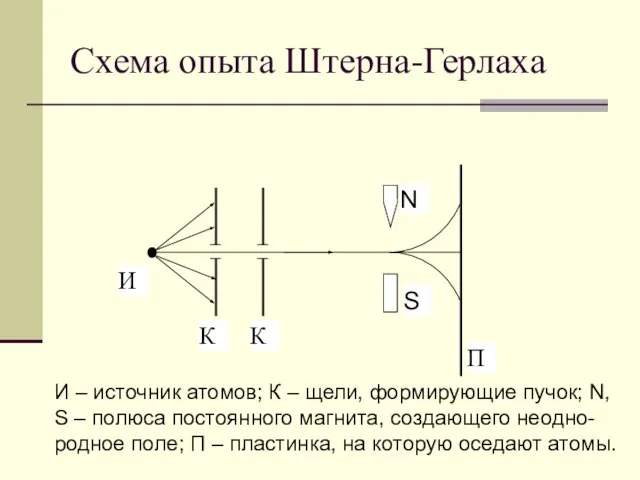
- 6. Схема опыта Штерна-Герлаха И – источник атомов; К – щели, формирующие пучок; N, S – полюса
- 7. Результаты опыта Штерна-Герлаха
- 8. Спиновое квантовое число (спин) Спин - собственный механический момент импульса электрона s = ½ — спиновое
- 9. Принцип Паули. Распределение электронов в атоме.
- 10. Состояние электрона в атоме определяется набором квантовых чисел
- 11. Правила отбора Переходы между электронными состояниями возможны только в том случае, если: 1) изменение ∆l орбитального
- 12. Принцип Паули В одном и том же атоме не может быть более одного электрона с одинаковым
- 13. Распределение электронов в атоме по состояниям Совокупность электронов в многоэлектронном атоме, имеющих одно и то же
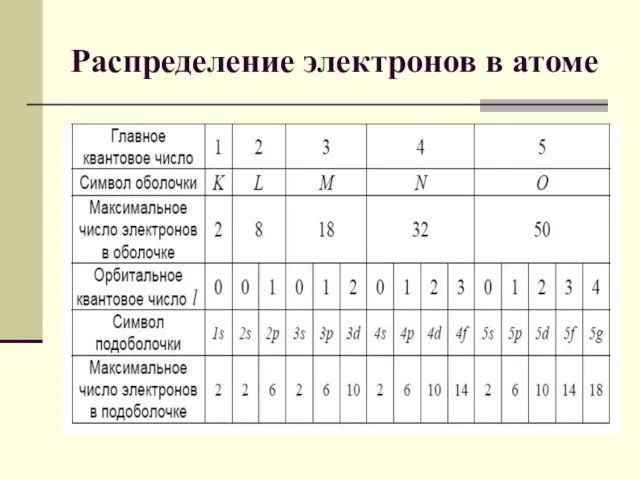
- 14. Распределение электронов в атоме
- 15. Периодическая система элементов Д.И.Менделеева Дмитрий Иванович МЕНДЕЛЕЕВ (8.II.1834 - 2.II.1907) - великий русский ученый-энциклопедист, химик, физик,
- 16. Теория периодической системы элементов Д.И.Менделеева Порядковый номер химического элемента равен общему числу электронов в атоме данного
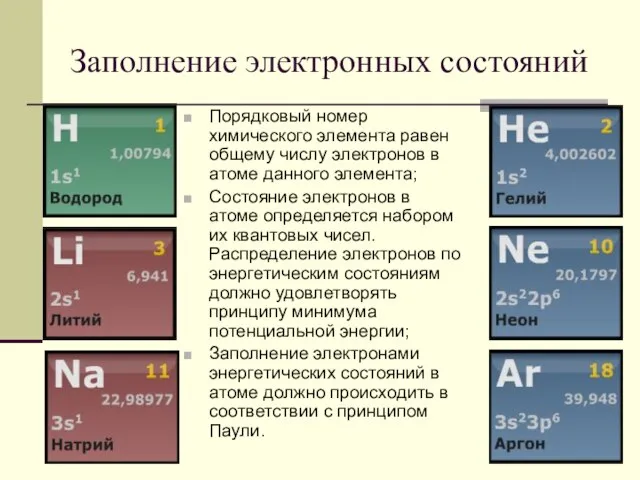
- 17. Заполнение электронных состояний Порядковый номер химического элемента равен общему числу электронов в атоме данного элемента; Состояние
- 19. Скачать презентацию











 Отряд Мозоленогие. Верблюды
Отряд Мозоленогие. Верблюды Практический семинар«Проектирование мультимедийного урока»
Практический семинар«Проектирование мультимедийного урока» Учителя МОКУ СОШ №2 г. Лузы Кировской области
Учителя МОКУ СОШ №2 г. Лузы Кировской области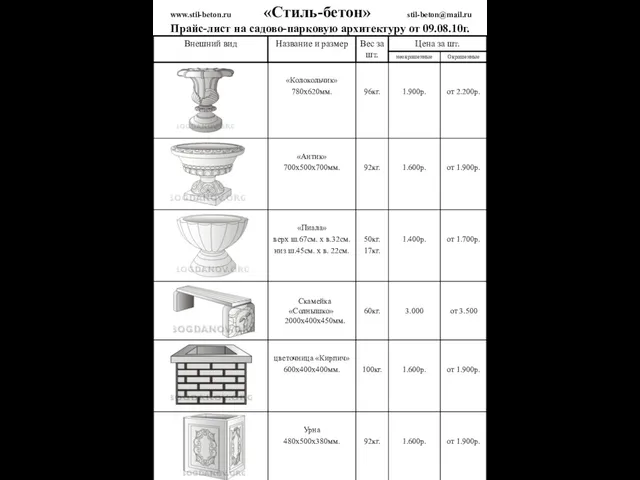 www.stil-beton.ru «Стиль-бетон»
www.stil-beton.ru «Стиль-бетон»  Гармония звуков, образов, красок в пейзажной лирике русских поэтов(А.А.Фета, Ф.И.Тютчева,Я.П.Полонского).
Гармония звуков, образов, красок в пейзажной лирике русских поэтов(А.А.Фета, Ф.И.Тютчева,Я.П.Полонского). Подготовка к ЕГЭ по русскому языку. Работа с микротекстом
Подготовка к ЕГЭ по русскому языку. Работа с микротекстом Коммуникационные технологии
Коммуникационные технологии Допрос, очная ставка: понятие, особенности, порядок осуществления. Подготовила: Калужина Ю.К.
Допрос, очная ставка: понятие, особенности, порядок осуществления. Подготовила: Калужина Ю.К. Современные информационные технологии в деятельности педагогов
Современные информационные технологии в деятельности педагогов Пятно как средство выражения. (Ритм пятен)
Пятно как средство выражения. (Ритм пятен) Тема презентации. Шаблон
Тема презентации. Шаблон Виды невербальных средств коммуникации
Виды невербальных средств коммуникации ЗЕМЛЯ ВОКРУГ ШЕРЕМЕТЬЕВО
ЗЕМЛЯ ВОКРУГ ШЕРЕМЕТЬЕВО Сертификат на предоставление дисконта к процентной ставке
Сертификат на предоставление дисконта к процентной ставке Talking About Writing
Talking About Writing Как излагать тему на Альфе
Как излагать тему на Альфе  Клубы микрорайона
Клубы микрорайона Техник-технолог хлебопекарного производства
Техник-технолог хлебопекарного производства Чешки для вашего ребенка
Чешки для вашего ребенка Упражнения для тренировки дома
Упражнения для тренировки дома Архитектурное законодательство и нормирование
Архитектурное законодательство и нормирование Great British Sporting Events!
Great British Sporting Events! Презентация на тему Нарушения темпа речи
Презентация на тему Нарушения темпа речи  Правовая группа. Интеллектуальная собственность
Правовая группа. Интеллектуальная собственность Сарсенбаев Ерсултан
Сарсенбаев Ерсултан Конституция – основной закон страны
Конституция – основной закон страны Средневековая Европа и Византия: 2 пути исторического развития
Средневековая Европа и Византия: 2 пути исторического развития Установление фактов, имеющих юридическое значение
Установление фактов, имеющих юридическое значение