Слайд 2Обратимые и необратимые процессы
Обратимым называют процесс, допускающий возможность возвращения системы в первоначальное

состояние без того, чтобы в окружающей среде остались какие-либо изменения
Обратимым может быть лишь равновесный процесс, но не всякий равновесный процесс обратим
Слайд 3Обратимые и необратимые процессы
Пример. Рассмотрим систему из газа, находящегося в цилиндре под
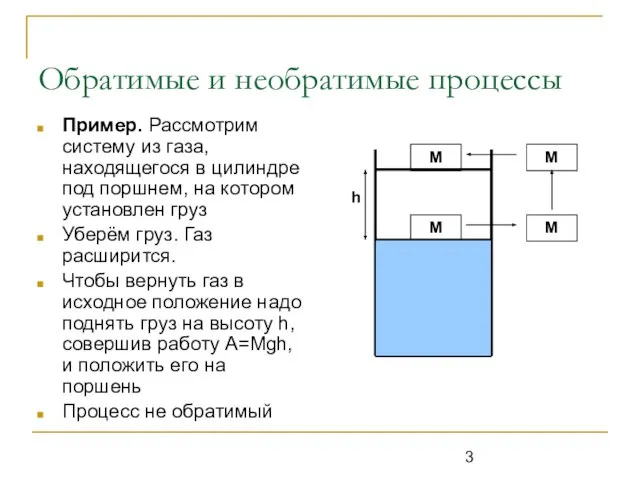
поршнем, на котором установлен груз
Уберём груз. Газ расширится.
Чтобы вернуть газ в исходное положение надо поднять груз на высоту h, совершив работу A=Mgh, и положить его на поршень
Процесс не обратимый
Слайд 4Обратимые и необратимые процессы
Разобьём груз на две равных части
Теперь, чтобы расширить и
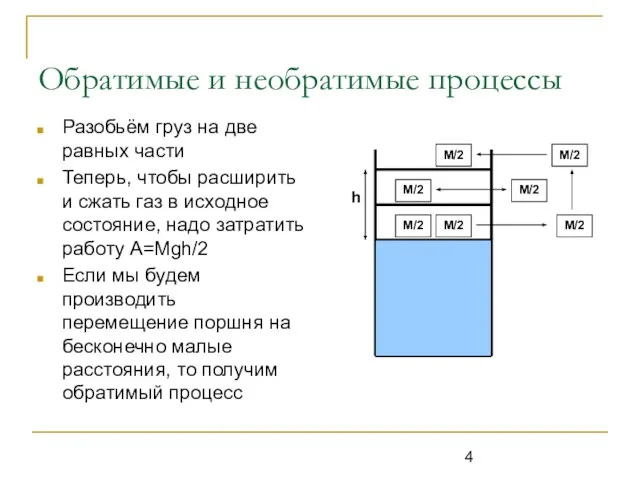
сжать газ в исходное состояние, надо затратить работу A=Mgh/2
Если мы будем производить перемещение поршня на бесконечно малые расстояния, то получим обратимый процесс
Слайд 5Обратимые и необратимые процессы
Пример равновесного необратимого процесса – теплообмен
Компенсацией за осуществление необратимых

круговых процессов является перевод энергии из одной формы в другую. В этом проявляется неэквивалентность различных форм энергии
Тепловая энергия оказывается менее ценным видом энергии, чем другие
Слайд 6Второе начало термодинамики
Второе начало термодинамики констатирует неэквивалентность различных видов энергии. Оно постулирует

направление протекания тепловых процессов
Формулировка Клаузиуса: Теплота не может самопроизвольно переходить от тела менее нагретого к более нагретому
Слайд 7Второе начало термодинамики
Формулировка Томсона. Невозможен круговой процесс, единственным результатом которого было бы

совершение работы за счёт охлаждения теплового резервуара
Устройство, которое позволяло бы осуществлять этот процесс, называется вечным двигателем второго рода
Слайд 8Второе начало термодинамики
Второе начало Т.Д. накладывает запрет на вечный двигатель второго рода
Из

второго начала Т.Д. можно получить множество конкретных результатов с помощью метода циклов и метода термодинамических функций
Слайд 9Тепловые двигатели
Тепловой двигатель – это устройство, в котором совершается циклический Т.Д. процесс
В
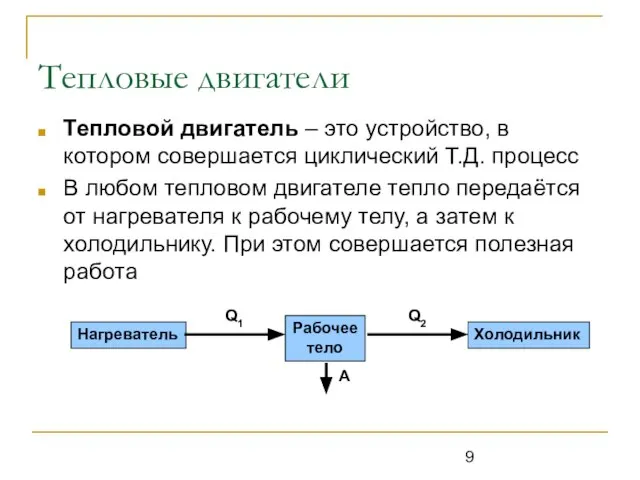
любом тепловом двигателе тепло передаётся от нагревателя к рабочему телу, а затем к холодильнику. При этом совершается полезная работа
Слайд 11Метод циклов
В циклическом процессе ΔU=0 → Q=A=Q1-Q2
При переходе 1→2 работа совершается системой,

а при переходе 2→1 над системой
При переходе 1'→2‘ тепло передаётся системе, а при переходе 2'→1' от системы
КПД теплового двигателя η=A/Q1=(Q1-Q2)/Q1
Слайд 12Цикл Карно
Цикл Карно состоит из двух изотерм и двух адиабат
Теплоёмкости в адиабатическом
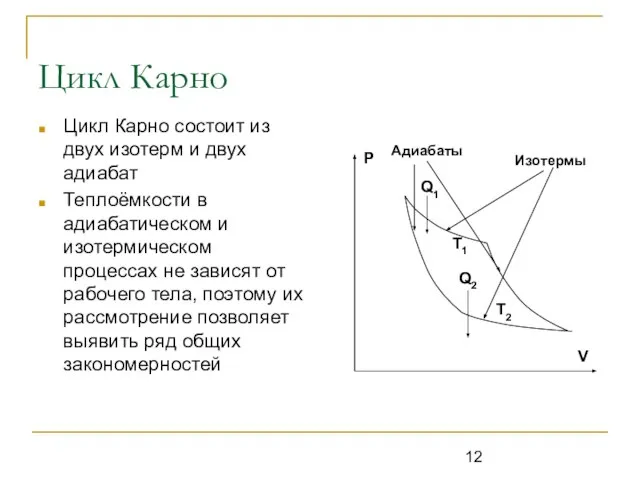
и изотермическом процессах не зависят от рабочего тела, поэтому их рассмотрение позволяет выявить ряд общих закономерностей
Слайд 13Цикл Карно
Первая теорема Карно: Коэффициент полезного действия тепловой машины, работающей по циклу

Карно, зависит только от температур нагревателя и холодильника и не зависит от устройства машины и типа рабочего тела
Слайд 14Цикл Карно
Для идеального газа:
Q1=RT1ln(V2/V1)
Q2=RT2ln(V4/V3)
A=Q1-Q2=RT1ln(V2/V1)-RT2ln(V3/V4)
η=A/Q1=[RT1ln(V2/V1)-RT2ln(V3/V4)]/RT1ln(V2/V1)
Из уравнения адиабаты:
TVγ-1=const
![Цикл Карно Для идеального газа: Q1=RT1ln(V2/V1) Q2=RT2ln(V4/V3) A=Q1-Q2=RT1ln(V2/V1)-RT2ln(V3/V4) η=A/Q1=[RT1ln(V2/V1)-RT2ln(V3/V4)]/RT1ln(V2/V1) Из уравнения адиабаты: TVγ-1=const](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/424407/slide-13.jpg)
Слайд 15Цикл Карно
T1V1γ-1= T2V4γ-1 и T1V2γ-1= T2V3γ-1 →
V2/V1=V3/V4 →
η=(T1-T2)/T1=1-T2/T1
Для повышения КПД надо

повышать температуру нагревателя и понижать температуру холодильника
η=(Q1-Q2)Q1=(T1-T2)/T1 →
Q1/T1=Q2/T2
Величина Q/T называется приведённой теплотой
Слайд 16Цикл Карно
Вторая теорема Карно: КПД любого цикла не может быть больше, чем
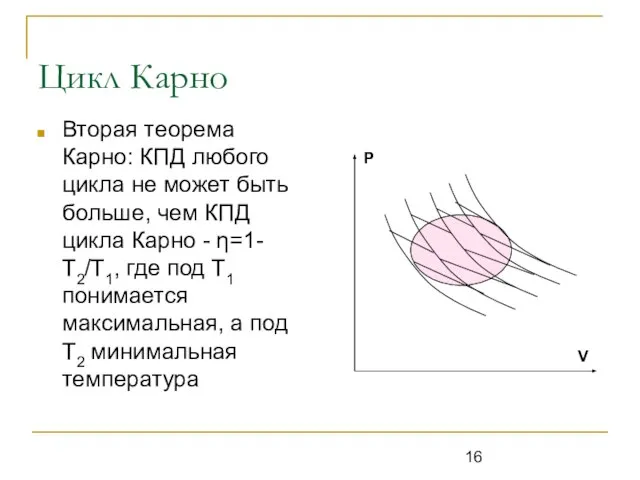
КПД цикла Карно - η=1-Т2/Т1, где под Т1 понимается максимальная, а под Т2 минимальная температура
Слайд 17Энтропия
Рассмотрим произвольный равновесный цикл. Аппроксимируем его малыми циклами Карно
Для каждого цикла К
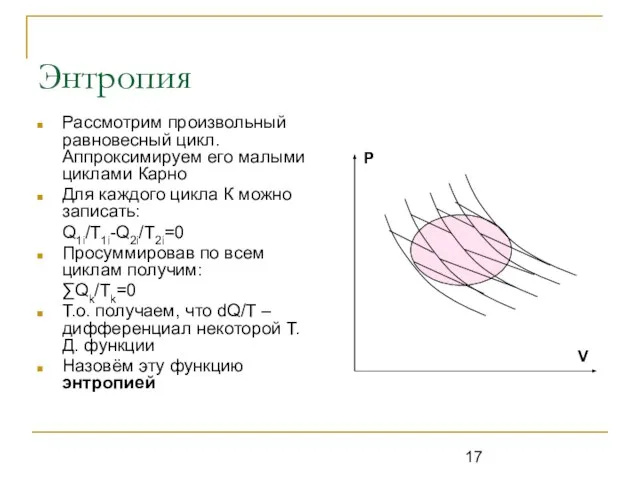
можно записать:
Q1i/T1i-Q2i/T2i=0
Просуммировав по всем циклам получим:
∑Qk/Tk=0
Т.о. получаем, что dQ/T – дифференциал некоторой Т.Д. функции
Назовём эту функцию энтропией
Слайд 18Энтропия
Энтропия – это такая функция состояния, дифференциал которой связан с элементарным тепловым

эффектом в обратимом процессе соотношением:
dQ=TdS (*)
Энтропия S имеет размерность теплоёмкости
С учётом (*) первое начало Т.Д. можно выразить как:
TdS=dU+PdV
Отсюда, зная термическое и калорическое уравнения, состояния можно найти зависимость энтропии от Т.Д. параметров
Слайд 19Энтропия
Найдём энтропию идеального газа
Из dU=cVdT и P/T=R/V следует что:
dS=cVdT/T+RdV/V → S(T,V)=cVlnT+RlnV
при cV=const
Можно

S выразить через T и P:
S(T,P)=cPlnT-RlnP
Слайд 20Энтропия
Определение энтропии через теплоту встречает одну трудность. В точке Т=0 интеграл ∫dQ/T

может расходиться
Эта неопределённость устраняется постулатом Нернста, называемым иногда третьим началом термодинамики
Слайд 21Постулат Нернста
Постулат Нернста сводится к двум утверждениям:
При приближении к абсолютному нулю энтропия

стремится к определённому конечному пределу. Можно положить S(Т=0)=0
Все равновесные процессы при Т=0 происходят без изменения энтропии. В частности, при Т=0 S не зависит от объёма
Слайд 22Статистическая интерпретация энтропии
Вероятность состояния пропорциональна его статистическому весу Ω, т.е. числу микроскопических

способов, которым может быть осуществлено данное макросостояние
Разобьём некоторую Т.Д. систему на две подсистемы, которые находятся в состояниях со стат. весами Ω1 и Ω2
Число способов, которыми может реализоваться данное состояние системы:
Ω=Ω1⋅Ω2
Слайд 23Статистическая интерпретация энтропии
Т.о. логарифм стат. веса является аддитивной функцией состояния системы:
lnΩ=lnΩ1+lnΩ2
Энтропия системы:
S=k⋅lnΩ (**)
где

k – постоянная Больцмана
Формула (**) называется формулой Больцмана
Слайд 24Статистическая интерпретация энтропии
Т.к. равновесным состоянием является состояние с наибольшим стат. весом (и

наибольшей энтропией), то можно заключить, что при протекании необратимых процессов энтропия изолированной системы возрастает
Энтропия системы, находящейся в равновесном состоянии, максимальна
Слайд 25Статистическая интерпретация энтропии
При протекании обратимых процессов энтропия изолированной системы остаётся постоянной
Энтропия равновесной

системы не остаётся строго постоянной она претерпевает флуктуации
Второй закон термодинамики, иногда называемый законом возрастания энтропии, утверждает, что энтропия изолированной системы может только возрастать либо оставаться неизменной:
ΔS≥0












![Цикл Карно Для идеального газа: Q1=RT1ln(V2/V1) Q2=RT2ln(V4/V3) A=Q1-Q2=RT1ln(V2/V1)-RT2ln(V3/V4) η=A/Q1=[RT1ln(V2/V1)-RT2ln(V3/V4)]/RT1ln(V2/V1) Из уравнения адиабаты: TVγ-1=const](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/424407/slide-13.jpg)











 Умеем ли мы прощать
Умеем ли мы прощать Управление образования администрации МО Красноармейский район Методические особенности введения учебного предмета ОРКСЭ Об изу
Управление образования администрации МО Красноармейский район Методические особенности введения учебного предмета ОРКСЭ Об изу Растения и животные
Растения и животные Презентация на тему Инфаркт миокарда
Презентация на тему Инфаркт миокарда Русская печь
Русская печь Поверхностное натяжение жидкостей
Поверхностное натяжение жидкостей Вводные слова
Вводные слова Животные живого уголка (2 класс)
Животные живого уголка (2 класс) Презентация на тему Простейшие Жгутиковые
Презентация на тему Простейшие Жгутиковые  Outcomes unit 11
Outcomes unit 11 Сколько треугольников? Четырехугольников?
Сколько треугольников? Четырехугольников? Готовность образовательных учреждений Сретенского района к работе по переходу на новые механизмы аттестации педагогических раб
Готовность образовательных учреждений Сретенского района к работе по переходу на новые механизмы аттестации педагогических раб Конспект занятия по развитию речив подготовительной группе детского сада на тему: «Музей почтовых принадлежностей» (с использов
Конспект занятия по развитию речив подготовительной группе детского сада на тему: «Музей почтовых принадлежностей» (с использов Образец оформления презентации для выступления
Образец оформления презентации для выступления HR бюджет – как превратить затраты в инвестиции Фацер Россия Татьяна Юркевич, директор по персоналу
HR бюджет – как превратить затраты в инвестиции Фацер Россия Татьяна Юркевич, директор по персоналу Синтетические каучуки, строение, свойства, применение
Синтетические каучуки, строение, свойства, применение Своеобразие поэзии Сергея Есенина
Своеобразие поэзии Сергея Есенина Основные информационные угрозы и состояние информационной безопасности
Основные информационные угрозы и состояние информационной безопасности  Умножение и деление многозначных чисел
Умножение и деление многозначных чисел Курс для тех, кто берет ответственность за свою жизнь и хочет помочь себе сам
Курс для тех, кто берет ответственность за свою жизнь и хочет помочь себе сам Студенческий сервисный отряд Сириус. Викторина
Студенческий сервисный отряд Сириус. Викторина О заболеваниях мочеполовой системы не принято говорить вслух, но бросать эти недуги на самотек опасно для здоровья, поэтому в данн
О заболеваниях мочеполовой системы не принято говорить вслух, но бросать эти недуги на самотек опасно для здоровья, поэтому в данн Срочно требуется грузчики, кассиры, работники торгового зала, продавцы. Работа в Липецке и Липецкой области
Срочно требуется грузчики, кассиры, работники торгового зала, продавцы. Работа в Липецке и Липецкой области Сфера духовной культуры
Сфера духовной культуры Бизнес проект : SportFaza (SF) - спортивно-оздоровительный тренажерный зал
Бизнес проект : SportFaza (SF) - спортивно-оздоровительный тренажерный зал Защита бренда. Информация для стюардов
Защита бренда. Информация для стюардов Технология ремонтно-отделочных работ
Технология ремонтно-отделочных работ Подробнее о кремах. Секрет Парацельса
Подробнее о кремах. Секрет Парацельса