Содержание
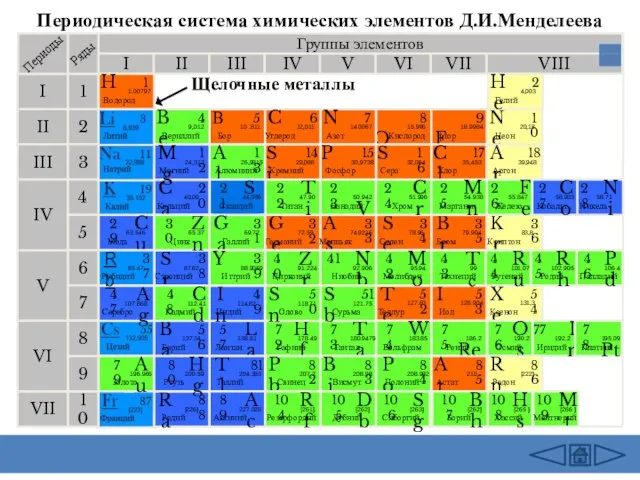
- 3. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
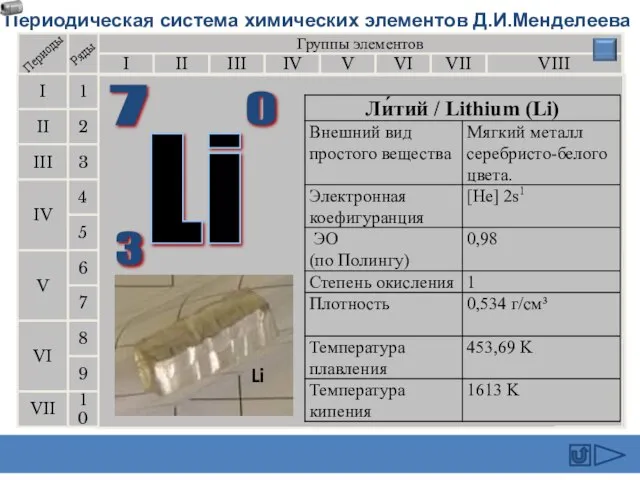
- 4. Происхождение названий щелочных металлов Li (1817) лат. " литос" - камень Na (1807) араб. "натрум" -сода
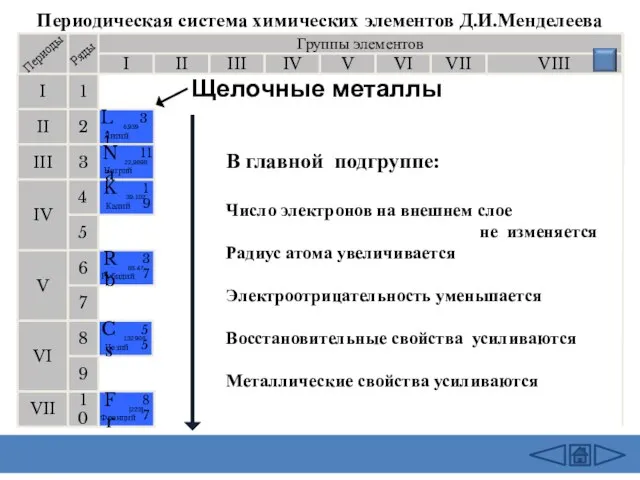
- 5. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 6. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ Li Na K Rb Cs Fr 7 23 39
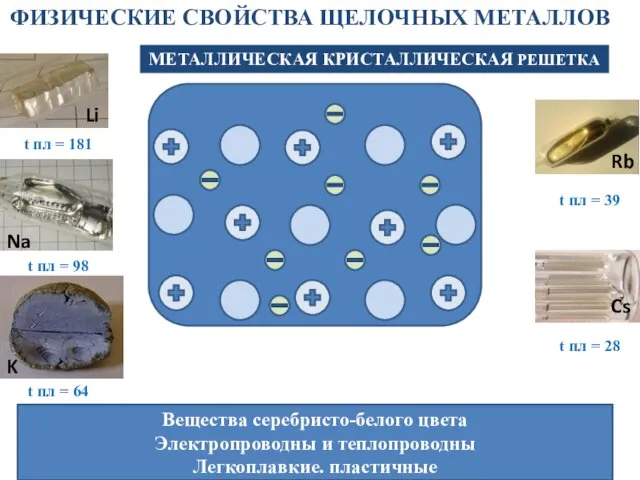
- 7. ФИЗИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ МЕТАЛЛИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА Вещества серебристо-белого цвета Электропроводны и теплопроводны Легкоплавкие. пластичные t
- 8. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 9. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 10. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 11. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 12. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
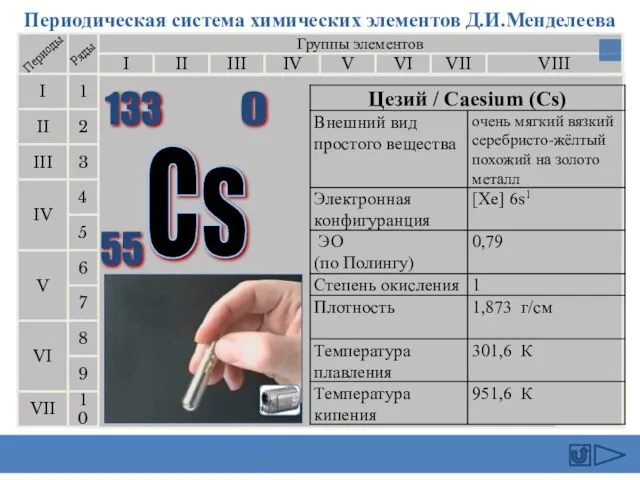
- 13. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 14. Сподуменн
- 15. Галит
- 16. Природные соединения калия Сильвин
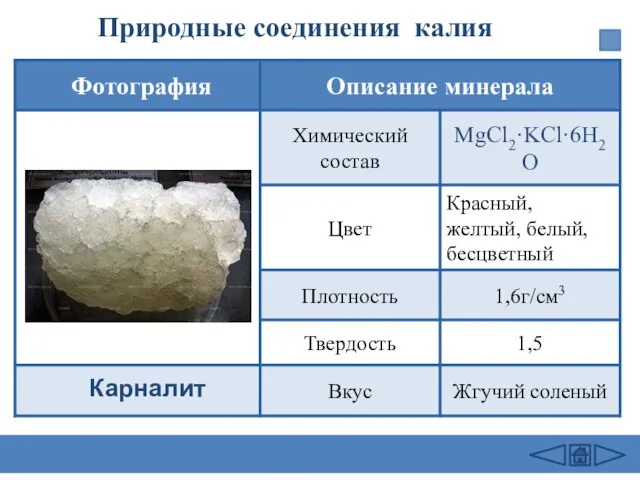
- 17. Природные соединения калия Карналит
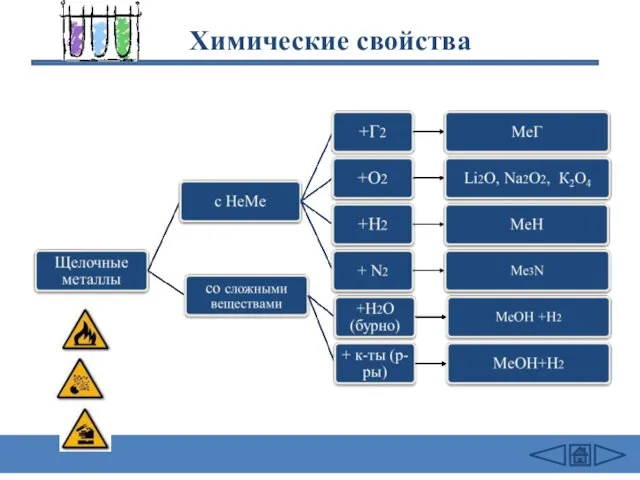
- 18. Химические свойства
- 19. Химические свойства 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются) 4Li
- 20. Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое
- 21. БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ СОЕДИНЕНИЙ КАЛИЯ И НАТРИЯ ответ ответ ответ NaCl Кристалли-ческая сода Na2CO3*10H2O Питьевая
- 22. 1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О
- 23. Соединения щелочных металлов Гидроксиды: NaOH – едкий натр, каустическая сода, каустик КОН – едкое кали 2.
- 24. Физические свойства щелочных металлов Щелочные металлы - серебристо–белые вещества, за исключением цезия - серебристо-желтого цвета, с
- 25. 1. В ряду от лития к францию атомный радиус: уменьшается не изменяется увеличивается 2. Степень окисления
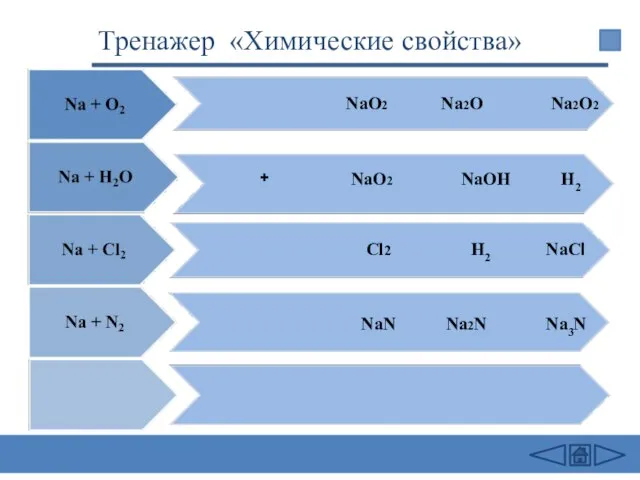
- 26. + NаО2 Nа2O2 NаОН NaCl Na2N Na3N NаО2 Cl2 NaN Na2O H2 H2 Тренажер «Химические свойства»
- 27. Проверь себя: ☺ Вычеркните неверное суждение о щелочных металлах: 1. Число электронов на внешнем энергетическом уровне
- 29. Скачать презентацию


















 Проект линии по выработке булки ярославской сдобной
Проект линии по выработке булки ярославской сдобной Заимствования в русском языке из английского
Заимствования в русском языке из английского Концепция электронной библиотеки лучших практик работы некоммерческого сектора в Свердловской области
Концепция электронной библиотеки лучших практик работы некоммерческого сектора в Свердловской области Презентация на тему Романтические произведения М. Горького
Презентация на тему Романтические произведения М. Горького  Издержки фирмы в долгосрочном периоде
Издержки фирмы в долгосрочном периоде Современные средства поражения (продолжение). Занятие №10, часть 2
Современные средства поражения (продолжение). Занятие №10, часть 2 кп.ppt
кп.ppt Как открыть брокерский счет
Как открыть брокерский счет Режиссер-постановщик: Владимир Бортко. Автор сценария: Наталия Бортко. По одноименной повести Михаила Афанасьевича Булгакова Опе
Режиссер-постановщик: Владимир Бортко. Автор сценария: Наталия Бортко. По одноименной повести Михаила Афанасьевича Булгакова Опе Welcome программа
Welcome программа МЕЖДУНАРОДНАЯ ЭКОНОМИЧЕСКАЯ ИНТЕГРАЦИЯ
МЕЖДУНАРОДНАЯ ЭКОНОМИЧЕСКАЯ ИНТЕГРАЦИЯ  Компьютерное моделирование
Компьютерное моделирование Презентация на тему Обзор программ по музыкальному воспитанию детей дошкольного возраста
Презентация на тему Обзор программ по музыкальному воспитанию детей дошкольного возраста Типовое проектирование ИС
Типовое проектирование ИС Памятка застройщику по вопросам размещения информации в ЕИСЖС_pptx (1)
Памятка застройщику по вопросам размещения информации в ЕИСЖС_pptx (1) Рисунок дает форму существам, а цвет дает им жизнь
Рисунок дает форму существам, а цвет дает им жизнь Возможности первичной профсоюзной организации студентов в вопросах назначения академической и государственной стипендий
Возможности первичной профсоюзной организации студентов в вопросах назначения академической и государственной стипендий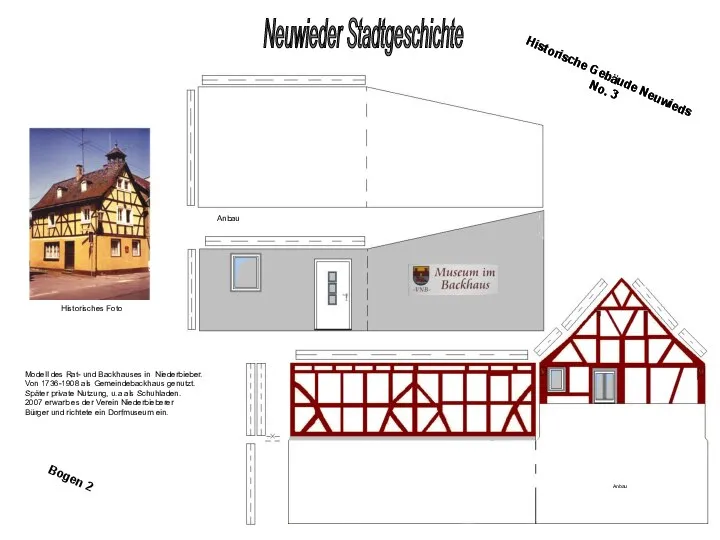 Historisches Foto
Historisches Foto Музей почетных граждан Санкт-Петербурга и истории микрорайона Коломяги
Музей почетных граждан Санкт-Петербурга и истории микрорайона Коломяги Управление персоналом
Управление персоналом Жостово. Роспись по металлу
Жостово. Роспись по металлу Международный маркетинг
Международный маркетинг Рекомендация родителям: как правильно воспринимать отметки
Рекомендация родителям: как правильно воспринимать отметки Инвентаризация НЗП и расходов будущих периодов. Тема 3.4
Инвентаризация НЗП и расходов будущих периодов. Тема 3.4 СОВЕТ СТАРШЕКЛАССНИКОВ«ЛИДЕР»
СОВЕТ СТАРШЕКЛАССНИКОВ«ЛИДЕР» Явления природы (1 класс)
Явления природы (1 класс) Зимние забавы (сочинение)
Зимние забавы (сочинение) Построение чертежа клиньевой юбки
Построение чертежа клиньевой юбки