Слайд 2Что значит научить решать задачи?
Научить решать задачи, значит:
Думать
Размышлять
Представлять
Анализировать
Делать выводы

Слайд 3Способы решения задач
Соотношение масс веществ
Сравнение масс веществ
Приведение к единице
Метод пропорции
С использованием величины

«n»
С использованием коэффициента пропорциональности
Алгебраический
Наглядно-образный
Таблично-схематичный
Слайд 4Алгебраический
Задача:
Вычислить массу сульфата натрия, необходимую для реакции с серной кислотой для

получения 16г. сернистого газа
Слайд 5Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O
m(Na2SO3)= n(Na2SO3)*M(Na2SO3) =
n(SO2)* M(Na2SO3) =

m(SO2)/M(SO2)* M(Na2SO3)
Слайд 6Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O
…массу 15%-ного раствора сульфита

натрия…
Слайд 7Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O
m(р-ра Na2SO3)= m(Na2SO3)/w =
n(Na2SO3)*M(Na2SO3)/w =
n(SO2)*

M(Na2SO3)/w =
(m(SO2)*M(Na2SO3)/(M(SO2)*w)
Слайд 8Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O
…объем 15%-ного раствора сульфита натрия,

плотность 1,07г/мл.…
Слайд 9Na2SO3 + H2SO4 = Na2SO4 + SO2 +H2O
V(р-ра Na2 SO3)= m(р-ра Na2SO3)/g

=
m(Na2 SO3)/(w*g) =
n(Na2SO3)*M(Na2SO3)/(w*g) =
n(SO2)* M(Na2SO3)/(w*g) =
(m(SO2)*M(Na2SO3)/(M(SO2)*w*g)
Слайд 10Задача:
Вычислить массу железа, полученной из руды, содержащей 464г. магнитного железняка

Слайд 11Магнитный железняк- Fe3O4
Fe3O4 – 3Fe
m(Fe) = n(Fe)*M(Fe) =
3n(Fe3O4)* M(Fe) =
3*m(Fe3O4)* M(Fe)

/ M(Fe3O4)
Слайд 12Наглядно-образный
Задача:
Масса поваренной соли, которую следует растворить
в 250г. 10%-ного

раствора для получения 18%-ного рассола, равна ____г.
Слайд 13Наглядно-образный
+
=
NaCl
x
Раствор 1
250
250*0,1
В-во
225
вода
Раствор 2
X+250
x+25
(в-во)
225
(вода)
W=0,18

Слайд 14Наглядно-образный
Задача:
Для приготовления 2л.37%-ной аккумуляторной серной кислоты (плотность 1,29г/мл) потребуется 95%-ная серная

кислота массой _____г.
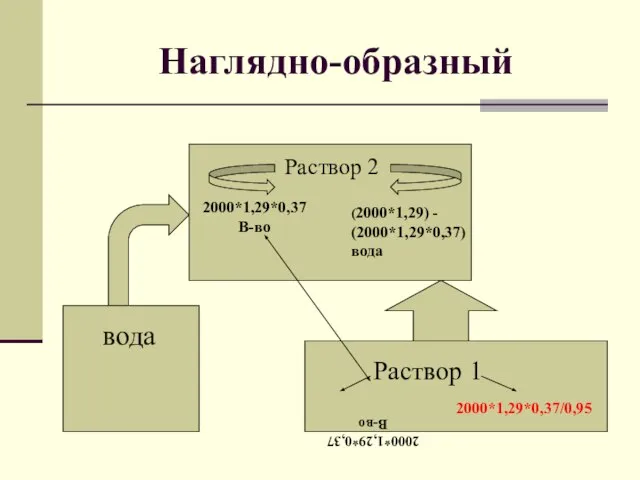
Слайд 15Наглядно-образный
Раствор 2
2000*1,29*0,37
В-во
(2000*1,29) - (2000*1,29*0,37)
вода
вода
Раствор 1
2000*1,29*0,37
В-во
2000*1,29*0,37/0,95
Слайд 16
Таблично-схематичный
Задача:
Определите состав раствора, полученного при растворении продукта окисления фосфора, полученного из

31г. фосфата кальция, в 200г. 8,4%-ного раствора гидроксида калия.
Слайд 17
Таблично-схематичный
Этапы работы:
Подготовительный – расчет «n» веществ
Основной – определение состава раствора

Слайд 18Подготовительный этап
Ca3(PO4)2 – 2P – P2O5
n(P2O5) = n(Ca3(PO4)2)
n(P2O5)= m(Ca3(PO4)2) / M (Ca3(PO4)2)

= 31/310 = 0,1 моль
n(KOH)= 200*0,084/56 = 0,3 моль
Слайд 19Основной этап
P2O5 + 6KOH = 2K3PO4 + 3H2O
Было 0,1 0,3
Изр. 0,3/6 0,3
Ост.

0,05 0 0,3/6*2=0,1
Слайд 20Основной этап
3H2O+P2O5 + 4K3PO4 =6K2HPO4
Было 0,05 0,1
Изр. 0,1/4 0,1
Ост. 0,025

0 0,1/4*6=0,15
Слайд 21Основной этап
3H2O+P2O5 + 2K2HPO4 =4KH2PO4
Было 0,025 0,15
Изр. 0,025 0,025*2
Ост. 0 0,1

0,025*4=0,1
Состав: K2HPO4 - 0,1
KH2PO4 - 0,1




















 Наполеон
Наполеон Цирк на проспекте Вернадского
Цирк на проспекте Вернадского Перекачка высоковязких и высокозастывающих нефтей
Перекачка высоковязких и высокозастывающих нефтей Швейцария
Швейцария Цель применения комплексных автоматизированных информационных систем управления
Цель применения комплексных автоматизированных информационных систем управления Навстречу ХХII зимним Олимпийским играм. Сочи 2014
Навстречу ХХII зимним Олимпийским играм. Сочи 2014 14 апреля 2005 г.
14 апреля 2005 г. Внедрение международных стандартов качества в розничном банке
Внедрение международных стандартов качества в розничном банке Эфирные масла
Эфирные масла Безопасность в сети интернет для 5-6 классов
Безопасность в сети интернет для 5-6 классов Colors. Red. Orange
Colors. Red. Orange Петербургская недвижимость. Слайды
Петербургская недвижимость. Слайды История развития кадастровых систем
История развития кадастровых систем Лес, как сказочное царство, Там кругом растут лекарства, В каждой травке, в каждой ветке- И микстура, и таблетки.
Лес, как сказочное царство, Там кругом растут лекарства, В каждой травке, в каждой ветке- И микстура, и таблетки. Органические вещества клетки
Органические вещества клетки UGC как инструмент удержания аудитории
UGC как инструмент удержания аудитории Наука биология
Наука биология Андрей Первозванный
Андрей Первозванный Гестационнный сахарный диабет
Гестационнный сахарный диабет 11
11 Инвестиционная деятельность
Инвестиционная деятельность Wide Range of UPVC Windows & Doors
Wide Range of UPVC Windows & Doors Сексуальное воспитание детей
Сексуальное воспитание детей Наука и техника в XIX веке
Наука и техника в XIX веке Алгоритм Чена
Алгоритм Чена Анализ финансовых отчетов
Анализ финансовых отчетов ПРОЕКТГеометрическая вероятность.
ПРОЕКТГеометрическая вероятность. Особенности проведения тестов на проникновение в организациях банковской сферы
Особенности проведения тестов на проникновение в организациях банковской сферы