Содержание
- 2. Минералогия как наука 1. Минералогия — наука о минералах, их составе, строении, свойствах, условиях образования и
- 3. Под минералом понимается продукт природных физико-химических процессов в земной коре или в космосе, обособленный от окружающей
- 4. Связь минералогии с геологическими науками
- 5. Деление минералогии: 1. минералогия земной коры: 2. минералогия мантии; 3. минералогия космоса; в зависимости от подходов
- 6. Конституция минералов Под конституцией минералов понимают химический состав и внутреннее строение минералов, которые взаимосвязаны между собой
- 7. Химический состав и свойства минералов В состав минералов входят почти все химические элементы таблицы Менделеева, однако
- 8. Минералы – химические соединения I.Гомоатомные соединения В случае образования минерала из одного химического элементf они называются
- 9. II. Простые соли (бинарные соединения) Простые соли в большинстве представляют собой бинарные соединениями, т.е. соединения в
- 10. III. Комплексные соединения Комплексные соединения – наиболее распространены в природе минералов. Они характеризуются определенными радикалами, т.е.
- 11. IV. Двойные соли Двойные соли - пользуются широким развитием в минеральном мире. Они представляют собой соединения,
- 12. Формулы минералов. Состав минерала обозначается химической формулой, которая условно отражает качественную и количественную характеристику слагающих минерал
- 13. Координационное число Число атомов ( ионов противоположного знака ), составляющих ближайшее окружение данного атома ( иона
- 14. Формы нахождения воды в минералах Вода – существенная составная часть многих минералов. Кроме этого процессы минералообразования
- 15. 2) Цеолитная вода – имеет место в так называемых цеолитах – минералах класса силикатах, которые имеют
- 17. Скачать презентацию
Слайд 2Минералогия как наука
1. Минералогия — наука о минералах, их составе, строении, свойствах,
Минералогия как наука
1. Минералогия — наука о минералах, их составе, строении, свойствах,

2. До недавнего времени к минералам относили лишь продукты природных процессов, возникшие в земной коре и входящие в ее состав. Изучение космического пространства, сведения о котором мы получаем в виде метеоритов и образцов пород Луны, и мантии Земли позволило расширить понятие о минерале и объектах исследования минералогии.
Слайд 3Под минералом понимается продукт природных физико-химических процессов в земной коре или в
Под минералом понимается продукт природных физико-химических процессов в земной коре или в

Предметом минералогии являются не только продукты природных процессов — минералы, а и сами процессы, при которых возникают или претерпевают различные изменения эти продукты. Следовательно, минералогия является наукой, восстанавливающей историю минералов. Она рассматривает и изучает минерал в его развитии и принадлежит к числу геологических наук, которые с разных сторон изучают неорганическое тело Земли.
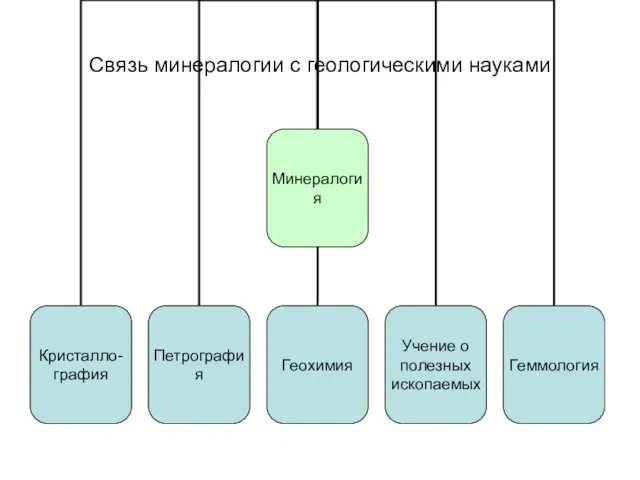
Слайд 4Связь минералогии с геологическими науками
Связь минералогии с геологическими науками
Слайд 5Деление минералогии:
1. минералогия земной коры:
2. минералогия мантии;
3. минералогия космоса;
в зависимости от подходов
Деление минералогии:
1. минералогия земной коры:
2. минералогия мантии;
3. минералогия космоса;
в зависимости от подходов

1) физика минералов
2) химия минералов
3) структурная минералогия
4) минералогическая кристаллохимия
5) генетическая минералогия
6) экспериментальная минералогия
7) прикладная минералогия
8) региональная минералогия
9) систематическая минералогия.
Слайд 6Конституция минералов
Под конституцией минералов понимают химический состав и внутреннее строение минералов, которые
Конституция минералов
Под конституцией минералов понимают химический состав и внутреннее строение минералов, которые

Конституция минералов определяется составляющими минералы структурными единицами (атомами и ионами).
При образовании минералов его структурные единицы стремятся к симметричному расположению и определённой координации, что приводит к образованию трёхмерных периодических структур, выраженных в виде пространственных кристаллических решёток.
Пространственная решётка состоит из элементарных ячеек со свойственными им «постоянными» решёток – ао, bо, со , β, ά, γ.
Элементарная ячейка для каждого минерала является типичной и из неё закономерным путём периодического повторения можно построить весь кристалл минерала с его внешними свойствами и формами.
Слайд 7Химический состав и свойства минералов
В состав минералов входят почти все химические элементы
Химический состав и свойства минералов
В состав минералов входят почти все химические элементы

Наряду с главными элементами, определяющими самостоятельность минерального вида, имеются элементы, входящие в минерал лишь в качестве примесей. Так, например, кремний (Si) образует более 400 минералов, примесями могут быть Са, Mg, Fe, Mn, Al, Сr.
В настоящий момент не известны минералы образованные рубидием(Rb)и гафнием (Gf).
Слайд 8Минералы – химические соединения
I.Гомоатомные соединения
В случае образования минерала из одного химического элементf
Минералы – химические соединения
I.Гомоатомные соединения
В случае образования минерала из одного химического элементf

- инертность в отношении химического взаимодействия с другими элементами. Они как правило химически устойчивые в условиях земной поверхности;
- практически всегда имеют примеси, хоть в небольших количествах (доли %);
- в структурном отношении они в большинстве своем кристаллизуются в кубической сингонии.
Слайд 9II. Простые соли (бинарные соединения)
Простые соли в большинстве представляют собой бинарные соединениями,
II. Простые соли (бинарные соединения)
Простые соли в большинстве представляют собой бинарные соединениями,

Среди них встречаются такие, у которых несколько катионов соединены с определенным анионом (халькопирит - CuFeS2, перовскит - CaTiO2).
Эти соединения также рассматриваются как бинарные: у которых сумма положительно заряженных частиц (+) находится в строгом соответствии к сумме отрицательно заряженных частиц (-).
В результате соединения нескольких химических элементов образуются минералы различного состава, среди которых особенно развиты простые, комплексные и двойные соли
Слайд 10III. Комплексные соединения
Комплексные соединения – наиболее распространены в природе минералов. Они характеризуются
III. Комплексные соединения
Комплексные соединения – наиболее распространены в природе минералов. Они характеризуются

Главными радикалами являются: силикаты-SiO4, фосфаты-PO4, карбонаты-CO3, сульфаты-SO4, нитраты-NO4;
Радикалы являются комплексными анионами и присоединяют при образовании минералов количество катионов, необходимое для компенсации отрицательной валентности. В комплексных анионах малые высоковалентные катионы, окружены большими низковалентными анионами. Например: в силикатах - очень мелкие ионы кремния (Si) окружены крупными атомами кислорода (О);
Комплексные анионы представляют собой в кристаллической решетке самостоятельные анионные группы с небольшим координационным числом центрального катиона. Прочность валентной связи между центральным катионом комплекса и окружающими его анионами больше, чем между этими анионами и катионами расположенные вне комплекса. Например: для кальцита внутри группы заряд углерода равен +2, а КЧ=3, т.е. прочность связи между С и О выражается отношением 4/3, в то время как вне комплекса заряд кальция =2, а координационное число = 6, т.е. прочность связи между Са и О = 2/6 (1/3).
Внутри комплекса прочность связи всегда >1.
Комплексные анионы по сравнению с простыми ионами выделяются большой величиной своих радиусов. Например: радиус сульфат-иона (SO4)=2,95А, а радиус О=1,32 А;
В минералогии в качестве комплексных ионов встречаются почти исключительно радикалы простых кислородных кислот.
Слайд 11IV. Двойные соли
Двойные соли - пользуются широким развитием в минеральном мире. Они
IV. Двойные соли
Двойные соли - пользуются широким развитием в минеральном мире. Они

Обычно кислородный радикал у обеих солей бывает одинаков, например: доломит – CaMg[CO3]2, но также бывают двойные соли с различными кислотными радикалами: каинит – KCl*Mg[SO4]*3H2O. .
Наиболее склонными к образованию двойных солей оказываются катионы, обладающие наибольшей основностью, уменьшающейся с увеличением заряда катиона и уменьшением размера ионного радиуса.
Наиболее активные катионы обладают наибольшим ВЭКом, к ним относятся щелочные металлы К+, Na+ и т.д.
Понятие ВЭКа был введён А.Е.Ферсманом в середине 50-х годов прошлого века.
ВЭК – средний пай энергии, вносимый данным ионом в кристаллическую решётку, отнесённый к единице валентности.
Слайд 12Формулы минералов.
Состав минерала обозначается химической формулой, которая условно отражает качественную и количественную
Формулы минералов.
Состав минерала обозначается химической формулой, которая условно отражает качественную и количественную

Формулы минералов могут быть эмпирическими и структурными.
Эмпирические формулы выражают количественный состав минералов и не дают представления о сочетаниях и связях составляющих минерал элементов;
Структурные формулы не только дают представление о химическом составе, но и позволяют судить о типе химического соединения и о взаимных связях между отдельными элементами.
Формулы минералов составляются по данным валового химического анализа и выражаются в %.
При сокращённом написании структурных формул близко связанные друг с другом атомы выделяют в группы посредством круглых скобок, а радикалы – квадратные скобки. Например: форстерит – Mg2[SiO4], каолинит – Al4(OH)8[Si4O10] .
Молекулы воды в кристаллогидратах пишутся в конце формулы Например:гипс -Ca[SO4]*2H2O.
Если в формуле есть дополнительные анионы ОН, и др. они ставятся перед радикалом Например: апатит - Ca5(F,Cl,OH)[PO4]3.
Изоморфные группы заключаются вместе в круглые скобки и отделяются друг от друга запятыми, причем элементы присутствуют в большом количестве пишутся впереди.
Например: сфалерит - (Zn, Fe, Mg, Cu, Ge, Yn, Tl,) S.
Слайд 13Координационное число
Число атомов ( ионов противоположного знака ), составляющих ближайшее окружение данного
Координационное число
Число атомов ( ионов противоположного знака ), составляющих ближайшее окружение данного

( Кч ), а геометрическая фигура, получающаяся при соединении центров этих атомов ( ионов ) прямыми линиями – его координационным многогранником
( Км ).
Например: 1. структура поваренной соли ( NaCI ): Кч(Na) – 6, КМ (Na) – октаэдр.
2. структура алмаза ( С ): Кч -4, КМ – тетраэдр.
3. структура флюорита ( Ca F2): Кч(Ca) – 8, КМ (Ca) – гексаэдр, Кч (F)– 4,
КМ (F)– тетраэдр.
В структурах одному и тому же координационому числу могут соответствовать различные координационные многогранники.
Например:
Кч КМ
1 - точка
2 - гантель
3 - треугольник
4 - тетраэдр ( квадрат )
6 - октаэдр ( тригональная призма )
8 - гексаэдр
12 - кубооктаэдр.
Слайд 14Формы нахождения воды в минералах
Вода – существенная составная часть многих минералов. Кроме
Формы нахождения воды в минералах
Вода – существенная составная часть многих минералов. Кроме

Вода в минералах может быть трех типов: кристаллизационной, цеолитной и адсорбционной.
1) Кристаллизационная (конституционная, координационная) вода – вода, содержащаяся в минералах в виде молекулы Н2О, является следствием их гидратации.
Минералы содержащие кристаллизационную воду, принято называть кристаллогидратами. В соответствующих формулах вода фигурирует целыми молекулами, Н2О.
Например: Ca(SO4)*2H2O – Ca(SO4)*0,5H2O – Ca(SO4)
гипс(монокл. с.) алебастр ангирит (ромб. с.)
Прочность связи кристаллизационной воды в отдельных кристаллогидратах весьма различна. В большинстве случаев выделение кристаллизационной воды происходит при температуре до 300 С
Признаки: 1) строгое положение в кристаллической решетке;
2) строгое количество молекул Н2О в формуле минерала.
Выделение кристаллизационной воды сопровождается разрушением кристаллической решетки с образованием безводного соединения или кристаллогидрата с промежуточным количеством воды.
Слайд 152) Цеолитная вода – имеет место в так называемых цеолитах – минералах
2) Цеолитная вода – имеет место в так называемых цеолитах – минералах

Например: п/к каркасные силикаты – натролит, анальцим (группа цеолитов)
. В пустотах этого каркаса и располагаются молекулы Н2О. При нагревании или под давлением эта вода свободно выходит из каркаса, при этом кристаллическая решетка не разрушается благодаря тому, что молекулы воды не принимают непосредственного участия в построении структуры минерала.
Удаленная цеолитная вода, может быть легко восстановлена минералом.
3) Адсорбционная вода – представляет собой молекулы Н2О, которые благодаря силе поверхностной энергии минерала механически притягиваются к его поверхности.
Содержание адсорбционной воды постоянно изменяется. Она удаляется из минералов, главным образом до температуры 110 С, при этом кристаллическая структура минерала не разрушается.
Например: гидрогётит – FeO(OH)*2H2O в процессе дегидратации превращается в безводный гидроксид железа – гётит FeO(OH)
 Виды Австралии
Виды Австралии Презентация на тему Наука и образование 7 класс
Презентация на тему Наука и образование 7 класс Орхидеи из бумаги в технике квиллинга
Орхидеи из бумаги в технике квиллинга Способы обозначения [Й‘] на письме
Способы обозначения [Й‘] на письме Программы утилиты
Программы утилиты Портрет
Портрет Симметрия вокруг нас
Симметрия вокруг нас Гимнастика спортивная и атлетическая
Гимнастика спортивная и атлетическая Школа
Школа 222 группа. Лукояновский педагогический колледж им. А.М. Горького
222 группа. Лукояновский педагогический колледж им. А.М. Горького ГЕНЕОЛОГИЯ UNIX
ГЕНЕОЛОГИЯ UNIX МОУ сош№2 МО город Горячий Ключ7 апреля 2011 годаСобрание родителей учащихся 9-х, 10-х классов
МОУ сош№2 МО город Горячий Ключ7 апреля 2011 годаСобрание родителей учащихся 9-х, 10-х классов Международные договоры как источник МЧП
Международные договоры как источник МЧП example
example Новая начальная школа
Новая начальная школа Родом из бетонной коробки, или новейшая архитектура Петербурга
Родом из бетонной коробки, или новейшая архитектура Петербурга ИСПОЛЬЗОВАНИЕ ВОЗМОЖНОСТЕЙ ИНТЕРНЕТ В РАБОТЕ УЧИТЕЛЕЙ АНГЛИЙСКОГО ЯЗЫКА.
ИСПОЛЬЗОВАНИЕ ВОЗМОЖНОСТЕЙ ИНТЕРНЕТ В РАБОТЕ УЧИТЕЛЕЙ АНГЛИЙСКОГО ЯЗЫКА. Трудности адаптации первоклассников к школе
Трудности адаптации первоклассников к школе Презентация на тему Классификация детских игр
Презентация на тему Классификация детских игр Тематическая деловая игра Государственная Дума РФ
Тематическая деловая игра Государственная Дума РФ Проектный метод в образовании
Проектный метод в образовании  Презентация на тему Возрастные особенности детей 5-6 лет
Презентация на тему Возрастные особенности детей 5-6 лет  Бизнес-марафон Взлетная полоса. Команда Fairy tale
Бизнес-марафон Взлетная полоса. Команда Fairy tale Природные памятники литосферы
Природные памятники литосферы Роль книги в интеллектуальном развитии ребенка
Роль книги в интеллектуальном развитии ребенка SHOES
SHOES Изображение фигуры человека и образ человека
Изображение фигуры человека и образ человека ПРАВОПРЕЕМСТВО ГОСУДАРСТВ В ОТНОШЕНИИ ГОСУДАРТСВЕННОЙ СОБСТВЕННОСТИ, ГОСУДАРСТВЕННЫХ ДОЛГОВ И ГОСУДАРСТВЕННЫХ АРХИВОВ
ПРАВОПРЕЕМСТВО ГОСУДАРСТВ В ОТНОШЕНИИ ГОСУДАРТСВЕННОЙ СОБСТВЕННОСТИ, ГОСУДАРСТВЕННЫХ ДОЛГОВ И ГОСУДАРСТВЕННЫХ АРХИВОВ