Содержание
- 2. N = NA∙ n, где N – число молекул NA – постоянная Авогадро, молек./моль n –
- 3. МАССА 1 МОЛЬ ВЕЩЕСТВА НАЗЫВАЕТСЯ ЕГО МОЛЯРНОЙ МАССОЙ, обозначается М и измеряется в г/моль.
- 4. 1 моль Fe весит 56г ? М(Fe) = 56 г/моль 1 моль S весит 32г ?
- 5. n = m / M и, следовательно, m = n ∙M и M = m/n
- 6. Задача 1. Найти массу 24 ∙1023 молекул озона. Задача 2. Сколько молекул содержится в 111г гидроксида
- 9. Скачать презентацию






 Презентация на тему Олимпийские игры в Москве 1980
Презентация на тему Олимпийские игры в Москве 1980  Национализм как политическая идеология
Национализм как политическая идеология Презентация на тему Решение задач на нахождение площади поверхности и объемов тел вращения
Презентация на тему Решение задач на нахождение площади поверхности и объемов тел вращения  Moderní cukrovar HROCHŮV TÝNEC
Moderní cukrovar HROCHŮV TÝNEC Система работы учителя математики с родителями при подготовке учащихся к государственной итоговой аттестации в форме ЕГЭ
Система работы учителя математики с родителями при подготовке учащихся к государственной итоговой аттестации в форме ЕГЭ Внешняя политика Александра I в 1801-1812 гг.
Внешняя политика Александра I в 1801-1812 гг. Основные ошибки при подаче документов на лицензирование
Основные ошибки при подаче документов на лицензирование Презентация на тему Изобразительное искусство классицизма и рококо
Презентация на тему Изобразительное искусство классицизма и рококо КИНЕШМА
КИНЕШМА Обработка нижнего среза изделия
Обработка нижнего среза изделия Педагогическая практика организации внеурочной и внеклассной деятельности
Педагогическая практика организации внеурочной и внеклассной деятельности Положение об общественном совете муниципального образования Северодвинск
Положение об общественном совете муниципального образования Северодвинск Луи , ПАСТЕР (Pasteur)
Луи , ПАСТЕР (Pasteur) Хохломская роспись
Хохломская роспись Горячая линия
Горячая линия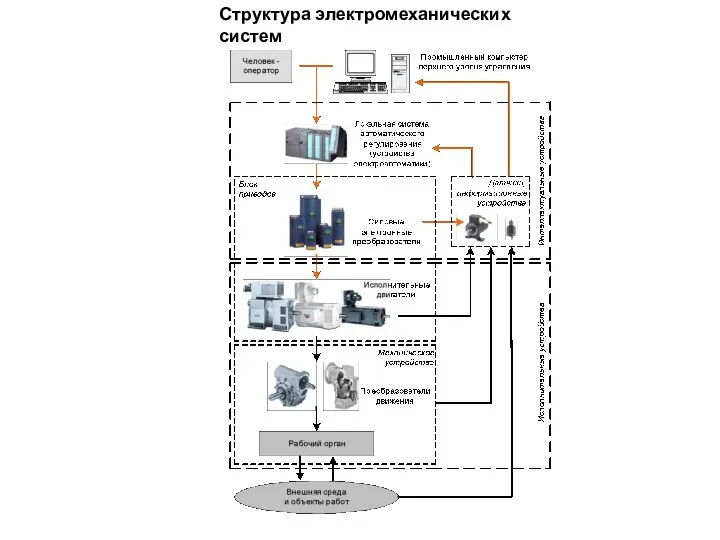 Структура электромеханических систем
Структура электромеханических систем Характер человека
Характер человека Преодоление сложностей при запоминании таблицы умножения
Преодоление сложностей при запоминании таблицы умножения Презентация на тему Юридическая клиника в кыргызско-российском славянском университете имени Бориса Ельцина
Презентация на тему Юридическая клиника в кыргызско-российском славянском университете имени Бориса Ельцина  Презентация на тему Военно-патриотическое воспитание
Презентация на тему Военно-патриотическое воспитание Обобщающий урок во 2 классе
Обобщающий урок во 2 классе Дистрибуция прессы в сети супермаркетов в России. Тенденции и перспективы развития.
Дистрибуция прессы в сети супермаркетов в России. Тенденции и перспективы развития.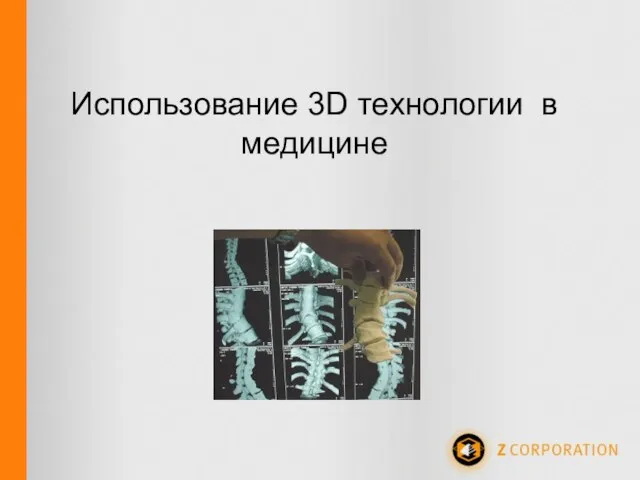 Использование 3D технологии в медицине
Использование 3D технологии в медицине Кружок робототехники
Кружок робототехники Война за независимость США
Война за независимость США Современная теория фотосинтеза
Современная теория фотосинтеза Программный комплекс «Карат» предназначен для создания в базе данных показателей любого типа, ручного ввода или автоматической п
Программный комплекс «Карат» предназначен для создания в базе данных показателей любого типа, ручного ввода или автоматической п Prezentacia_лекція_10-1_ТЕК (3)
Prezentacia_лекція_10-1_ТЕК (3)