Содержание
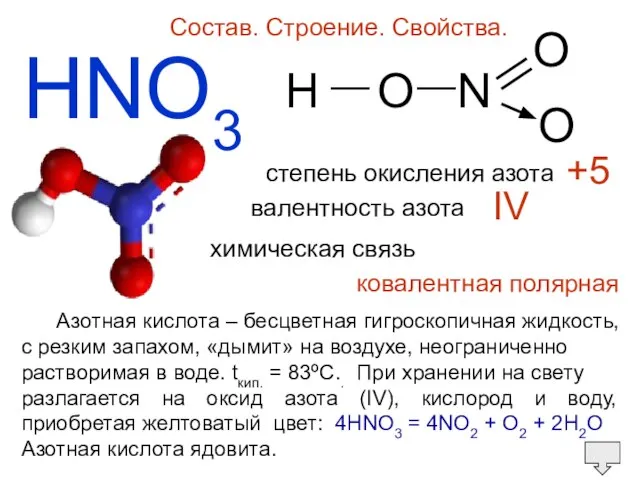
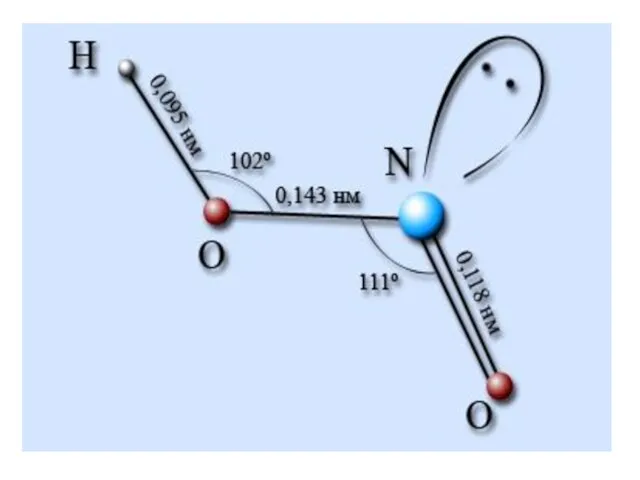
- 2. HNO3 Состав. Строение. Свойства. H O N O O — — степень окисления азота валентность азота
- 4. При разложении азотной кислоты выделяется кислород, поэтому скипидар вспыхивает.
- 5. Азотная кислота (HNO3) Классификация наличию кислорода: основности: растворимости в воде: летучести: степени электролитической диссоциации: кислородсодержащая одноосновная
- 6. Получение азотной кислоты в промышленности NH3 NO NO2 HNO3 4NH3+ 5O2 = 4NO + 6H2O 2NO+O2
- 7. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании. Составьте уравнение
- 8. Химические свойства азотной кислоты 1. Типичные свойства кислот 2. Взаимодействие азотной кислоты с металлами 3. Взаимодействие
- 9. Химические свойства азотной кислоты Азотная кислота проявляет все типичные свойства кислот. Перечислите свойства характерные для кислот.
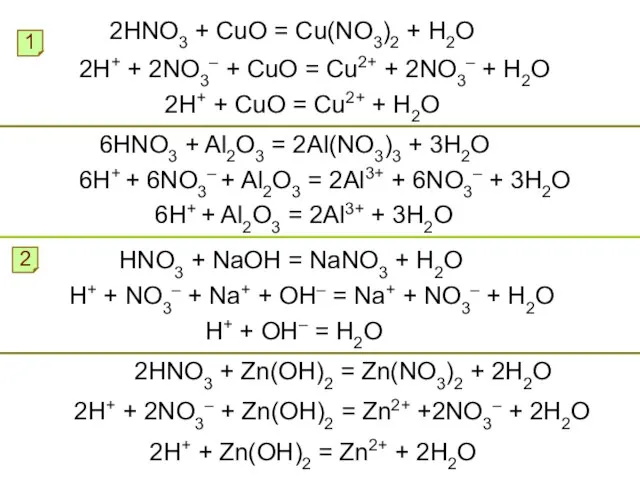
- 10. 2HNO3 + CuO = Cu(NO3)2 + H2O 1 2H+ + 2NO3– + CuO = Cu2+ +
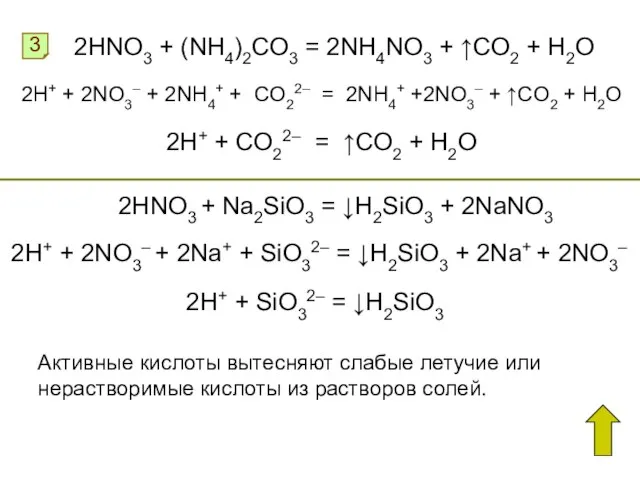
- 11. 3 2HNO3 + (NH4)2CO3 = 2NH4NO3 + ↑CO2 + H2O 2H+ + 2NO3– + 2NH4+ +
- 12. Взаимодействие азотной кислоты с металлами Как реагируют металлы с растворами кислот? Металлы, стоящие в ряду активности
- 13. Окислительные свойства азотной кислоты
- 14. Составьте уравнение реакции взаимодействия концентрированной азотной кислоты с ртутью. Рассмотрите реакцию с т. зр. ОВР. 4HN+5O3
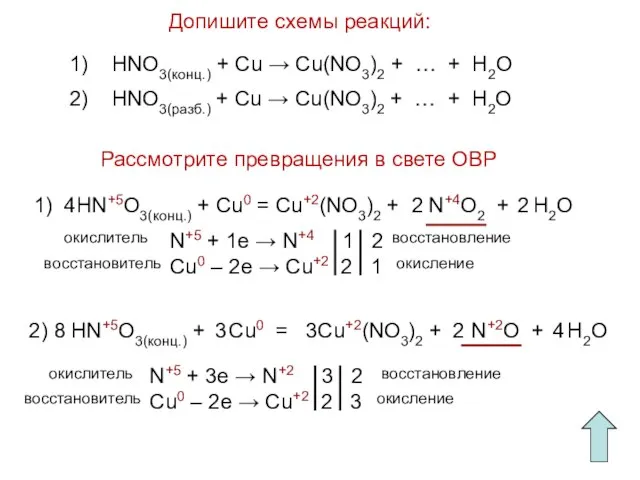
- 15. Допишите схемы реакций: Рассмотрите превращения в свете ОВР 1) HNO3(конц.) + Cu → Cu(NO3)2 + …
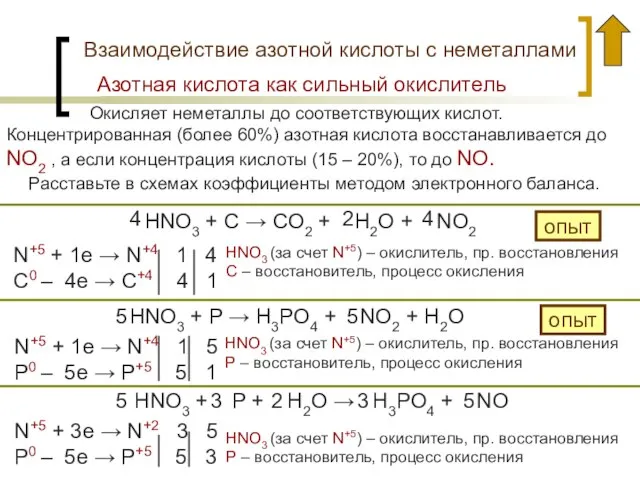
- 17. Взаимодействие азотной кислоты с неметаллами Окисляет неметаллы до соответствующих кислот. Концентрированная (более 60%) азотная кислота восстанавливается
- 18. Взаимодействие азотной кислоты с углем
- 19. Взаимодействие азотной кислоты с белым фосфором
- 20. Применение азотной кислоты 1 5 4 6 2 3 Производство азотных и комплексных удобрений. Производство взрывчатых
- 21. Соли азотной кислоты Как называются соли азотной кислоты? нитраты Нитраты K, Na, NH4+ называют селитрами Составьте
- 22. Нитрат калия (калиевая селитра) Бесцветные кристаллы Значительно менее гигроскопична по сравнению с натриевой, поэтому широко применя-ется
- 23. Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение
- 24. При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду напряжений стоит металл, образующий соль.
- 26. Скачать презентацию

















 Один день из жизни учителя
Один день из жизни учителя Сюжетно- Ролевая игра
Сюжетно- Ролевая игра Wonders of the modern word
Wonders of the modern word §34-40. Звуковые волны
§34-40. Звуковые волны Отчет о прохождении учебной практики (практики по получению первичных профессиональных умений
Отчет о прохождении учебной практики (практики по получению первичных профессиональных умений Как продвигать сайт без помощи SEO специалистов
Как продвигать сайт без помощи SEO специалистов Классификация ЧС природного характера
Классификация ЧС природного характера РВАТЬ ЗУБЫ И МЫТЬ ДЕНЬГИ: ОБ ОДНОМ ТИПЕ УПОТРЕБЛЕНИЯ ПРОСТЫХ ИМПЕРФЕКТИВОВ В РУССКОМ ЯЗЫКЕ Анна А.Зализняк Институт языкознания Р
РВАТЬ ЗУБЫ И МЫТЬ ДЕНЬГИ: ОБ ОДНОМ ТИПЕ УПОТРЕБЛЕНИЯ ПРОСТЫХ ИМПЕРФЕКТИВОВ В РУССКОМ ЯЗЫКЕ Анна А.Зализняк Институт языкознания Р Цыганы как романтическая поэма
Цыганы как романтическая поэма Требования к методическому обеспечению учебного курса/модуля
Требования к методическому обеспечению учебного курса/модуля Подсчет запасов
Подсчет запасов Презентация на тему "Будни и праздники 5 класса" - скачать презентации по Педагогике
Презентация на тему "Будни и праздники 5 класса" - скачать презентации по Педагогике Влияние итальянского искусства на культуру Петербурга
Влияние итальянского искусства на культуру Петербурга FORWARD
FORWARD Цели создания кластераПредставление организационной структуры ИТ-кластера
Цели создания кластераПредставление организационной структуры ИТ-кластера Психосоматический подход в решении вопросов здоровья
Психосоматический подход в решении вопросов здоровья семья и брак
семья и брак Мотоциклы Италии
Мотоциклы Италии Информация. Понятие, свойства, виды и единицы измерения
Информация. Понятие, свойства, виды и единицы измерения Международные отношения и политика СССРв Европево 2-й половине 40-х гг.
Международные отношения и политика СССРв Европево 2-й половине 40-х гг. Региональный банк актуального педагогического опыта. Информационная карта опыта
Региональный банк актуального педагогического опыта. Информационная карта опыта Коты - служители Эрмитажа
Коты - служители Эрмитажа Односоставные предложения. Типы односоставных предложений
Односоставные предложения. Типы односоставных предложений Мышление
Мышление Костюм «Корнелия»
Костюм «Корнелия» 20140113_frantsiya_i_germaniya
20140113_frantsiya_i_germaniya Повторение изученного по теме «Наречие»
Повторение изученного по теме «Наречие» Итоги и перспективы развития рынков электрической энергии
Итоги и перспективы развития рынков электрической энергии