Слайд 2Основные газовые законы
Закон Дальтона:
Закон Бойля-Мариотта: P⋅V=const при t0=const
Закон Шарля: P/T=const при V=const
Закон

Гей-Люссака: V/T=const при P=const
Закон Авогадро: одинаковые количества газов при одинаковых температуре и давлении занимают одинаковый объём
Слайд 3Основные газовые законы
Законы Шарля и Гей-Люссака имеют такой простой вид если температура

измеряется по абсолютной шкале
Первоначально эти законы были сформулированы для температуры, измеренной в некоторой практической шкале. В этом случае они имеют более сложный вид:
P=P0[1+α⋅(t-t0)]
V=V0[1+β⋅(t-t0)]
при чём коэффициенты α и β оказались равными и не зависящими от рода газа
Слайд 4Основные газовые законы
Процессы, описываемые уравнениями
2-4 называются изопроцессами:
Изотермическим
Изохорным
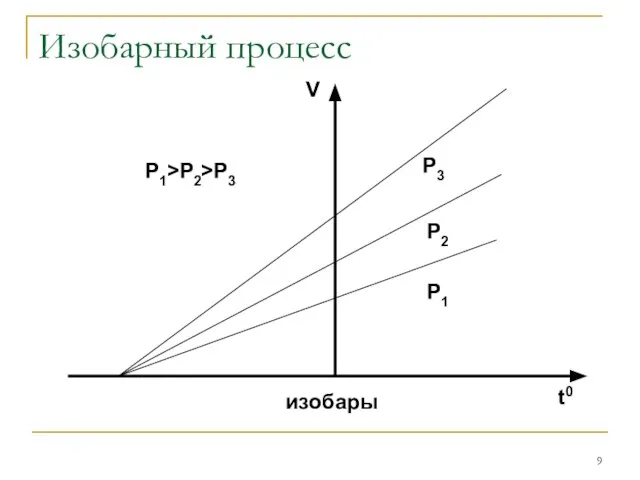
Изобарным

Слайд 11Основные газовые законы
Если измерять температуру по шкале Цельсия, то оказывается, что точка

пересечения изохорного и изобарного процессов с осью температур имеет координату t=-373,15 0С. Это значит, что α=β=1/273,15 1/0С
Слайд 12Основные газовые законы
Если ввести новую шкалу температур, такую, что Т=t+273,15, то уравнения

примут более простой вид:
P/T=const
V/T=const
Определённая таким образом температура называется абсолютной температурой
Слайд 13Основные газовые законы
Рассмотрим переход из состояния 1 в 2 через а на
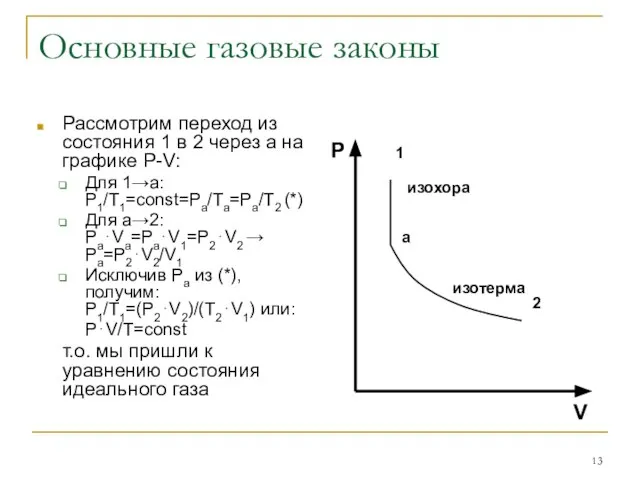
графике P-V:
Для 1→а: P1/T1=const=Pa/Ta=Pa/T2 (*)
Для а→2: Pa⋅Va=Pa⋅V1=P2⋅V2 → Pa=P2⋅V2/V1
Исключив Ра из (*), получим: P1/T1=(P2⋅V2)/(T2⋅V1) или:
P⋅V/T=const
т.о. мы пришли к уравнению состояния идеального газа
Слайд 14Основные газовые законы
Из закона Авогадро следует, что величина соотношения (P⋅V)/T не зависит

от вида газа, значит мы можем записать, что для одного моля любого газа (P⋅V)/T=R, где R – универсальная газовая постоянная, называемая постоянной Авогадро
R=8,31 Дж/(град⋅моль)
Из закона Дальтона следует, что при постоянных V и Т, Р является линейной функцией количества вещества ν
Слайд 15Основные газовые законы
Т.о., мы пришли к уравнению Клапейрона-Менделеева:
P⋅V=ν⋅R⋅T
или
P⋅V=(m/μ)⋅R⋅T

Слайд 16Основные газовые законы
Идеальный газ
Идеальным называется такой газ, который подчиняется закону Клапейрона-Менделеева
Поведение реальных

газов приближается к поведению идеального газа в пределе низких давлений и высоких температур
Размеры молекул идеального газа малы по сравнению с межмолекулярным расстоянием, а энергией взаимодействия молекул можно пренебречь
Слайд 17Кинетическая теория газов
Оценка размеров молекул
Средний размер молекул =(V/N)1/3, где V – объём,

а N – количество молекул
Для воды: ρ=1г/см3, μ=18 г/моль → Vμ=18 см3. =(Vμ/NA)1/3=(18/6⋅1023)1/3≈3⋅10-8 см=
=3⋅10-10 м
Слайд 18Кинетическая теория газов
Оценка расстояния между молекулами в газе
<>=(V/NA)1/3, при комнатной температуре и

атмосферном давлении 1 моль газа занимает объём 22 400 см3 →
<>=(22400/6⋅1023)1/3≈3,3⋅10-7 см
Т.о. <> на порядок больше, чем , соответственно, объём на три порядка больше
Слайд 19Кинетическая теория газов
Оценка средней длины свободного пробега молекул в газах
λ~<>⋅(<>/)2
При нормальном давлении

λ~10-5 см, то есть на два порядка больше <>
Слайд 20Кинетическая теория газов
Задача МКТ заключается в установлении взаимосвязи между макроскопическими параметрами ТД

системы (P, T и др.) и её микроскопическими характеристиками (λ, μ, , , <>)
Слайд 21Вывод основного уравнения МКТ
Рассмотрим цилиндр с площадью основания S=1, опирающийся на стенку

сосуда
Примем следующую модель
Частицы разделены на три равные группы, каждая из которых движется вдоль одной из координатных осей
Частицы не взаимодействуют между собой
При ударе частицы о стенку, на неё действует сила i такая, что:
i⋅τ=Δpix≈2⋅ pix (*)
Слайд 22Вывод основного уравнения МКТ
Число ударов о стенку:
zi=S⋅ni⋅vix⋅Δt
Заменим в (*) i на

<> так, что i⋅τ=<> ⋅Δt
Тогда, полная сила, действующая на стенку со стороны молекул, имеющих скорость vix:
Fix=zi⋅2⋅ pix/Δt=S⋅ni⋅vix⋅ pix
Слайд 23Вывод основного уравнения МКТ
→ P=ΣFi/S=Σni⋅vix⋅ pix=n⋅=1/3⋅n⋅
⋅=(2/3)⋅n⋅
Таким образом мы получили основное уравнение

молекулярно-кинетической теории газов:
Р=(2/3)⋅n⋅
Слайд 24Оценка скорости молекул
Р=(2/3)⋅n⋅=(2/3)⋅n⋅m⋅/2=
=N⋅m⋅/(3⋅V)=M⋅/(3⋅V) →
→ =3⋅P⋅V/M=3⋅P/ρ →

Слайд 25Оценка скорости молекул
Для молекул водорода Н2 μ=2⋅10-3 кг/моль,
при комнатной температуре:
≈1800 м/с
для

молекул О2 μ=2⋅10-3 кг/моль, при комнатной температуре:
≈500 м/с
Слайд 26Кинетическая теория газов
Сравнивая уравнение Клапейрона-Менделеева:
P=ν⋅R⋅T/V, где ν/V=n/Na
с основным уравнением молекулярно-кинетической

теории газов:
Р=(2/3)⋅n⋅
мы можем заключить что:
R⋅T/NA=(2/3)⋅
Слайд 27Кинетическая теория газов
Окончательно получаем:
=(3/2)⋅k⋅T
где k – постоянная Больцмана
k=1,38⋅10-23 Дж/град
k=R/NA
Т.о. мы выяснили

молекулярно-кинетический смысл температуры – она пропорциональна средней кинетической энергии молекулы
Слайд 28Кинетическая теория газов
Из Р=(2/3)⋅n⋅
и =(3/2)⋅k⋅T
следует что:
P=n⋅k⋅T























 Церковь. Для малыша 2-5 лет
Церковь. Для малыша 2-5 лет Потребности человека
Потребности человека Итоги Второй мировой войны
Итоги Второй мировой войны Презентация на тему Однокоренные (родственные) слова. Корень слова
Презентация на тему Однокоренные (родственные) слова. Корень слова  Интегрированный урок физики и биологии
Интегрированный урок физики и биологии Правила оформления и структура научно-исследовательской работы
Правила оформления и структура научно-исследовательской работы Е.Н. Никитина Директор Центр им. А.Сахарова- фонд Г.Белля 6 октября 2009 Москва
Е.Н. Никитина Директор Центр им. А.Сахарова- фонд Г.Белля 6 октября 2009 Москва What is law
What is law Презентация на тему Окончание Столетней войны Жанны д'Арк
Презентация на тему Окончание Столетней войны Жанны д'Арк  Ядерные программы Англии, Франции и Китая. Лекция 6
Ядерные программы Англии, Франции и Китая. Лекция 6 Фонетическая система русского языка
Фонетическая система русского языка Политическая система
Политическая система Энергетические напитки и школьники (2) (2)
Энергетические напитки и школьники (2) (2) Пневмотиски
Пневмотиски Тема: «Растровая и векторная графика»
Тема: «Растровая и векторная графика» Муниципальное общеобразовательноеучреждение Центр образования № 49г.Тверь
Муниципальное общеобразовательноеучреждение Центр образования № 49г.Тверь «Чтобы сделать из людей хороших граждан, им следует дать возможность проявить свои права граждан и исполнить обязанности граждан".
«Чтобы сделать из людей хороших граждан, им следует дать возможность проявить свои права граждан и исполнить обязанности граждан". Авторский бренд
Авторский бренд Кормушка для птиц
Кормушка для птиц Презентация на тему: «Биография Александра Исаевича Солженицына»
Презентация на тему: «Биография Александра Исаевича Солженицына» Состояние здоровья на китайском
Состояние здоровья на китайском Формирование УУД Педагогические технологии
Формирование УУД Педагогические технологии Звягинцева ТИ_ВР_ПрезентацияВКР
Звягинцева ТИ_ВР_ПрезентацияВКР Гражданские правоспособность и дееспособность
Гражданские правоспособность и дееспособность О Деятельности службы медицинской профилактики в ГУЗ со «сгптд»
О Деятельности службы медицинской профилактики в ГУЗ со «сгптд» Итоги научно-исследовательской работы НИАИ им. В.В.Соболеваза 2009 год.
Итоги научно-исследовательской работы НИАИ им. В.В.Соболеваза 2009 год. Тектоно-металлогеническая модель Земной коры Металлогения
Тектоно-металлогеническая модель Земной коры Металлогения Интеллектуально-правовая игра
Интеллектуально-правовая игра