Слайд 2Цели и задачи
1. Познакомить учащихся с взглядами на строение атома, существовавших до

начала XIX века.
2. Рассказать о ядерной модели атома Резерфорда
3.Показать, чем отличаются друг от друга атомы различных химических элементов.
4. Показать строение атомов водорода, дейтерия, трития.
Слайд 3Взгляды учёных на строение атома
В начале XIX века в физике бытовали самые

разные и часто фантастические представления о строении атома.
Например, ректор Мюнхенского университета Фердинанд Линдеман в 1905 году утверждал, что « атом кислорода имеет форму кольца, а атом серы – форму лепёшки».
Слайд 4Модель атома по Дж. Томсону.
Дж. Томсон в 1898 году предложил

модель атома в виде положительно заряженного шара радиусом 10-10 м, в котором « плавают» отрицательные электроны, размеры которых 10-13 м. Сам Томсон относился к своим моделям без энтузиазма.
Слайд 5Русские физики
Вопрос о строении атома изучали и русские физики:
Пётр Николаевич Лебедев
И

известный учёный – народник Николай Морозов
Слайд 6Атом, атомная физика, атомный век…
Мы чуть не с пелёнок слышим со

всех сторон: атом, атомная физика, атомная энергия, атомная электростанция, атомная подводная лодка, атомный век…
Известно, что атомы – это крошечные частички, из которых состоит всё на свете: воздух, вода, земля, еда, Солнце, звёзды…
Слайд 7Опыты Резерфорда.
В 1911 году Резерфорд со своими сотрудниками провёл ряд опытов

по исследованию состава и строения атомов.
Слайд 8Строим модель атома. Как выглядит атом? Что у него внутри?
Если изобразить «детали»

из которых состоит атом, пластилиновыми шариками:
Красный – протон,
зелёный – нейтрон,
синий - электрон
Слайд 9Модель самого простого атома.
Возьмём красный шарик - протон и синий – электрон

и соединим их ниткой.
Протон – частица неповоротливая, он в две тысячи раз тяжелее электрона. Неудивительно, что протон «сидит»в центре атома, а легкий и непоседливый электрон крутится вокруг него, словно спутник вокруг Земли.
Слайд 10Модель атома самого лёгкого газа.
Самый лёгкий газ – водород. Он в 15

раз легче воздуха, поэтому наполненный водородом дирижабль всплывает в воздушном океане, словно поплавок
Слайд 11« Воздушные шарики»
Шары, которые подняли в воздух одного из героев сказки Юрия

Олеши «Три толстяка», были наполнены водородом…
Слайд 12Дейтерий
Лёгкий водород можно сделать потяжелее, если присоединить к протону нейтрон. Вот теперь

в атоме все три детали: протон, нейтрон и электрон. Это тяжёлый водород - дейтерий.
Слайд 13Тритий
Но можно сделать водород ещё тяжелее, присоединив к протону не один,

а два нейтрона – получаем сверхтяжёлый водород – тритий.
Слайд 14«Водо –род»
Водород «родит воду» он хорошо горит, а при этом атомы водорода
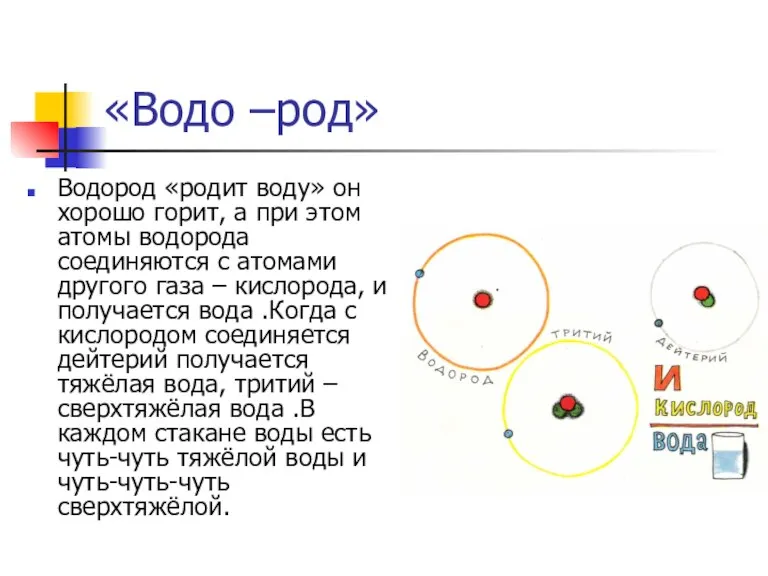
соединяются с атомами другого газа – кислорода, и получается вода .Когда с кислородом соединяется дейтерий получается тяжёлая вода, тритий – сверхтяжёлая вода .В каждом стакане воды есть чуть-чуть тяжёлой воды и чуть-чуть-чуть сверхтяжёлой.
Слайд 15Модель атома гелия
Если теперь в ядре атома будет два протона, два нейтрона,

а вокруг них будут вращаться два электрона, то получим модель атома совсем другого газа – гелия.
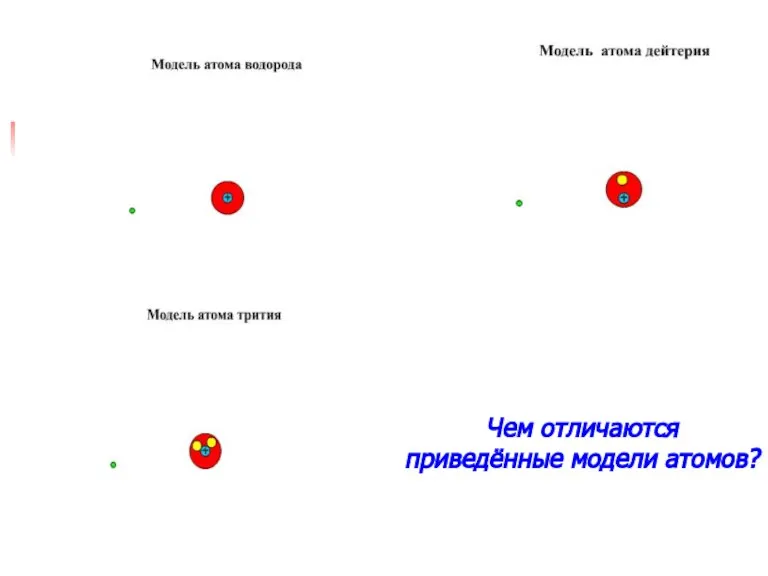
Слайд 17Чем отличаются приведённые модели атомов?
















 Концепция агентских отношений
Концепция агентских отношений Проект «Госпожа Производная»
Проект «Госпожа Производная» Организационная структура студии депиляции по франшизе SAHAR&VOSK
Организационная структура студии депиляции по франшизе SAHAR&VOSK Притчи Господа
Притчи Господа Организация исследовательской и проектно-творческой деятельности учащихся
Организация исследовательской и проектно-творческой деятельности учащихся Кто такой менеджер продукта и что он может дать компании разработчику?
Кто такой менеджер продукта и что он может дать компании разработчику? Морозильные лари
Морозильные лари Оформление отчета по учебной практике. Шаблон
Оформление отчета по учебной практике. Шаблон Культура Древней Руси в 9-13 вв
Культура Древней Руси в 9-13 вв Новогодняя викторина Новогодние традиции в разных странах
Новогодняя викторина Новогодние традиции в разных странах Компьютерные сетиОборудование и линии связи
Компьютерные сетиОборудование и линии связи 丰 品 问 题 Product Feedback
丰 品 问 题 Product Feedback Анализ базы данных «Контингент» (май 2007 года)
Анализ базы данных «Контингент» (май 2007 года) 8 класс I тур 2006-2007 г.
8 класс I тур 2006-2007 г. Союз Ительменских Родов
Союз Ительменских Родов Общий вид конструктора Лего
Общий вид конструктора Лего Итоги правления Петра 1
Итоги правления Петра 1 Профессия повар, кондитер
Профессия повар, кондитер Рынок благ. Теория совокупного спроса
Рынок благ. Теория совокупного спроса  Навчальні можливості за кордоном: як не прогавити? Каленюк Дар’я, Барсукова Дарина, 2009 Харківська ФРІ
Навчальні можливості за кордоном: як не прогавити? Каленюк Дар’я, Барсукова Дарина, 2009 Харківська ФРІ Теория строения органических соединений А.М.Бутлерова
Теория строения органических соединений А.М.Бутлерова Значение природных ресурсов
Значение природных ресурсов Проектирование электроснабжения жилых микрорайонов
Проектирование электроснабжения жилых микрорайонов Учебно-методические комплекты и Новый образовательный стандарт по биологии
Учебно-методические комплекты и Новый образовательный стандарт по биологии Физиология синапсов ЦНС
Физиология синапсов ЦНС Идеология как социологическое и политическое понятие
Идеология как социологическое и политическое понятие О теореме Пифагора и способах её доказательства
О теореме Пифагора и способах её доказательства Потемкин Н.А. «Грамматические школы и школьные грамматики 12-17 в.в. как один из институтов европейского мышления»
Потемкин Н.А. «Грамматические школы и школьные грамматики 12-17 в.в. как один из институтов европейского мышления»