Слайд 2Немного истории
В середине II тысячелетия до н.э. в Египте была основана металлургия

железа – получение его из железных руд. Это положило начало железному веку в истории человечества.
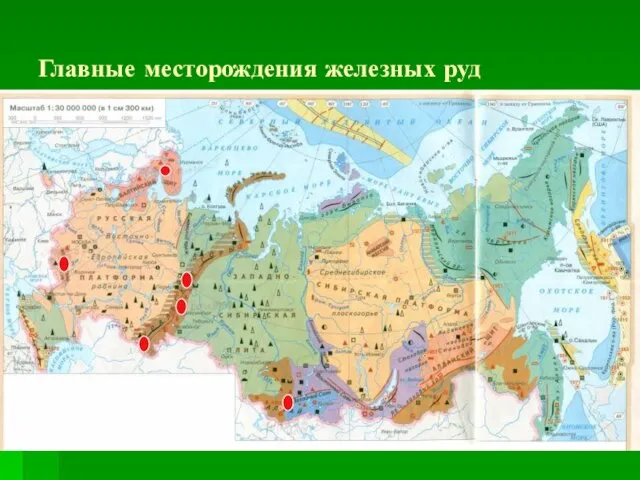
Слайд 4Главные месторождения железных руд
Слайд 6Железо – d-элемент.
Порядковый номер
26
Относительная атомная масса
55,847
Валентность переменная
II-III

Слайд 7Физические свойства железа
Плотность=7,87 г/см3
Тпл = 1539ْ С
Ткип = 3200ْ С
Намагничивается
Легко

обрабатывается: режется, прокатывается,
куётся
Слайд 8Химические свойства железа
Металл средней активности
в концентрированных серной и азотной кислотах пассивируется

Слайд 9Коррозия металла
Железо разрушается под действием окружающей среды – оно ржавеет
4Fe + 3O2

+ 2n·H2O = 2Fe2O3·nH2 O
Состав ржавчины очень сложный
Слайд 10Защита железа от коррозии
Лако-красочные покрытия
Эмаль – силикатное стекло с добавлением оксидов металлов
Металлические

покрытия: лужение, оцинковывание, хромирование и т.д.
Выплавление нержавеющих сталей
Ингибирование
Слайд 11Соединения железа
FeO →Fe(OH)2 – основные соединения
FeO + H2SO4 = FeSO4 +H2O
Fe2O3

→ Fe(OH)3 – амфотерные соединения
Fe(OH)3 + NaOH =t Na[Fe(OH)4]
Слайд 12Качественные реакции
На ион Fe2+ - взаимодействие с красной кровяной солью гексацианоферратом (III)калия

Fe+2SO4+K3[Fe(CN)6]=KFe+3[Fe+2(CN)6]↓+K2SO4
синего цвета
На ион Fe3+–взаимодействие с роданидом аммония
Fe+3CI3+3NH4SCN↔Fe(SCN)3↓+3NH4CI
кроваво-красного
цвета











 Отмена ЕНВД
Отмена ЕНВД Рынок земли(природных ресурсов)
Рынок земли(природных ресурсов) «Электричество и растения».
«Электричество и растения». Роль женщины-матери в духовно-нравственном воспитании детей
Роль женщины-матери в духовно-нравственном воспитании детей Риск-менеджмент. Теоретические основы рискологии. Лекция №1
Риск-менеджмент. Теоретические основы рискологии. Лекция №1 Моя любимая игра: ,,Страйкбол”
Моя любимая игра: ,,Страйкбол” Что такое Recognition? Программа Recognition (перевод с англ. признание) – это инновационный продукт на международном образовательном рынке.
Что такое Recognition? Программа Recognition (перевод с англ. признание) – это инновационный продукт на международном образовательном рынке.  Презентация на тему Петр I
Презентация на тему Петр I  Единое и расчлененное знание в истории культуры
Единое и расчлененное знание в истории культуры 2_5390911506760081685
2_5390911506760081685 Государственный Фонд развития промышленности Рязанской области (ГФРП РО)
Государственный Фонд развития промышленности Рязанской области (ГФРП РО) Некоторые задачи планирования сети магистрального оператора
Некоторые задачи планирования сети магистрального оператора Жизнь и творчество Л.Н. Толстого (1828-1910)
Жизнь и творчество Л.Н. Толстого (1828-1910) Трансплантация
Трансплантация Разработка продающего сайта
Разработка продающего сайта Литература и искусство эпохи Возрождения
Литература и искусство эпохи Возрождения Слайд только для инструкторов *** Не демонстрировать во время презентации
Слайд только для инструкторов *** Не демонстрировать во время презентации МОУ МАГАНСКАЯ СОШ
МОУ МАГАНСКАЯ СОШ Эко-отель Leaprus
Эко-отель Leaprus Презентация на тему Три состояния вещества Физика 7 класс
Презентация на тему Три состояния вещества Физика 7 класс  Клеточное строение корня (1)
Клеточное строение корня (1) Административные дела (первая инстанция) Урок 3.2. Рассмотрение административного дела
Административные дела (первая инстанция) Урок 3.2. Рассмотрение административного дела Зразы картофельные с грибами (замороженный полуфабрикат)
Зразы картофельные с грибами (замороженный полуфабрикат) Внедрение ГШИС и КМИС КУ в образовательном учреждении
Внедрение ГШИС и КМИС КУ в образовательном учреждении Правописание суффиксов -чик- и -щик-
Правописание суффиксов -чик- и -щик- Тест "Про кошек и собак" 2 класс
Тест "Про кошек и собак" 2 класс Смертная казнь по законодательству Республики Казахстан: история и современность
Смертная казнь по законодательству Республики Казахстан: история и современность Первый питательный крем от Anew - Ультра-Питание
Первый питательный крем от Anew - Ультра-Питание