Содержание
- 2. Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2,
- 3. Способы получения оксидов. Взаимодействие простых веществ с кислородом: 2Mg + O2 = 2Mg O 2. Горение
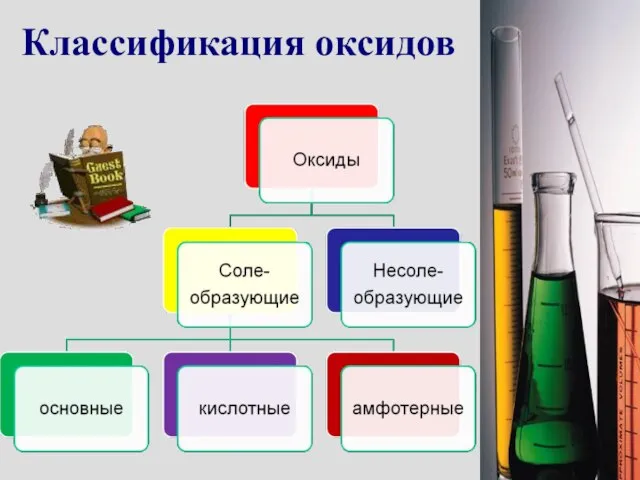
- 4. Классификация оксидов
- 5. Несолеобразующие оксиды Это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не образуют
- 6. Основные оксиды Это оксиды, которым в качестве гидроксидов соответствуют основания. Например: CuO → Cu(OH)2 Основные оксиды
- 7. Химические свойства основных оксидов. Взаимодействие с кислотами, с образованием соли и воды: MgO + HCl =
- 8. Кислотные оксиды Это оксиды, которым в качестве гидроксидов соответствуют кислоты. Например: SO3 → H2SO4 Кислотные оксиды
- 9. Химические свойства кислотных оксидов. С основаниями, образуя соль и воду: CO2 + 2KOH = K2CO3 +
- 10. АМФОТЕРНЫЕ ОКСИДЫ. Это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот. Например: BeO
- 11. Химические свойства амфотерных оксидов. В качестве основных оксидов. С кислотами, образуя соль и воду: ZnO +
- 12. Вывод. С повышением степени окисления атомов элемента, образующего оксиды, увеличиваются кислотные свойства его оксидов и гидроксидов.
- 14. Скачать презентацию










 Перспективы развития порта Петропавловск- Камчатский как морского хаба между Северной Европой, Юго-Восточной Азией и Западным поб
Перспективы развития порта Петропавловск- Камчатский как морского хаба между Северной Европой, Юго-Восточной Азией и Западным поб Предмет, методы, система экологического права как отрасли права
Предмет, методы, система экологического права как отрасли права Универсалистская парадигма в логике и принцип композициональности Горбатов В.В. ст. преподаватель ф-та философии ГУ-ВШЭ
Универсалистская парадигма в логике и принцип композициональности Горбатов В.В. ст. преподаватель ф-та философии ГУ-ВШЭ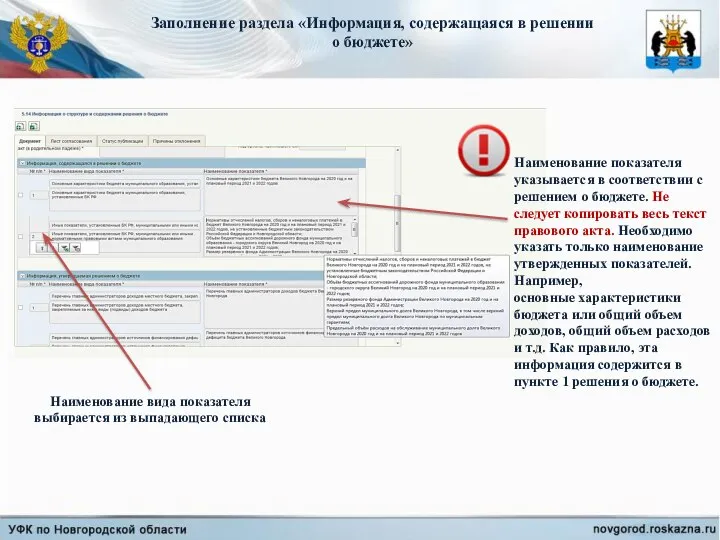 Информация, содержащаяся в решении о бюджете
Информация, содержащаяся в решении о бюджете Мифы народов мира
Мифы народов мира Презентация на тему Встраивание видео в презентацию
Презентация на тему Встраивание видео в презентацию  Расписание занятий
Расписание занятий Последствия при авариях на ХОО
Последствия при авариях на ХОО Руководство для статистиков
Руководство для статистиков Системный блок. Внутри ПК
Системный блок. Внутри ПК Open Enterprise Server 2Service Pack 2
Open Enterprise Server 2Service Pack 2 Древний Восток: Иран, Индия, Китай (10 класс)
Древний Восток: Иран, Индия, Китай (10 класс) Мой любимый Париж
Мой любимый Париж Презентация на тему Человек как биологический вид
Презентация на тему Человек как биологический вид  Всемирное наследие
Всемирное наследие Виды кабелей
Виды кабелей Проект научного портала Сингулярность
Проект научного портала Сингулярность Анги удирдсан багш О.Саранчимэг
Анги удирдсан багш О.Саранчимэг СРЕДСТВА ОКАЗАНИЯ ПЕРВОЙ МЕДИЦИНСКОЙ ПОМОЩИ. Учебно-методический центр по ГО и ЧС Курской области.
СРЕДСТВА ОКАЗАНИЯ ПЕРВОЙ МЕДИЦИНСКОЙ ПОМОЩИ. Учебно-методический центр по ГО и ЧС Курской области. Клиническая психология детей и подростков
Клиническая психология детей и подростков Салон красоты. Кейс продвижения с нуля
Салон красоты. Кейс продвижения с нуля Составление творческого рассказа по аналогии. Лексическая тема: Зима, зимующие птицы
Составление творческого рассказа по аналогии. Лексическая тема: Зима, зимующие птицы Организация работы ресторана русской кухни на 60 посадочных мест
Организация работы ресторана русской кухни на 60 посадочных мест 4 НОЯБРЯ -
4 НОЯБРЯ - Влияние электрического поля на рост кристаллов
Влияние электрического поля на рост кристаллов Аутизм, вызовы и решения. VII Международная научно-практическая конференция
Аутизм, вызовы и решения. VII Международная научно-практическая конференция науменко_анна_николаевна_студия_машинной_вышивки_фин_модель_2_этап (1)
науменко_анна_николаевна_студия_машинной_вышивки_фин_модель_2_этап (1) WEAPONRY
WEAPONRY