Содержание
- 2. Основания, их классификация и свойства в свете теории электролитической диссоциации
- 3. 1) сформировать понятие об основаниях как электролитах; 2) рассмотреть классификацию оснований по различным признакам; 3) познакомить
- 4. ЗАДАЧИ УРОКА: 1) учиться проводить химические реакции и записывать уравнения химических реакций в молекулярной, полной и
- 5. Основания - это сложные вещества, в которых атом металла связан с одной или несколькими гидроксогруппами (ОН).
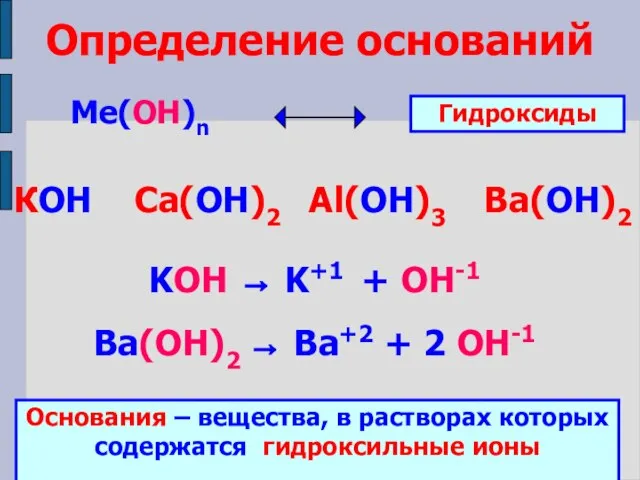
- 6. Определение оснований Ме(ОН)n КОН Ca(ОН)2 Al(ОН)3 Ba(ОН)2 Гидроксиды KOH → K+1 + OH-1 Ba(ОН)2 → Ba+2
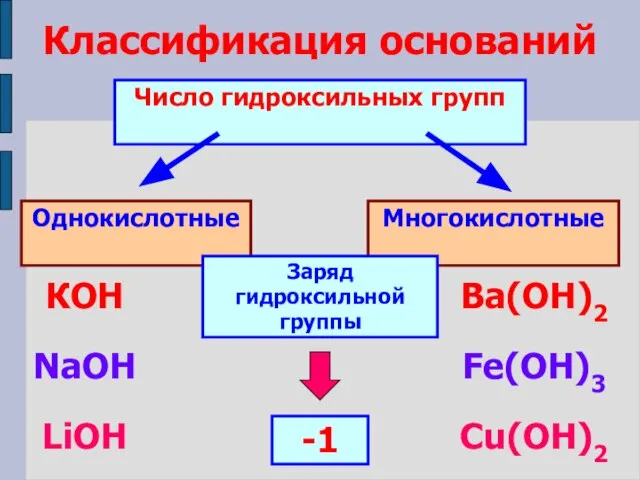
- 7. Классификация оснований Число гидроксильных групп Однокислотные Многокислотные КОН NaOH LiOH Ba(ОН)2 Fe(OH)3 Cu(OH)2 Заряд гидроксильной группы
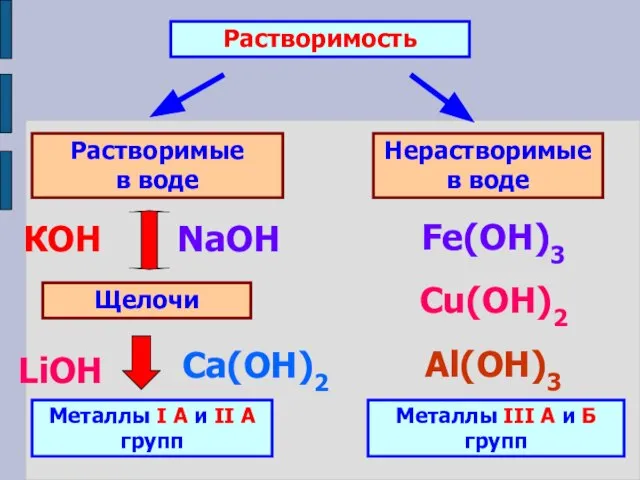
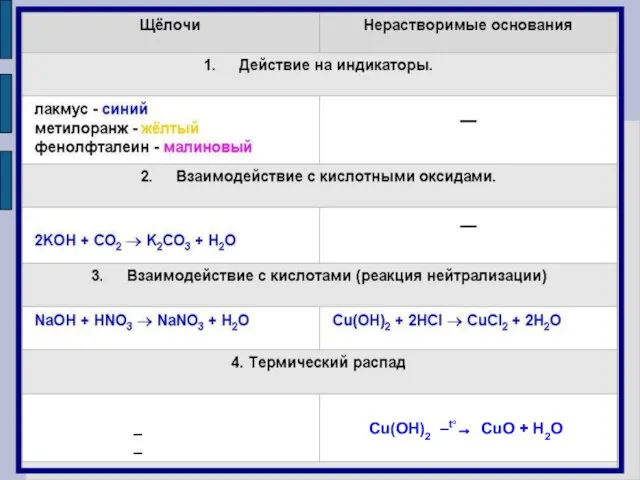
- 8. Растворимость Растворимые в воде Нерастворимые в воде Щелочи Металлы I А и II А групп КОН
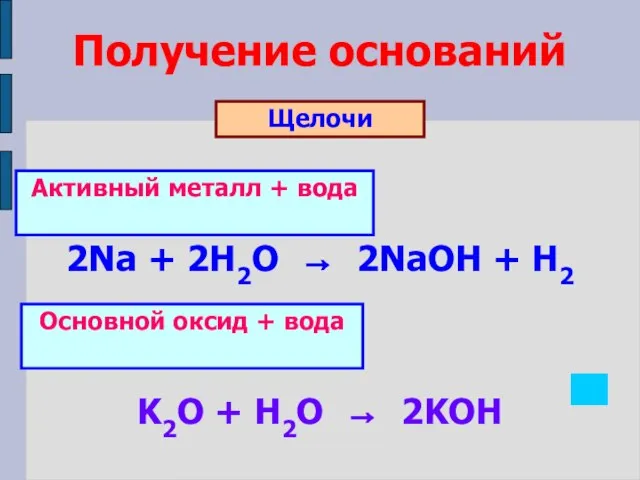
- 10. Получение оснований Щелочи 2Na + 2H2O → 2NaOH + H2 K2O + H2O → 2KOH Активный
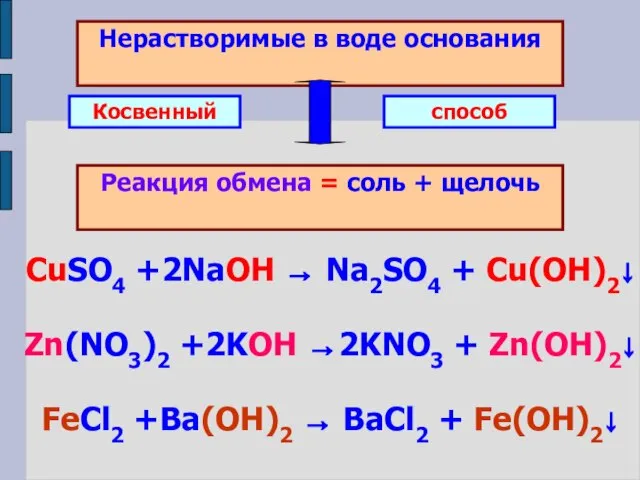
- 11. Нерастворимые в воде основания Реакция обмена = соль + щелочь Косвенный способ CuSO4 +2NaOH → Na2SO4
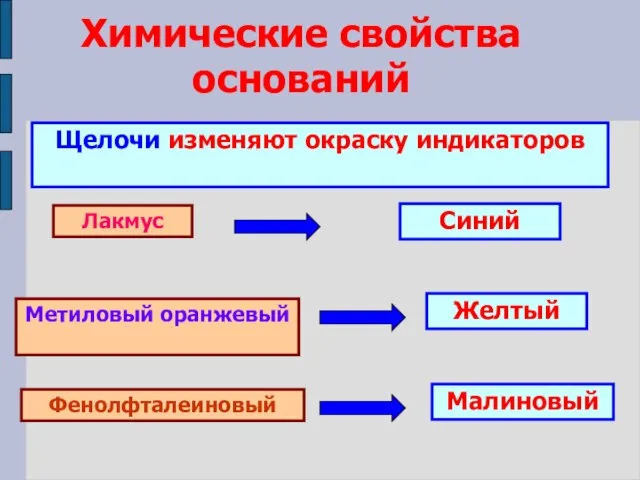
- 12. Химические свойства оснований Щелочи изменяют окраску индикаторов Лакмус Метиловый оранжевый Фенолфталеиновый Синий Желтый Малиновый
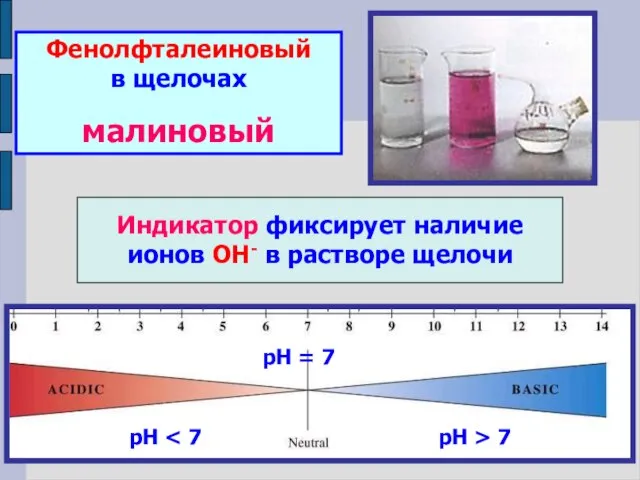
- 13. Фенолфталеиновый в щелочах малиновый Индикатор фиксирует наличие ионов ОН- в растворе щелочи рН рН = 7
- 20. Cu(OH)2 –t°→ CuO + H2O ––
- 22. Рефлексия: Вариант 1 Вариант2 1. Данны вещества: CaO, AI(OH)3, HCI, KOH, Na2SO4, MgO, BA(OH)2, H2SO4, N2O5,
- 24. Скачать презентацию













 Интернет-зависимость
Интернет-зависимость АППЛИКАЦИЯ В ДЕТСКОМ САДУ
АППЛИКАЦИЯ В ДЕТСКОМ САДУ Прародитель «неуловимых»
Прародитель «неуловимых» Байкеры
Байкеры Презентация на тему Новогодняя красавица «Ёлочка из перьев»
Презентация на тему Новогодняя красавица «Ёлочка из перьев»  The main functions of intonation
The main functions of intonation Методология исследования
Методология исследования Еда. Вспомни изученные слова
Еда. Вспомни изученные слова Дни науки и техники
Дни науки и техники Председатель Комитета по транспортно-транзитной политике Н.А.Асаул Заседание Правительства Санкт-Петербурга 21 июля 2009 года Об отр
Председатель Комитета по транспортно-транзитной политике Н.А.Асаул Заседание Правительства Санкт-Петербурга 21 июля 2009 года Об отр Памятка_сотруднику_действия_при_вручении_повестки
Памятка_сотруднику_действия_при_вручении_повестки Школьные фобии
Школьные фобии Санный спорт
Санный спорт Совершенствование процесса доения коров и первичной обработки молока в КФХ Тройнин
Совершенствование процесса доения коров и первичной обработки молока в КФХ Тройнин Группа продленного дня в школе (методические рекомендации)
Группа продленного дня в школе (методические рекомендации) ГТО – это спорт, а спорт это жизнь! 3 класс
ГТО – это спорт, а спорт это жизнь! 3 класс Смехач и небожители: свидетельства об античной религии в сборнике Φιλόγελως
Смехач и небожители: свидетельства об античной религии в сборнике Φιλόγελως Концепт беспилотного автомобиля
Концепт беспилотного автомобиля Каша – матушка наша
Каша – матушка наша International. MINE. Awareness day
International. MINE. Awareness day «Кометы вблизи.Комета Галлея»
«Кометы вблизи.Комета Галлея» Геометрия крыла
Геометрия крыла Фанатское движение
Фанатское движение SP_Osen_2022_Izh
SP_Osen_2022_Izh Итоги Декады качества предоставления государственных услуг в сфере социальной поддержки и социального обслуживания населения
Итоги Декады качества предоставления государственных услуг в сфере социальной поддержки и социального обслуживания населения Презентация на тему Классицизм в архитектуре Западной Европы
Презентация на тему Классицизм в архитектуре Западной Европы  Деловая этика и корпоративная культура
Деловая этика и корпоративная культура Тема материнства в живописи
Тема материнства в живописи