Особенности оформления документов с целью замены регистрационного удостоверения на медицинское изделие
Содержание
- 2. Федеральная служба по надзору в сфере здравоохранения О порядке подготовки и оформления документов для целей внесения
- 3. Федеральная служба по надзору в сфере здравоохранения Особенности оформления документов с целью замены регистрационного удостоверения на
- 4. Замена регистрационного удостоверения на медицинское изделие Постановление Правительства Российской Федерации от 27.12.2012 № 1416 «Об утверждении
- 5. Регистрационные удостоверения на медицинское изделие, не подлежащие замене Регистрационные удостоверения, выданные после 1 января 2013 года
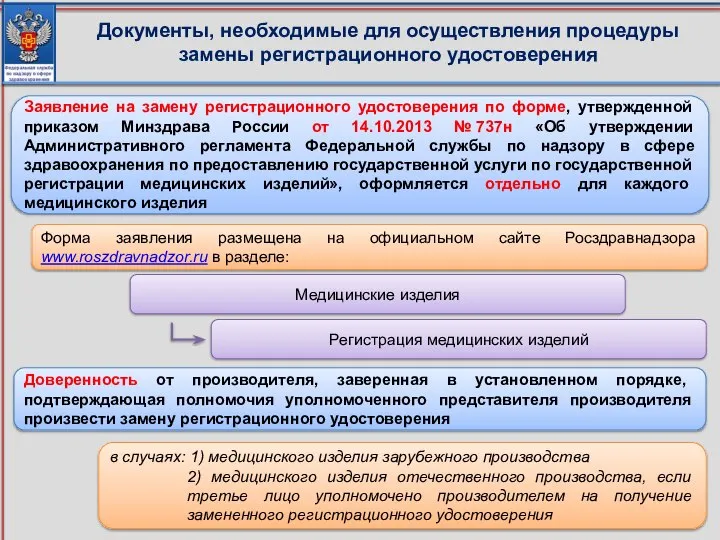
- 6. Документы, необходимые для осуществления процедуры замены регистрационного удостоверения Заявление на замену регистрационного удостоверения по форме, утвержденной
- 7. Наиболее часто встречающиеся основания для отказа в замене регистрационных удостоверений на медицинское изделие Некорректное оформление доверенности
- 8. Наиболее часто встречающиеся основания для отказа в замене регистрационных удостоверений на медицинское изделие Несоответствие сведений, указанных
- 9. Иные вопросы, возникающие при замене регистрационных удостоверений на медицинское изделие Процедура замены регистрационного удостоверения осуществляется Росздравнадзором
- 11. Федеральная служба по надзору в сфере здравоохранения Порядок подачи заявления и документов на внесение изменений в
- 12. Нормативно-правовые акты, применяемые при подготовке документов для процедуры внесения изменений в регистрационное удостоверение 1. Постановление Правительства
- 13. Государственная пошлина за процедуру внесения изменений в регистрационное удостоверение на медицинское изделие Согласно ст. 333.32.2 Налогового
- 14. Кто такой заявитель? Согласно пункту 8 Правил государственной регистрации, заявителем является: 1. Разработчик 2. Производитель медицинского
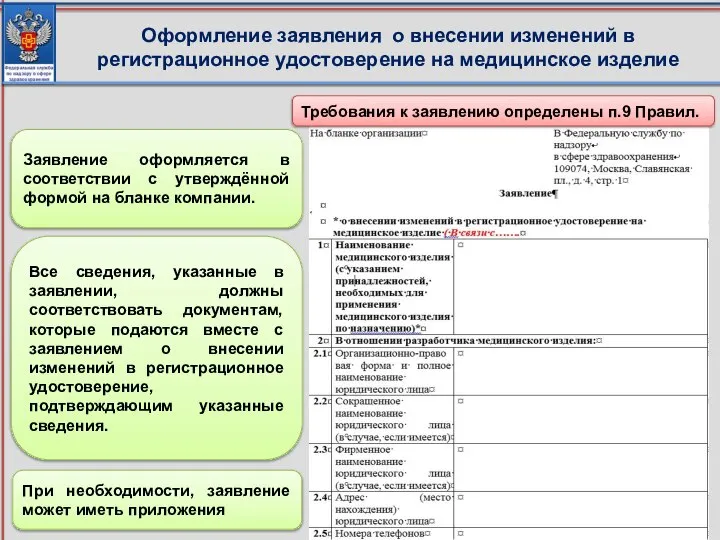
- 15. Оформление заявления о внесении изменений в регистрационное удостоверение на медицинское изделие Требования к заявлению определены п.9
- 16. п. 6 Административного регламента Федеральной службы по надзору в сфере здравоохранения по предоставлению государственной услуги по
- 17. Внесение изменений в регистрационное удостоверение согласно подпункту «а» п.37 Правил а) изменение сведений о заявителе (производителе):
- 18. Реорганизация юридического лица и (или) смена адреса места нахождения юридического лица Документы, подтверждающие такие изменения, например:
- 19. Изменение наименования заявителя (производителя) Письмо от производителя, в котором содержатся пояснения о характере внесенных изменений, а
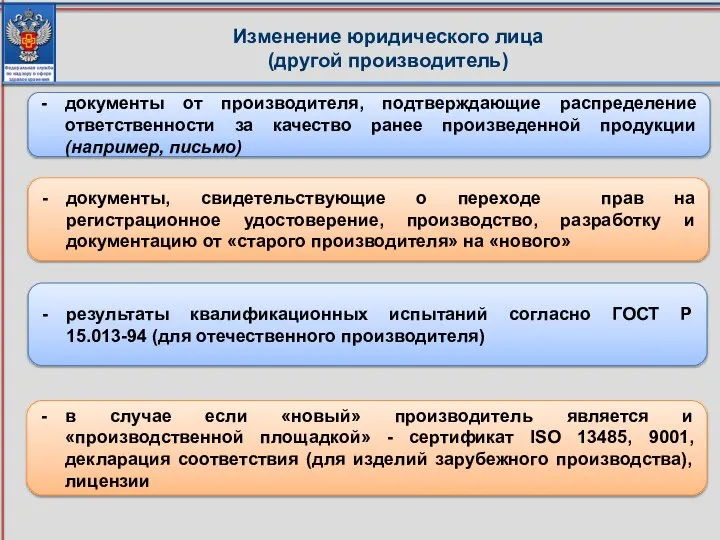
- 20. Изменение юридического лица (другой производитель) документы от производителя, подтверждающие распределение ответственности за качество ранее произведенной продукции
- 21. Изменение адреса места производства медицинского изделия согласно подпункту «б» п.37 Правил государственной регистрации медицинских изделий документы,
- 22. Изменение наименования медицинского изделия согласно подпункту «в» п.37 Правил государственной регистрации медицинских изделий заявление с указанием
- 23. Изменение сведений о юридическом лице, на имя которого может быть выдано регистрационное удостоверение, согласно подпункту «г»
- 24. Указание вида медицинского изделия согласно подпункту «д» п.37 Правил заявление с указанием вида медицинского изделия сведения
- 25. Пункт 38 Правил государственной регистрации медицинских изделий Для внесения изменений в регистрационное удостоверение заявитель не позднее
- 26. Обращаем Внимание! При принятии решения о внесении изменений в регистрационное удостоверение регистрирующий орган оформляет и выдает
- 28. Федеральная служба по надзору в сфере здравоохранения Требования к документам, представляемым заявителем с целью получения дубликата
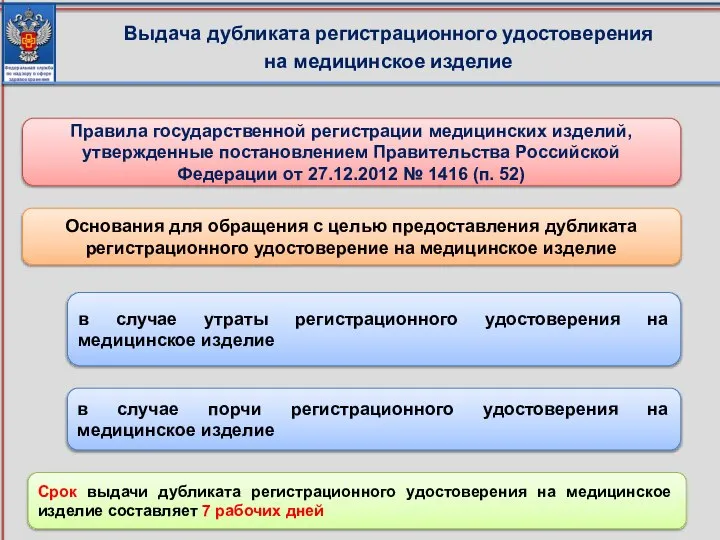
- 29. Выдача дубликата регистрационного удостоверения на медицинское изделие Правила государственной регистрации медицинских изделий, утвержденные постановлением Правительства Российской
- 30. Документы и сведения, предоставляемые для выдачи дубликата регистрационного удостоверения на медицинское изделие Заявление о выдаче дубликата
- 31. Доверенность от производителя медицинского изделия на выдачу дубликата регистрационного удостоверения с заверенным в установленном порядке переводом
- 32. Часто встречающиеся основания для отказа в выдаче дубликата регистрационного удостоверения на медицинское изделие Некорректное оформление доверенности
- 34. Федеральная служба по надзору в сфере здравоохранения Основные нарушения и недостатки при рассмотрении комплектов регистрационной документации
- 35. Нормативно-правовые акты, регламентирующие процедуры регистрации медицинских изделий и внесения изменений в регистрационные удостоверения на медицинские изделия
- 36. Государственная пошлина, предусмотренная налоговым законодательством Российской Федерации за процедуру внесения изменений в регистрационные документы Государственная пошлина
- 37. Внесение изменений в регистрационную документацию (п. 55 Правил) В случае необходимости (по желанию заявителя) внесения изменений
- 38. Внесение изменений в регистрационную документацию (п. 55 Правил) В случае необходимости внесения изменений в документы, указанные
- 39. Внесение изменений в регистрационную документацию (п. 55 Правил) Вне зависимости от причины внесения изменений всегда представляется
- 40. Внесение изменений в регистрационную документацию (п. 55 Правил) Основаниями для вынесения экспертным учреждением заключения о невозможности
- 41. В случае если внесение изменений в техническую и (или) эксплуатационную документацию касаются: Росздравнадзор самостоятельно (без проведения
- 42. Документы, необходимые для внесения изменений в регистрационное досье по п.55 Правил 1. Окончание срока действия технических
- 43. Документы, необходимые для внесения изменений в регистрационное досье по п.55 Правил 3. Изменение маркировки или упаковки
- 44. Документы, необходимые для внесения изменений в регистрационное досье по п.55 Правил 5. Изменение показаний (противопоказаний) к
- 46. Федеральная служба по надзору в сфере здравоохранения Требования к технической и эксплуатационной документации на медицинское изделие,
- 47. Необходимость предоставления технической и эксплуатационной документации Необходимость предоставления технической и эксплуатационной документации при внесении изменений в
- 48. Необходимость предоставления технической и эксплуатационной документации в рамках п. 37 Правил государственной регистрации медицинских изделий Пункт
- 49. Необходимость предоставления технической и эксплуатационной документации в рамках п. 55 Правил государственной регистрации медицинских изделий Пункт
- 50. Техническая документация производителя (изготовителя) Требования к технической документации установлены в пункте 4 Правил государственной регистрации медицинских
- 51. Эксплуатационная документация производителя (изготовителя) Требования к эксплуатационной документации установлены в пункте 4 Правил государственной регистрации медицинских
- 52. Возможные варианты изменений, требующие актуализации технической и эксплуатационной документации Изменение наименования изделия Сведения о неизменности функционального
- 53. Основные несоответствия технической и эксплуатационной документации производителя (изготовителя) Основные несоответствия Изменилось функциональное назначение Расширились модельные и
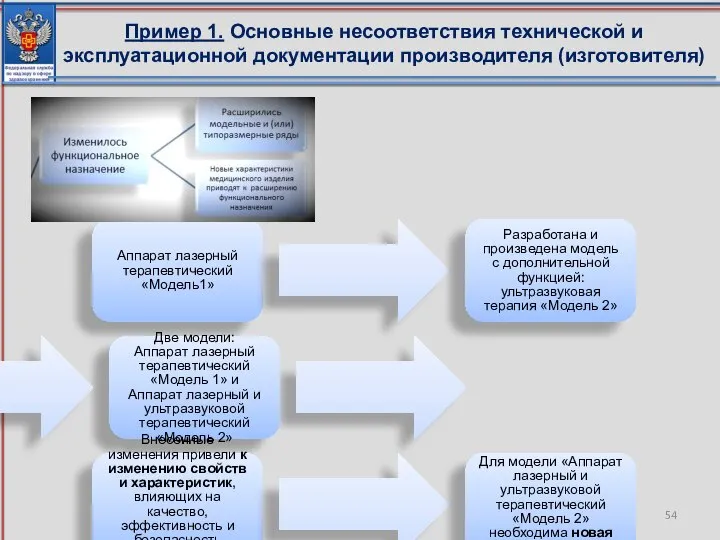
- 54. Пример 1. Основные несоответствия технической и эксплуатационной документации производителя (изготовителя) Аппарат лазерный терапевтический «Модель1» Разработана и
- 55. Пример 2. Основные несоответствия технической и эксплуатационной документации производителя (изготовителя) Изменены функциональные характеристики и параметры (улучшены)
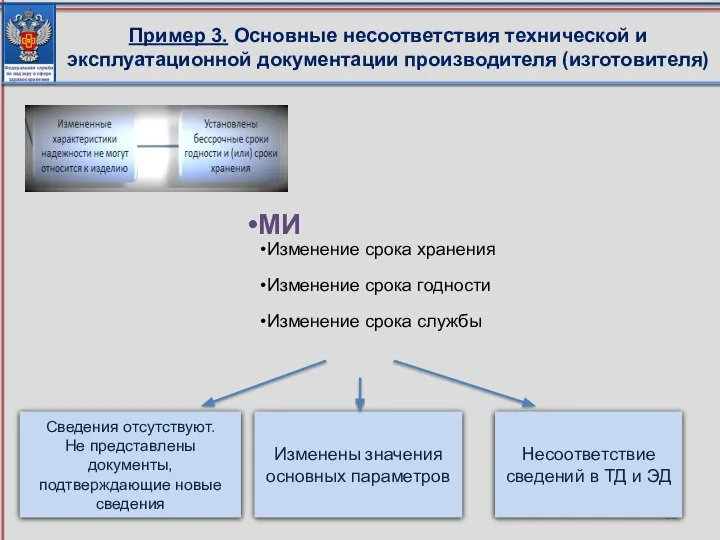
- 56. Пример 3. Основные несоответствия технической и эксплуатационной документации производителя (изготовителя) МИ Изменение срока хранения Изменение срока
- 57. Основные рекомендации для производителя при внесении изменений по п.55 Правил государственной регистрации медицинских изделий документировать все
- 59. Федеральная служба по надзору в сфере здравоохранения Особенности оценки результатов технических испытаний при проведении экспертизы по
- 60. Пункт 55 - В случае необходимости (по желанию заявителя) внесения изменений в документы, предусмотренные подпунктом "а"
- 61. Пункт 4 Правил государственной регистрации медицинских изделий, утвержденных постановлением Правительства Российской Федерации от 27.12.2012 № 1416:
- 62. Оформление результатов технических испытаний для подтверждения внесенных изменений производится в соответствии с Приказ Минздрава России от
- 63. В п. 5 приказа Минздрава России от 09.01.2014 № 2н установлено: «Технические испытания медицинских изделий проводятся
- 64. Порядок проведения технических испытаний медицинских изделий при внесении изменений В рамках оценки и анализа данных проводятся:
- 65. Перечень документов, которые предоставляет Заявитель для проведения технических испытаний (п. 9 приказа Минздрава России от 09.01.2014
- 66. Акт результатов технических испытаний измененного медицинского изделия и Приложения к нему: фотографическое изображение общего вида медицинского
- 67. Перечень документов, подтверждающих результаты технических испытаний медицинских изделий при внесении изменений Акт Программа технических испытаний Фотографии
- 68. Перечень документов, подтверждающих результаты технических испытаний медицинских изделий при внесении изменений Акт оценки результатов технических испытаний
- 69. Структура Программы технических испытаний медицинских изделий при внесении изменений - вводная часть; - рассмотрение технической и
- 70. Структура и содержание протоколов испытаний (рекомендуемая) ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных
- 71. Структура и содержание протоколов испытаний (рекомендуемая) - результаты проведенных испытаний медицинского изделия и его принадлежностей по
- 72. Распространенные замечания по результатам оценки протоколов технических испытаний внесенных изменений Испытания проведены на соответствие недействующим национальным
- 73. Рекомендации для проведения технических испытаний при внесении изменений в документацию Проверить наличие действующей аккредитации у лаборатории
- 75. Федеральная служба по надзору в сфере здравоохранения Особенности оценки результатов токсикологических исследований при проведении экспертизы по
- 76. Пункт 4 Правил государственной регистрации медицинских изделий, утвержденных постановлением Правительства Российской Федерации от 27.12.2012 № 1416:
- 77. Оформление результатов токсикологических исследований для подтверждения внесенных изменений производится в соответствии с Приказом Минздрава России от
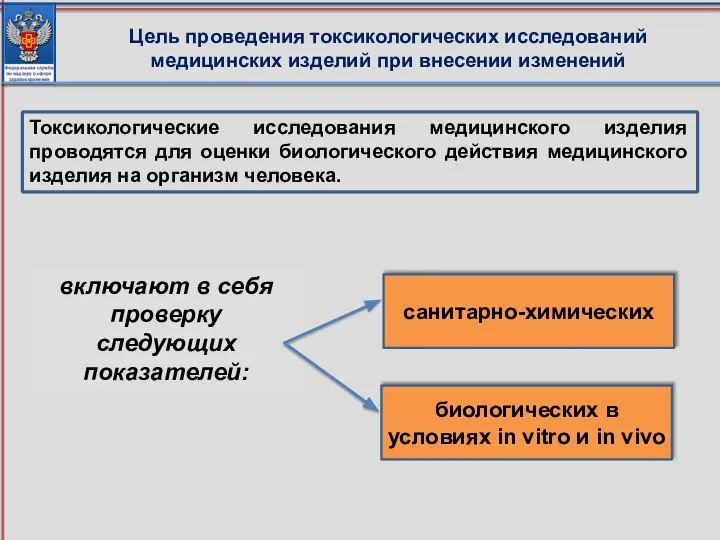
- 78. биологических в условиях in vitro и in vivo санитарно-химических Цель проведения токсикологических исследований медицинских изделий при
- 79. а) заявление о проведении токсикологических исследований; б) образцы (образец) медицинского изделия или принадлежности, к медицинскому изделию,
- 80. идентификация медицинского изделия (материала); классификация медицинского изделия; определение длительности контакта медицинского изделия с организмом человека; анализ
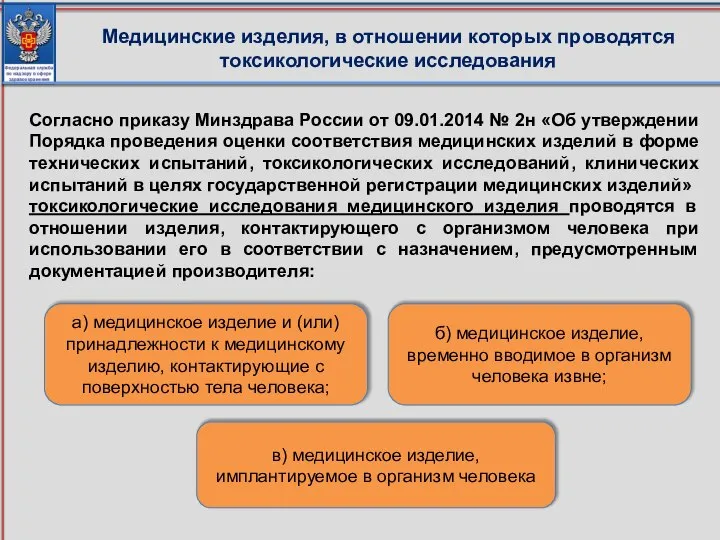
- 81. Медицинские изделия, в отношении которых проводятся токсикологические исследования Согласно приказу Минздрава России от 09.01.2014 № 2н
- 82. Медицинские изделия по виду контакта с организмом человека подразделяют на несколько групп. Изделия, контактирующие непосредственно или
- 83. Программа токсикологических исследований составляется испытательной организацией совместно с заявителем и утверждается руководителем испытательной организации, проводящей токсикологические
- 84. Соблюдение положений стандартов серии ISO 10993 "Оценка биологического действия медицинских изделий" позволит обеспечить системный подход к
- 85. 1 этап: Санитарно-химические исследования Санитарно-химические исследования позволяют отбраковывать непригодную к применению в клинической практике продукцию. Результаты
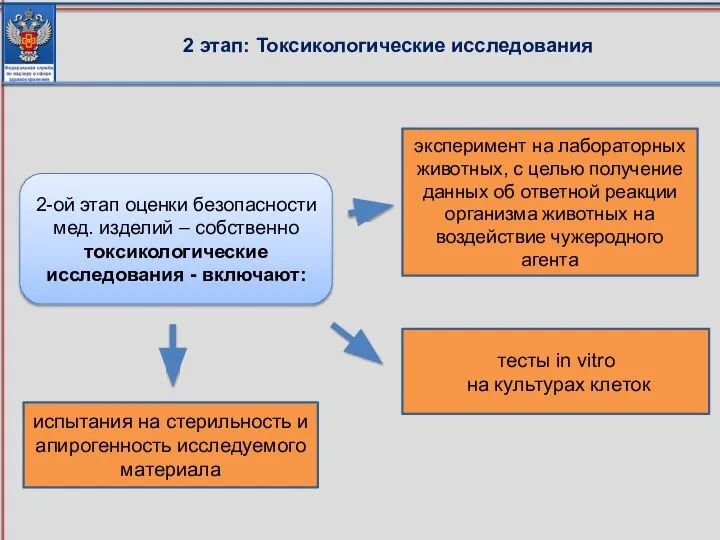
- 86. 2 этап: Токсикологические исследования испытания на стерильность и апирогенность исследуемого материала тесты in vitro на культурах
- 87. 2 этап: Токсикологические исследования - полноту и объективность установленных технической и эксплуатационной документацией производителя характеристик, подлежащих
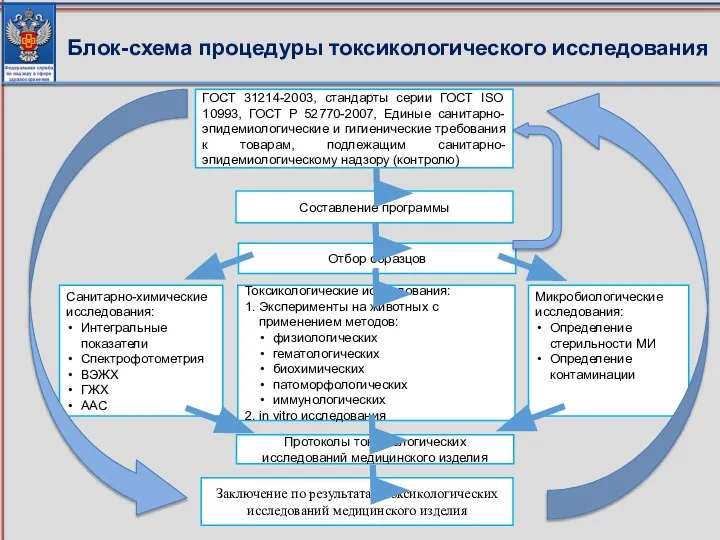
- 88. ГОСТ 31214-2003, стандарты серии ГОСТ ISO 10993, ГОСТ Р 52770-2007, Единые санитарно-эпидемиологические и гигиенические требования к
- 89. Оформляется заключение по результатам токсикологических исследований медицинского изделия, форма которого приведена в приложении № 3 к
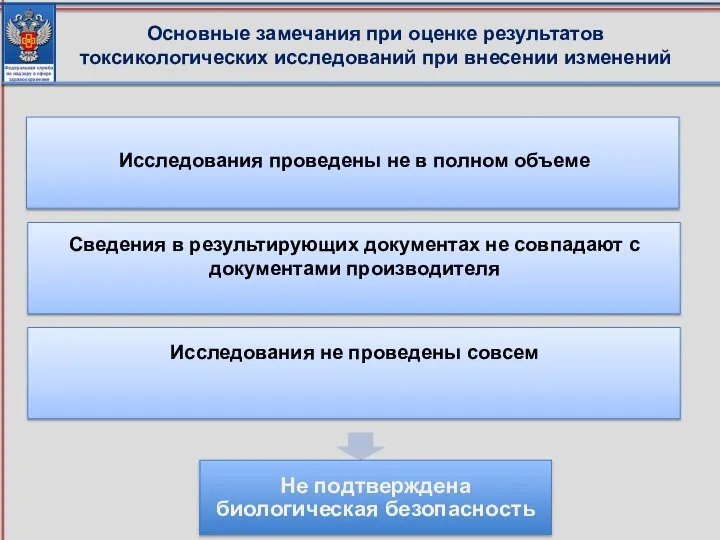
- 90. Исследования проведены не в полном объеме Сведения в результирующих документах не совпадают с документами производителя Исследования
- 91. Рекомендации для проведения токсикологических исследований при внесении изменений в документацию
- 93. Федеральная служба по надзору в сфере здравоохранения Особенности оценки результатов клинических испытаний при проведении экспертизы по
- 94. Нормативно-правовое регулирование при внесении изменений в регистрационное досье Порядок проведения оценки соответствия медицинских изделий в форме
- 95. Приложения и дополнения к Акту клинических испытаний Следует обратить особое внимание, что в качестве приложений Акт
- 96. Базы данных для поиска EMBASE – Escerpta Medica published by Elsevier CENTRAL – The Cochrane Central
- 97. Публикации о клинической эффективности медицинского изделия
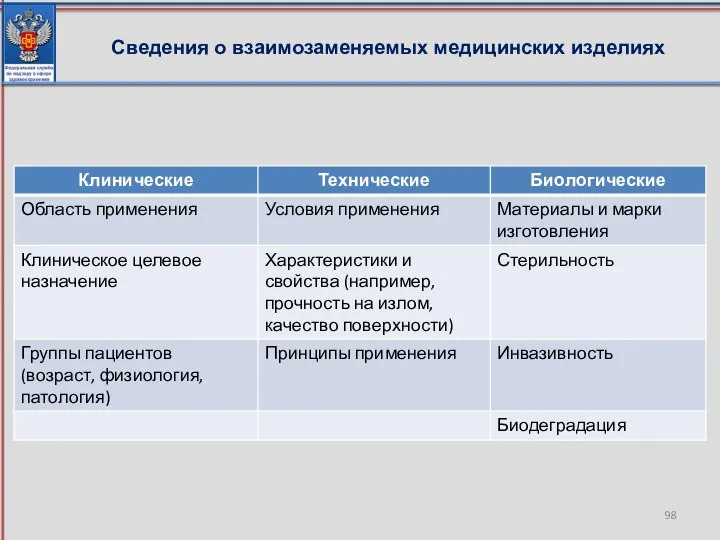
- 98. Сведения о взаимозаменяемых медицинских изделиях
- 99. Клинические испытания медицинских изделий для диагностики in vitro Клинические испытания медицинских изделий для диагностики in vitro
- 100. Результаты клинических испытаний считаются отрицательными: п. 45 Приказа Минздрава России от 09.01.2014 № 2н медицинское изделие
- 101. Основания для проведения клинических испытаний по п. 55 Правил государственной регистрации МИ Расширение показаний к применению
- 102. Пример 1. Расширение показаний к применению Изделие может использовать не только у взрослых, но и у
- 103. Пример 2. Уточнение/дополнение показаний к применению При неизменности функционального назначения и (или) принципа действия МИ Показания
- 104. Пример 3. Уточнение/дополнение противопоказаний к применению Противопоказания при регистрации МИ - Введение в область вокруг глаз
- 105. Пример 4. Уточнение/дополнение побочных эффектов при применении Новые побочные эффекты: - уплотнение или узелки в месте
- 106. Пример 5. Расширение области применения Области применения при регистрации: Шейный отдел позвоночника Запястье, кисть, пальцы Колени
- 107. Пример 6. Модернизация режима работы При неизменности функционального назначения и (или) принципа действия МИ Аппарат физиотерапевтический
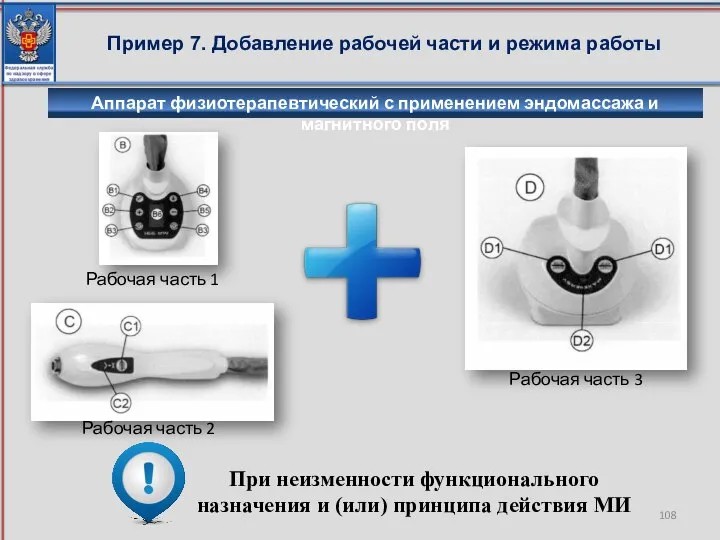
- 108. Пример 7. Добавление рабочей части и режима работы При неизменности функционального назначения и (или) принципа действия
- 109. Пример 8. Расширение условий применения При неизменности функционального назначения и (или) принципа действия МИ Тонометр Для
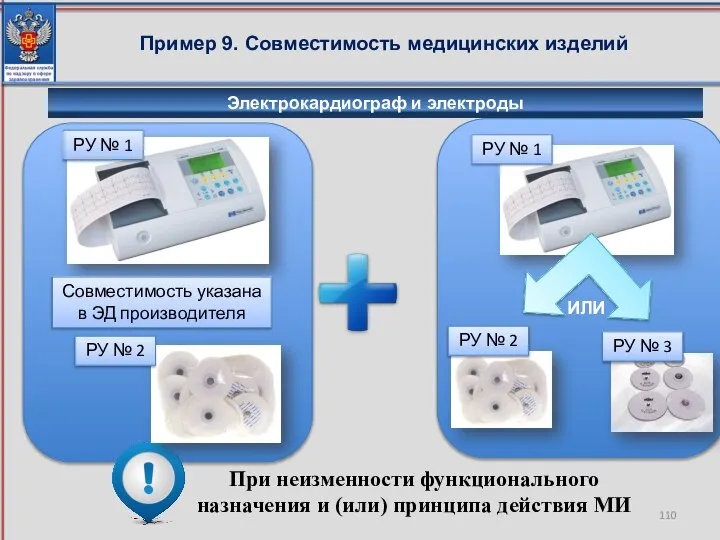
- 110. Пример 9. Совместимость медицинских изделий При неизменности функционального назначения и (или) принципа действия МИ РУ №
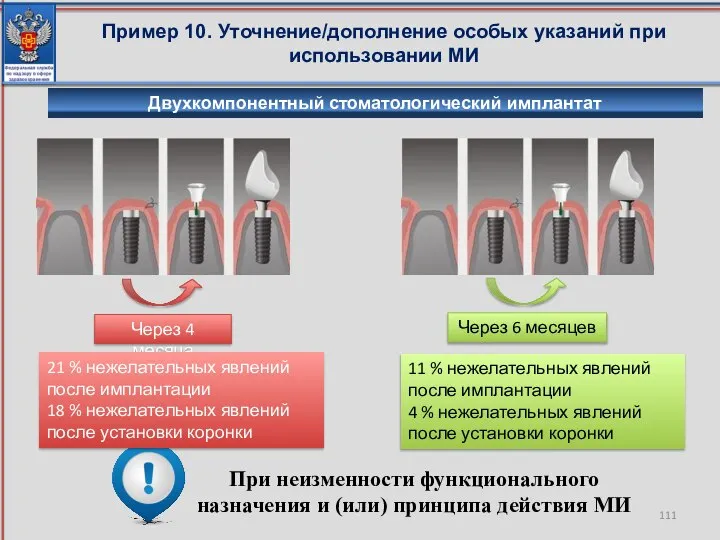
- 111. Пример 10. Уточнение/дополнение особых указаний при использовании МИ При неизменности функционального назначения и (или) принципа действия
- 112. Федеральная служба по надзору в сфере здравоохранения Анализ запросов о предоставлении дополнительных материалов и сведений и
- 113. п. 26: При внесении изменений в документы, указанные в подпунктах "в" и "г" пункта 10 Правил,
- 114. В случае недостаточности для вынесения экспертом заключения материалов и сведений, содержащихся в представленных заявителем заявлении о
- 115. Основаниями для вынесения экспертным учреждением заключения о невозможности внесения изменений в документы, предусмотренные подпунктами "в" и
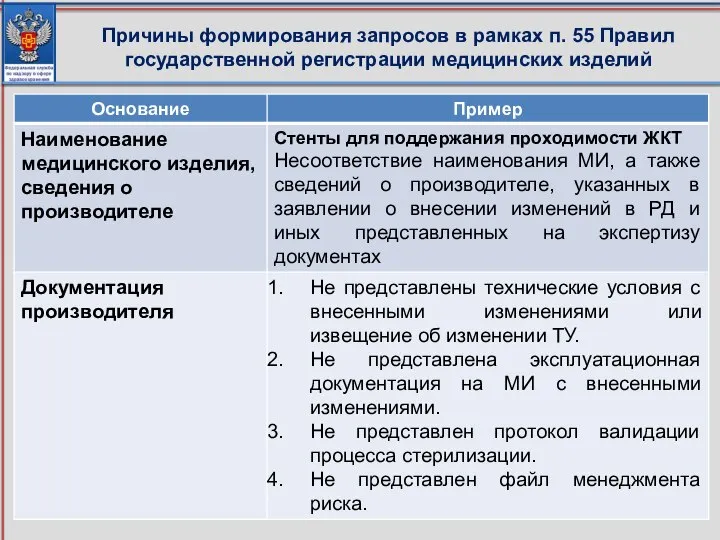
- 116. Причины формирования запросов в рамках п. 55 Правил государственной регистрации медицинских изделий
- 117. Причины формирования запросов в рамках п. 55 Правил государственной регистрации медицинских изделий
- 118. Причины формирования запросов в рамках п. 55 Правил государственной регистрации медицинских изделий
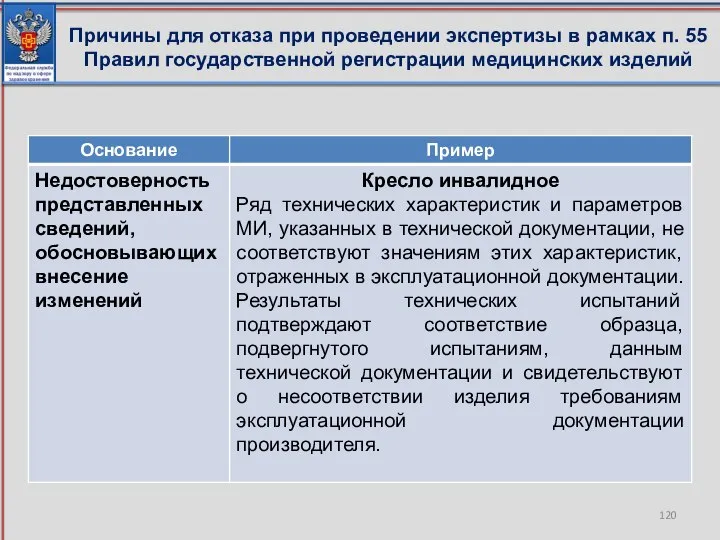
- 119. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
- 120. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
- 121. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
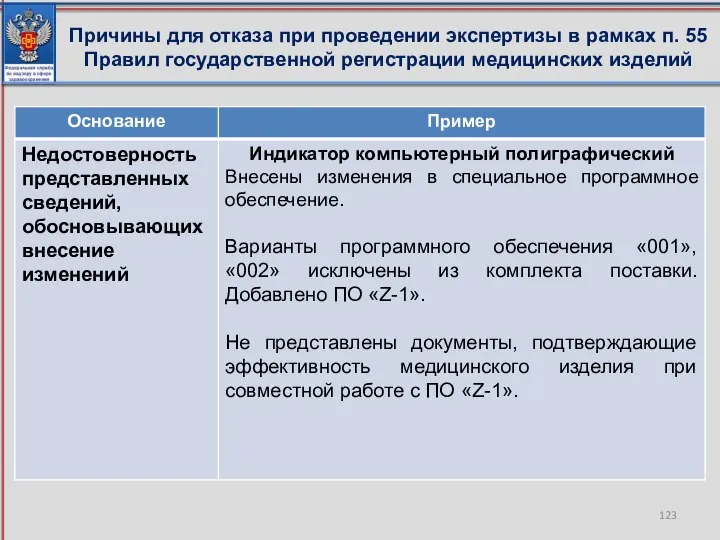
- 122. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
- 123. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
- 124. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
- 125. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
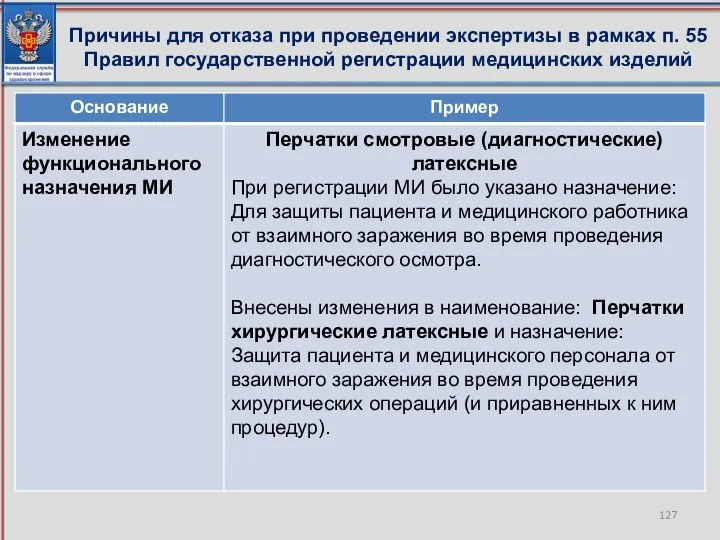
- 126. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
- 127. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
- 128. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
- 129. Причины для отказа при проведении экспертизы в рамках п. 55 Правил государственной регистрации медицинских изделий
- 130. Федеральная служба по надзору в сфере здравоохранения Спасибо за внимание! [email protected]
- 132. Скачать презентацию













































































































 ПРОЕКТ «ЗЕЛЕНОЕ ДЕТСТВО»
ПРОЕКТ «ЗЕЛЕНОЕ ДЕТСТВО» тест
тест FLAG OF ENGLAND
FLAG OF ENGLAND  Презентация на тему Час Земли
Презентация на тему Час Земли В 1663 году из гонимых за старую веру образовалась деревня Ново-Алейка. Основатели ее – старообрядцы Матвей и Ларион Лазурины, Валех
В 1663 году из гонимых за старую веру образовалась деревня Ново-Алейка. Основатели ее – старообрядцы Матвей и Ларион Лазурины, Валех Моря, озёра и реки России
Моря, озёра и реки России Проект на тему: Фэн-шуй ( | ) в классной комнате. - презентация
Проект на тему: Фэн-шуй ( | ) в классной комнате. - презентация Презентация на тему Skype
Презентация на тему Skype Булочки синабон
Булочки синабон Человеческий капитал = Профильный актив?!
Человеческий капитал = Профильный актив?! Я и полиция
Я и полиция Исключения из страхового покрытия и основания для освобождения страховщика от осуществления страховой выплаты: правовая природа
Исключения из страхового покрытия и основания для освобождения страховщика от осуществления страховой выплаты: правовая природа  Презентация на тему Античный период
Презентация на тему Античный период  пример РП по ФГОС
пример РП по ФГОС Презентация на тему Плутон
Презентация на тему Плутон ЦРП-2 23.09.22
ЦРП-2 23.09.22 Расширенная программа сессии Кузбасский Университариум Стратега
Расширенная программа сессии Кузбасский Университариум Стратега Сиднейский оперный театр
Сиднейский оперный театр Урок Мир вокруг нас в 1 классе. Автор: учитель начальных классов МОУ СОШ №2 с.Арзгир Концевая Н.Д.
Урок Мир вокруг нас в 1 классе. Автор: учитель начальных классов МОУ СОШ №2 с.Арзгир Концевая Н.Д. Двоичная арифметика
Двоичная арифметика Пышная фатиновая юбка – модный тренд. Кроим и шьем
Пышная фатиновая юбка – модный тренд. Кроим и шьем Обращения
Обращения ОПРЕДЕЛЕНИЕ НАПРЯЖЕНИЙ В ГРУНТАХ
ОПРЕДЕЛЕНИЕ НАПРЯЖЕНИЙ В ГРУНТАХ Роль психолога в период адаптации первоклассников
Роль психолога в период адаптации первоклассников Оборудование для бургерных
Оборудование для бургерных Специальные объекты ландшафтного проектирования. Лекция 3
Специальные объекты ландшафтного проектирования. Лекция 3 Презентация на тему Йемен
Презентация на тему Йемен «Детский мобильный интернет» вовлечение ЦА в создание продукта
«Детский мобильный интернет» вовлечение ЦА в создание продукта