Содержание
- 2. ОФИЦИАЛЬНАЯ ПС ЭЛЕМЕНТОВ ИЮПАК (2012 г.)
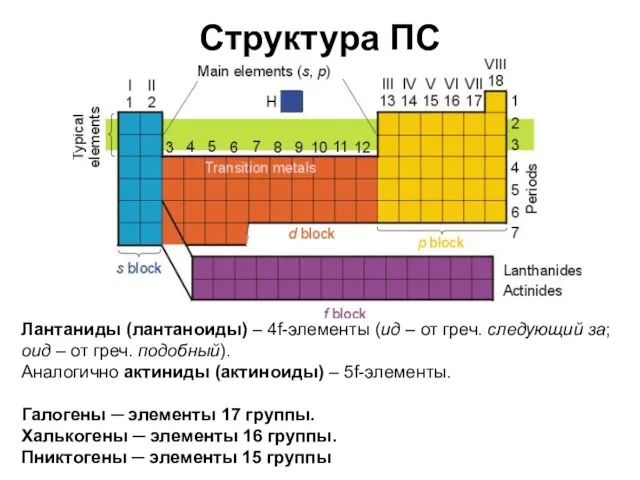
- 3. Структура ПС Лантаниды (лантаноиды) – 4f-элементы (ид – от греч. следующий за; оид – от греч.
- 4. Закономерности изменения свойств атомов и ионов Одна из основных характеристик атомов и ионов – их размеры.
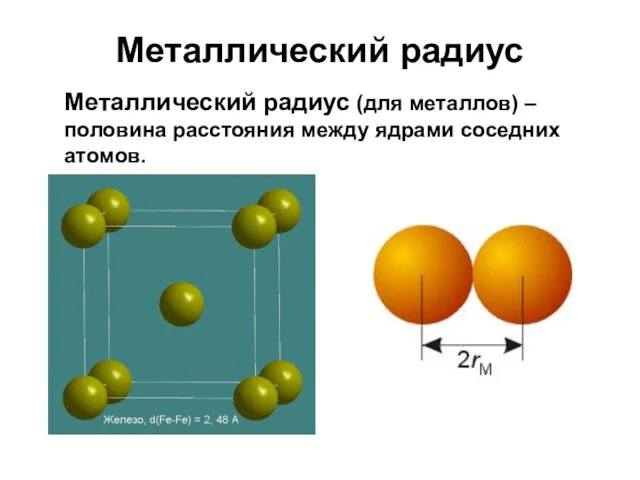
- 5. Металлический радиус Металлический радиус (для металлов) – половина расстояния между ядрами соседних атомов.
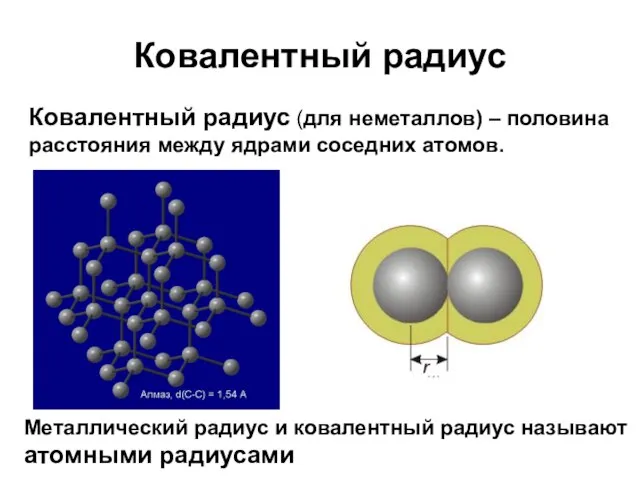
- 6. Ковалентный радиус Ковалентный радиус (для неметаллов) – половина расстояния между ядрами соседних атомов. Металлический радиус и
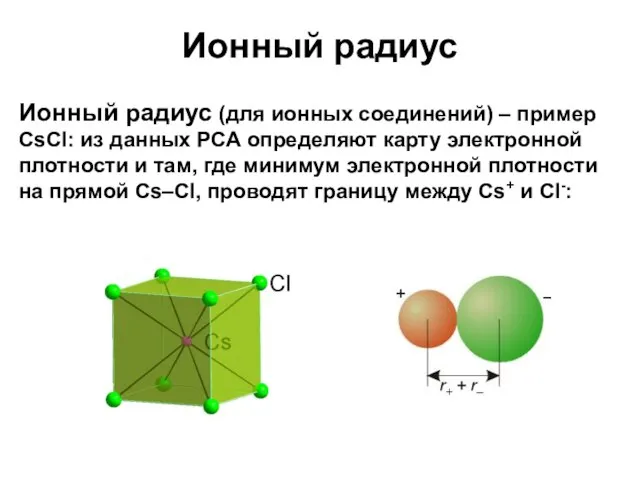
- 7. Ионный радиус Ионный радиус (для ионных соединений) – пример CsCl: из данных РСА определяют карту электронной
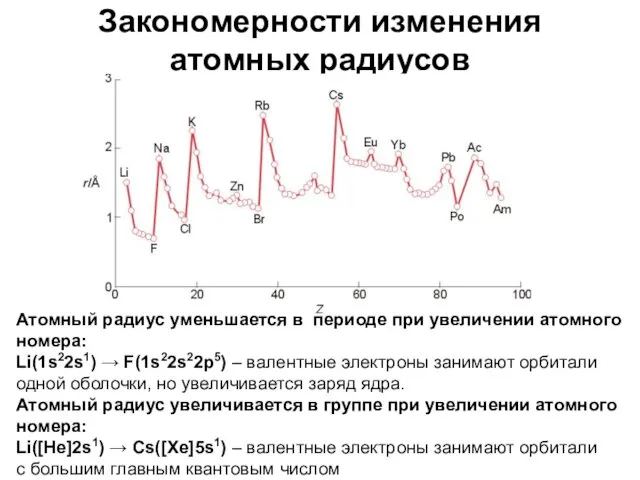
- 8. Закономерности изменения атомных радиусов Атомный радиус уменьшается в периоде при увеличении атомного номера: Li(1s22s1) → F(1s22s22p5)
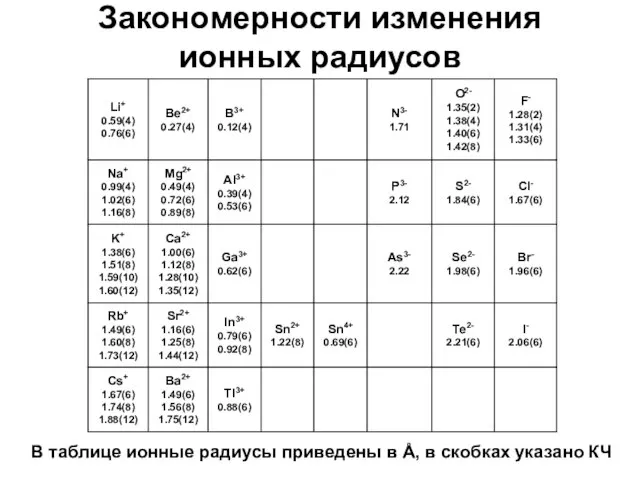
- 9. Закономерности изменения ионных радиусов В таблице ионные радиусы приведены в Å, в скобках указано КЧ
- 10. Закономерности изменения ионных радиусов Ионный радиус зависит от координационного окружения (КЧ) – чем больше КЧ, тем
- 11. Закономерности изменения ионных радиусов для переходных металлов В периоде Ti2+ (1,00 Å) → Ni2+ (0,83 Å)
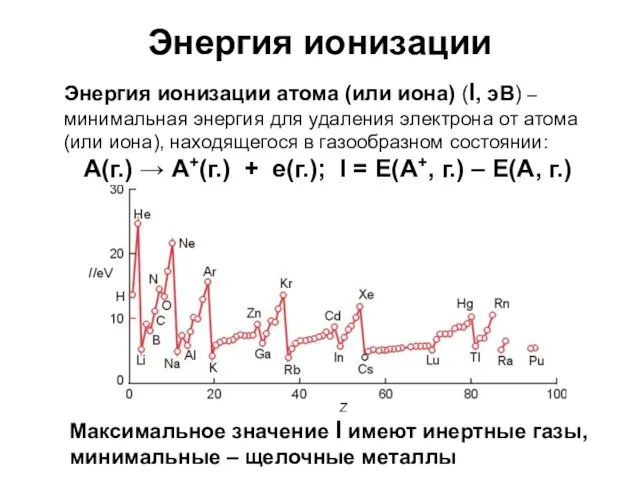
- 12. Энергия ионизации Энергия ионизации атома (или иона) (I, эВ) – минимальная энергия для удаления электрона от
- 13. Энергия ионизации Горизонтальная периодичность – в пределах одного периода значения I увеличиваются, так как увеличивается заряд
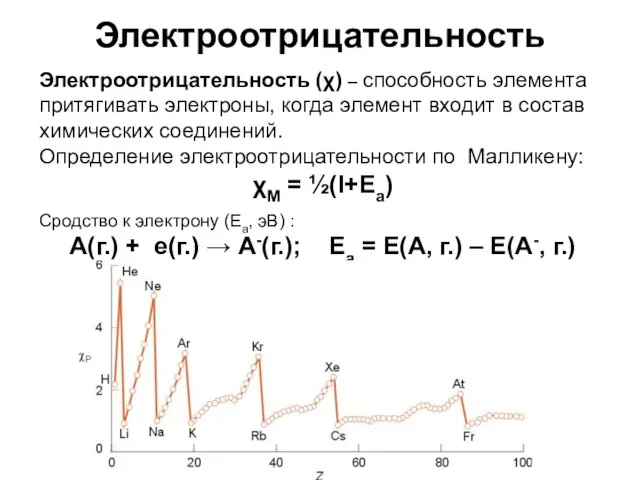
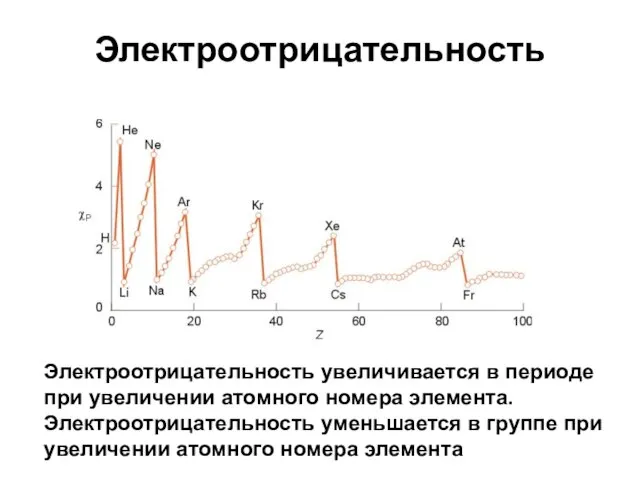
- 14. Электроотрицательность Электроотрицательность (χ) – способность элемента притягивать электроны, когда элемент входит в состав химических соединений. Определение
- 15. Электроотрицательность Электроотрицательность увеличивается в периоде при увеличении атомного номера элемента. Электроотрицательность уменьшается в группе при увеличении
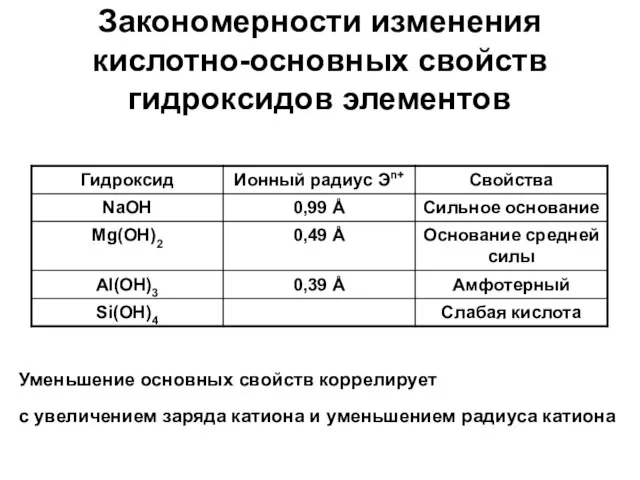
- 16. Закономерности изменения кислотно-основных свойств гидроксидов элементов Основные свойства: ЭОН → Э+ + ОН- Кислотные свойства: ЭОН
- 17. Закономерности изменения кислотно-основных свойств гидроксидов элементов Уменьшение основных свойств коррелирует с увеличением заряда катиона и уменьшением
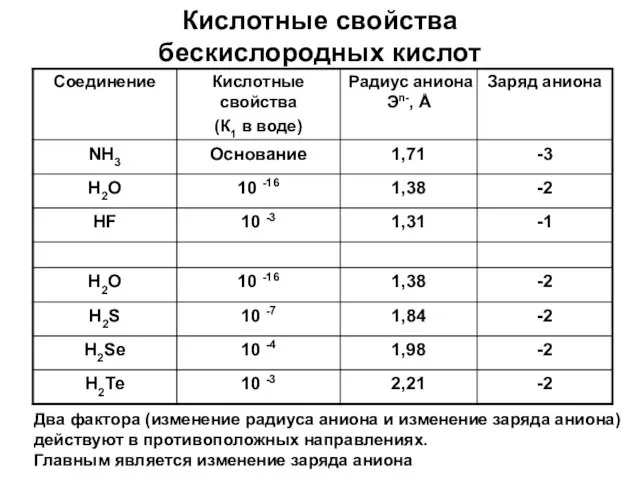
- 18. Кислотные свойства бескислородных кислот Два фактора (изменение радиуса аниона и изменение заряда аниона) действуют в противоположных
- 19. Некоторые закономерности изменения окислительно-восстановительных свойств Э + 2е + 2Н+ → Н2Э (Э – халькоген) Окислительные
- 20. Окислительно-восстановительные свойства соединений элементов в высших степенях окисления Главные элементы – s и p: 14 группа:
- 22. Скачать презентацию








 Предложение по перспективному развитию военного городка отдельного медико-санитарного батальона г. Балашиха
Предложение по перспективному развитию военного городка отдельного медико-санитарного батальона г. Балашиха Язык современной Интернет - субкультуры
Язык современной Интернет - субкультуры Отцовская доблесть. Семья Канчуриных
Отцовская доблесть. Семья Канчуриных Кто хочет стать миллионером (разовая игра 15 вопросов)
Кто хочет стать миллионером (разовая игра 15 вопросов) Публичный отчет МОУ СОШ №18 г. Пензы (декабрь 2009 г.)
Публичный отчет МОУ СОШ №18 г. Пензы (декабрь 2009 г.) Презентация на тему Декартовы координаты
Презентация на тему Декартовы координаты  Кулинарные традиции семьи
Кулинарные традиции семьи Аксонометрия. Прямоугольные и косоугольные аксонометрические проекции
Аксонометрия. Прямоугольные и косоугольные аксонометрические проекции Технические средства измерения массы груза
Технические средства измерения массы груза Мой любимый продукт
Мой любимый продукт Гамма-стерилизация
Гамма-стерилизация Химическое оружие. Виды
Химическое оружие. Виды ОРГАНИЗАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ В ПОЛЬШЕ
ОРГАНИЗАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ В ПОЛЬШЕ Служба в органах уголовно-исполнительной системы как вид государственной службы
Служба в органах уголовно-исполнительной системы как вид государственной службы Путевая бюрократия или все о вагонной документации
Путевая бюрократия или все о вагонной документации Ecological problems
Ecological problems Продам 2 комнатную квартиру по приятной цене
Продам 2 комнатную квартиру по приятной цене Возрастная психология
Возрастная психология Правила vs Нормы
Правила vs Нормы Психолог-юзабилист О новой профессии в мире высоких технологий (для студентов-психологов)
Психолог-юзабилист О новой профессии в мире высоких технологий (для студентов-психологов) Управления рисками в банке
Управления рисками в банке Презентация на тему Мировые религии
Презентация на тему Мировые религии Ядерная сделка с Ираном
Ядерная сделка с Ираном Lean Startup «Бережливый стартап» Как делать игры, нужные людям
Lean Startup «Бережливый стартап» Как делать игры, нужные людям Презентация на тему Первые летательные аппараты
Презентация на тему Первые летательные аппараты Документирование среды программирования для операционной системы L4Ka(Documenting the programmer environment for L4ka)
Документирование среды программирования для операционной системы L4Ka(Documenting the programmer environment for L4ka) Правописание частицы НЕ с глаголами
Правописание частицы НЕ с глаголами Пьеса для театра А.Н.Островского "Снегурочка"
Пьеса для театра А.Н.Островского "Снегурочка"