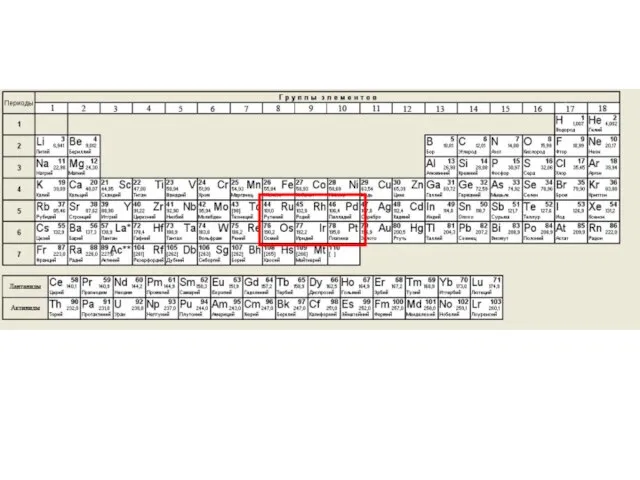
Содержание
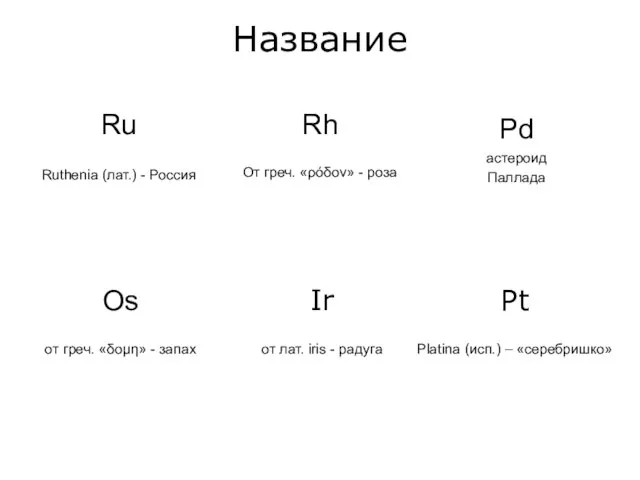
- 3. Название Ru Ruthenia (лат.) - Россия Rh От греч. «ρóδoν» - роза Os от греч. «δoμη»
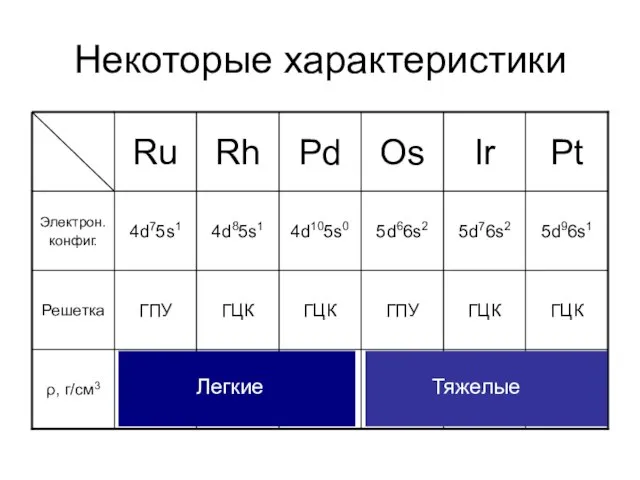
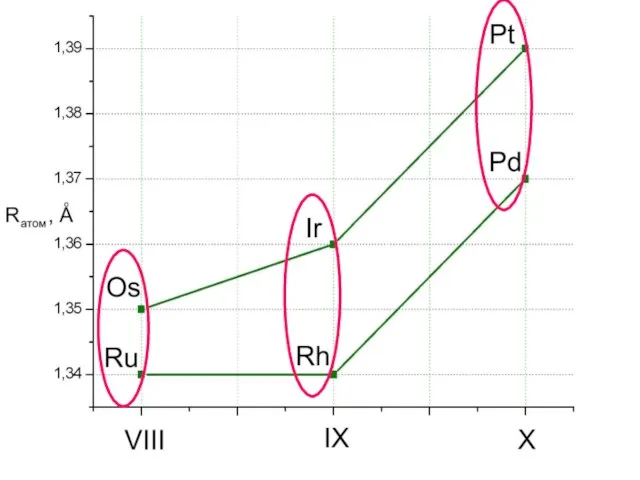
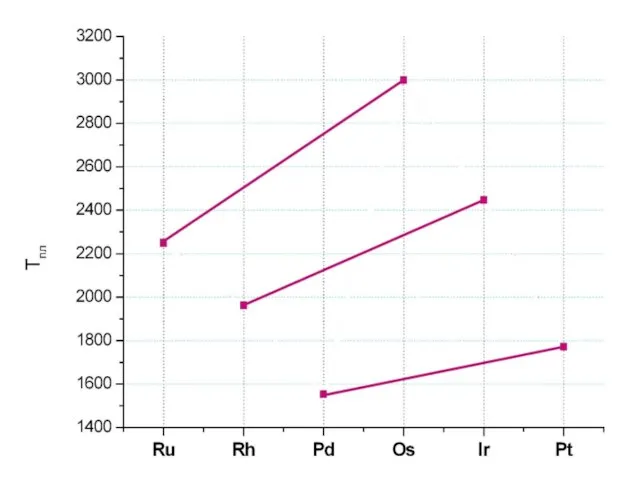
- 4. Некоторые характеристики Легкие Тяжелые
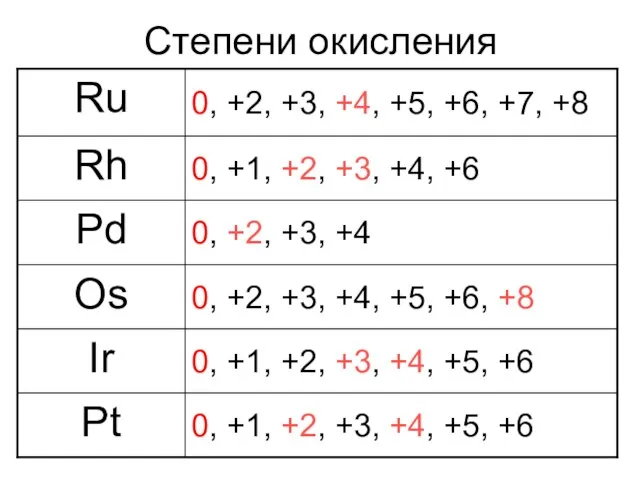
- 5. Степени окисления
- 8. Распространенность в земной коре, в %
- 9. Основные минералы Поликсен (Pt, Fe): Pt 80 — 88% Ферроплатина: Pt 84 — 81% Палладистая платина:
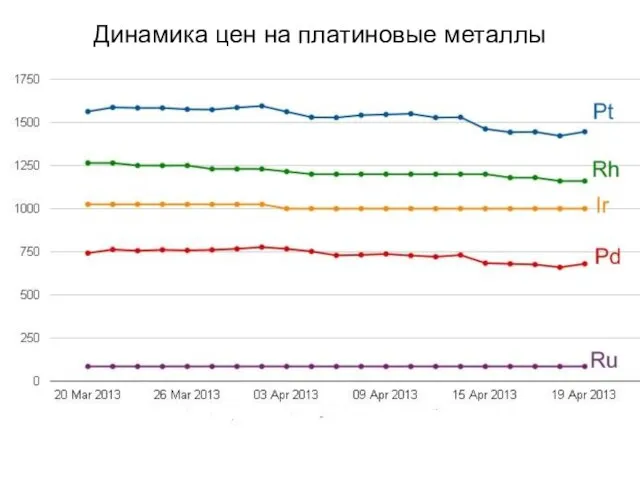
- 10. Динамика цен на платиновые металлы
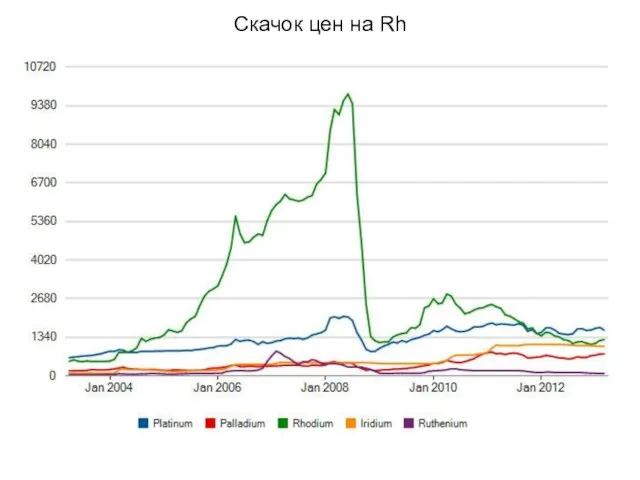
- 11. Скачок цен на Rh
- 12. Получение аффинаж Смесь + «царская водка» = H2[ЭСl6], Os,Ir не растворяются 3Pt + 4HNO3 + 18HCl
- 13. Химические свойства простых веществ Взаимодействие с кислотами-окислителями: Pd + 2H2SO4 = PdSO4 + SO2 + 2H2O
- 14. Химические свойства простых веществ Окисление, сопровождающееся комплексообразованием: 3Pt(Pd) + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO
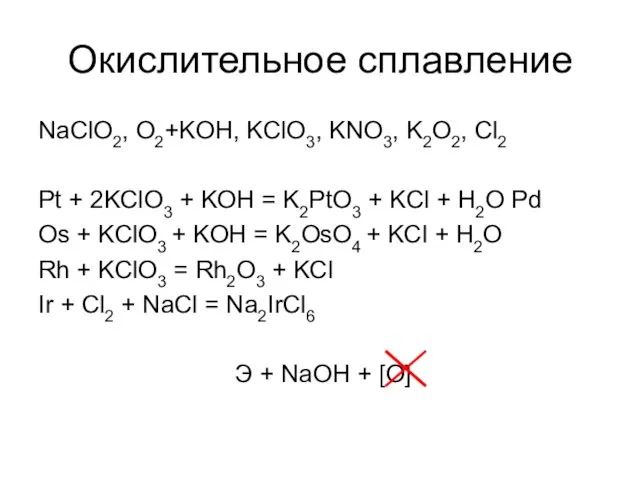
- 15. Окислительное сплавление NaClO2, O2+KOH, KClO3, KNO3, K2O2, Cl2 Pt + 2KClO3 + KOH = K2PtO3 +
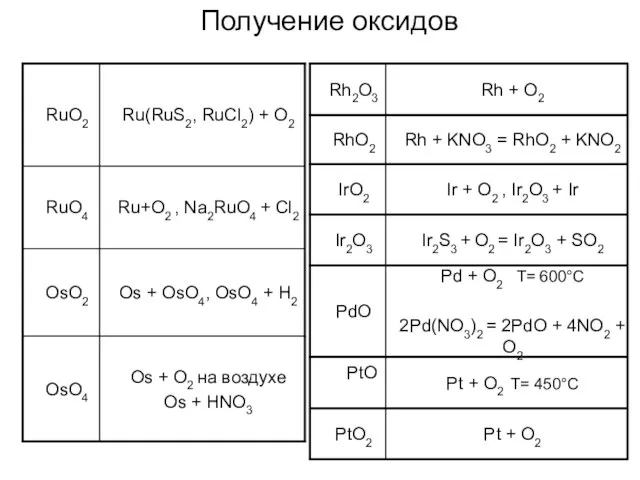
- 16. Получение оксидов
- 17. Поведение оксидов при нагревании
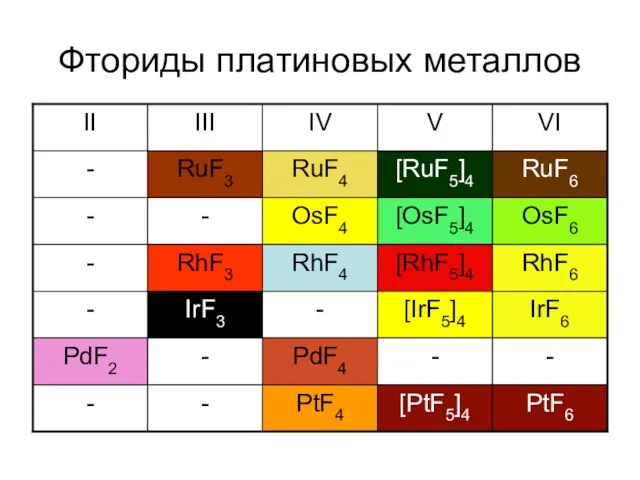
- 18. Фториды платиновых металлов
- 19. Фториды платиновых металлов Сильные окислители PtF6 самый сильный окислитель: O2 + PtF6 = O2+[PtF]6- Xe +
- 20. Ru, Os (+8) Слабые кислотные свойства: OsO4 + H2O = H2[OsO4(OH)2] K1= 10-12 OsO4+ KOH =
- 21. Ru, Os (+8) OsO4 , RuO4 OsO4 + HCl(конц.) = H2[OsCl6]+Cl2+H2O OsO4 + HCl(разб.) = RuO4
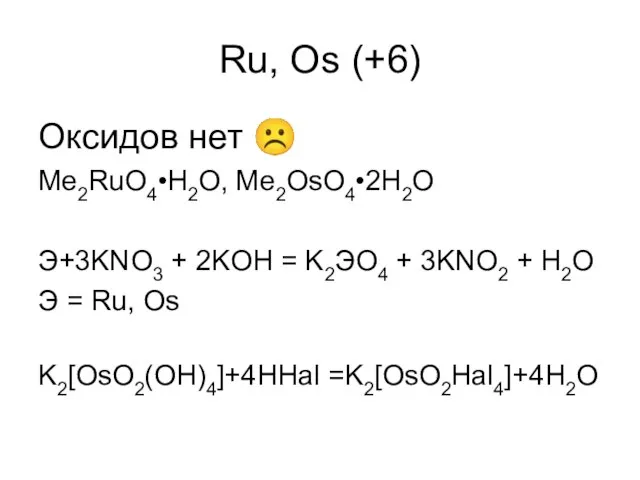
- 22. Ru, Os (+6) Оксидов нет ☹ Me2RuO4•H2O, Me2OsO4•2H2O Э+3KNO3 + 2KOH = K2ЭO4 + 3KNO2 +
- 23. Ru, Os (+6) Ru+6 окислители: 2K2RuO4+ 12HCl = 2K2[RuCl6] + Cl2 + 6H2O K2RuO4+ H2SO4 =
- 24. Ru, Os (+4) RuO2, OsO2 Кислотно-основные свойства: ЭO2 + 6HCl = H2[ЭCl6] + 2H2O ЭF4 +
- 25. Rh, Ir (+4) Получение: Ir + Na2CO3 + 2NaNO3 = Na2IrO3 + 2NaNO2 + CO2 K2IrF6
- 26. Rh, Ir (+4) IrO2 Прочная кристал. решетка низкая хим. активность RhO2 не устойчив Обменные реакции Характерны
- 27. Rh, Ir (+4) Rh+4 сильные окислители Cs2[RhCl6] = RhCl3 + CsCl + Cl2 2RhO2 + 8HCl
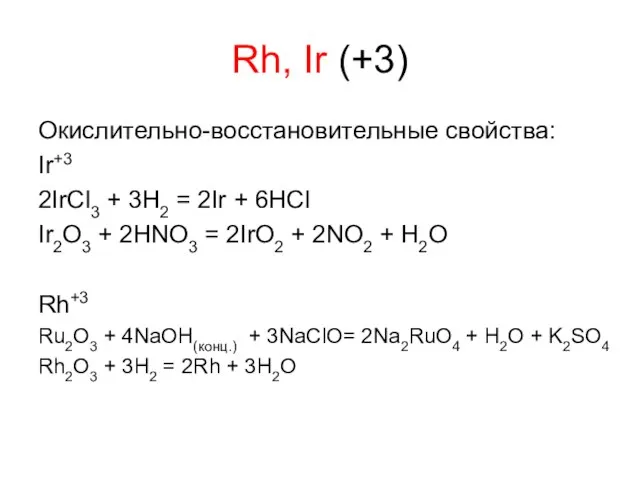
- 28. Rh, Ir (+3) Кислотно - основные свойства: Rh2O3 + 6HCl = H3[RhCl6] + 3H2O Ir2O3 +
- 29. Rh, Ir (+3) Окислительно-восстановительные свойства: Ir+3 2IrCl3 + 3H2 = 2Ir + 6HCl Ir2O3 + 2HNO3
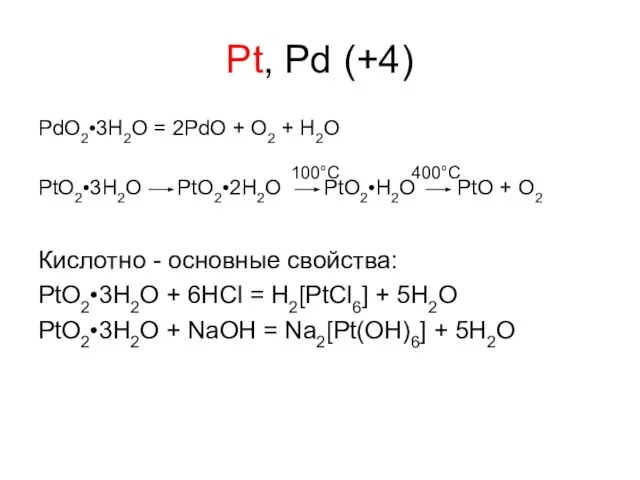
- 30. Pt, Pd (+4) PdO2•3H2O = 2PdO + O2 + H2O PtO2•3H2O PtO2•2H2O PtO2•H2O PtO + O2
- 31. H2[PtCl6] Гексахлороплатинат(IV) водорода Гексахлорплатиновая кислота Устойчивая, сильная Получение: Pt(OH)4 + HCl = H2[PtCl6] + H2O PtCl4
- 32. H2[Pt(OH)6] Гексагидроксоплатинат (IV) водорода Гексагидроксоплатиновая кислота Слабая, малорастворимая Получение: K2[Pt(OH)6] + HCl = H2[Pt(OH)6] + KCl
- 33. Pt, Pd (+4) Окислительно-восстановительные свойства Pd+4 сильный окислитель Pd(OH)4 = Pd(OH)2 + O2 + 2H2O Ткомн.
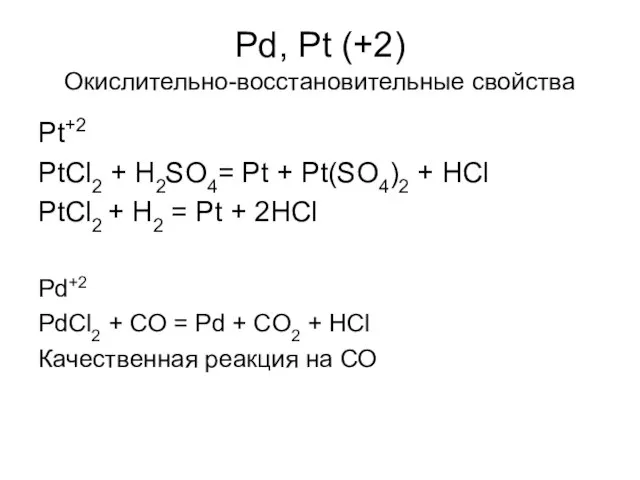
- 34. Pt, Pd (+2) Pd+2 в воде [Pd(H2O)6]2+ Pd(ClO4), PdSO4 Кислотно-основные свойства: PtO амфотерен PtO + HCl
- 35. Pd, Pt (+2) Окислительно-восстановительные свойства Pt+2 PtCl2 + H2SO4= Pt + Pt(SO4)2 + HCl PtCl2 +
- 36. Применение Pd: Kat реакций гидрирования Pt: Kat Посуда Термопары Электроды Ювелирное и зубопротезное Rh, Os Добавки
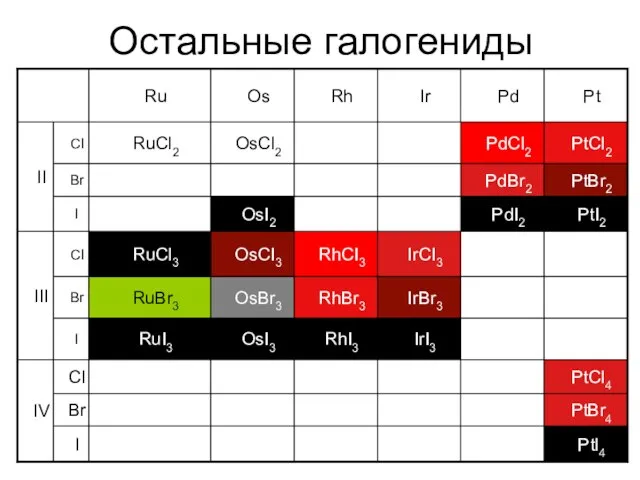
- 37. Остальные галогениды
- 38. Сульфиды, фосфиды и т.д. Ru2P – Co2P RhP3 – CoP3 RuP – FeP и CoP PdP3
- 39. Принципы разделения Os и Ru не растворяются ни в одной из кислот вплоть до Ткип, тогда
- 41. Скачать презентацию


![Получение аффинаж Смесь + «царская водка» = H2[ЭСl6], Os,Ir не растворяются 3Pt](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378163/slide-11.jpg)




![Ru, Os (+8) Слабые кислотные свойства: OsO4 + H2O = H2[OsO4(OH)2] K1=](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378163/slide-19.jpg)
![Ru, Os (+8) OsO4 , RuO4 OsO4 + HCl(конц.) = H2[OsCl6]+Cl2+H2O OsO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378163/slide-20.jpg)
![Ru, Os (+6) Ru+6 окислители: 2K2RuO4+ 12HCl = 2K2[RuCl6] + Cl2 +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378163/slide-22.jpg)
![Ru, Os (+4) RuO2, OsO2 Кислотно-основные свойства: ЭO2 + 6HCl = H2[ЭCl6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378163/slide-23.jpg)


![Rh, Ir (+4) Rh+4 сильные окислители Cs2[RhCl6] = RhCl3 + CsCl +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378163/slide-26.jpg)
![Rh, Ir (+3) Кислотно - основные свойства: Rh2O3 + 6HCl = H3[RhCl6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378163/slide-27.jpg)
![H2[PtCl6] Гексахлороплатинат(IV) водорода Гексахлорплатиновая кислота Устойчивая, сильная Получение: Pt(OH)4 + HCl =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378163/slide-30.jpg)
![H2[Pt(OH)6] Гексагидроксоплатинат (IV) водорода Гексагидроксоплатиновая кислота Слабая, малорастворимая Получение: K2[Pt(OH)6] + HCl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378163/slide-31.jpg)

![Pt, Pd (+2) Pd+2 в воде [Pd(H2O)6]2+ Pd(ClO4), PdSO4 Кислотно-основные свойства: PtO](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378163/slide-33.jpg)



 Развитие визуального восприятия. Воображение. Правила создания образа
Развитие визуального восприятия. Воображение. Правила создания образа Весенний вечер
Весенний вечер Вводные слова. Сочинение-рассуждение
Вводные слова. Сочинение-рассуждение Бесполое размножение
Бесполое размножение Pretty Little Liars
Pretty Little Liars Рак печени
Рак печени  Венгрия
Венгрия РАЗВИТИЕ ТЕХНОЛОГИЙ ПРОВЕДЕНИЯ МЕЖРЕГИОНАЛЬНЫХ СДЕЛОК
РАЗВИТИЕ ТЕХНОЛОГИЙ ПРОВЕДЕНИЯ МЕЖРЕГИОНАЛЬНЫХ СДЕЛОК Устный счёт на уроке математики в 1 классе
Устный счёт на уроке математики в 1 классе Разделка рыбы и приготовление полуфабрикатов из рыбы
Разделка рыбы и приготовление полуфабрикатов из рыбы СOВМЕСТНЫЙ АНАЛИЗ ПАЛЕОХРОНОЛОГИЙ ПРИБАЙКАЛЬЯ
СOВМЕСТНЫЙ АНАЛИЗ ПАЛЕОХРОНОЛОГИЙ ПРИБАЙКАЛЬЯ Что это за листья (1 класс)
Что это за листья (1 класс) Гербы и эмблемы. 5 класс
Гербы и эмблемы. 5 класс Развитие личности обучающихся учреждения дополнительного образования детей и молодежи средствами социокультурной деятельности
Развитие личности обучающихся учреждения дополнительного образования детей и молодежи средствами социокультурной деятельности Устав НЭПК «Союз «Атамекен» в новой редакции Астана 2012 г.
Устав НЭПК «Союз «Атамекен» в новой редакции Астана 2012 г. Презентация на тему Астероиды и кометы
Презентация на тему Астероиды и кометы Интересный тест. Тест Локус контроля
Интересный тест. Тест Локус контроля Презентация на тему Живопись России 18 века
Презентация на тему Живопись России 18 века Отчёт по производственной практикеДля получения рабочей профессиипрофессия 30.20 «Автомеханик»07.06 – 27.06.12 года
Отчёт по производственной практикеДля получения рабочей профессиипрофессия 30.20 «Автомеханик»07.06 – 27.06.12 года Падежные окончания
Падежные окончания Как снять уникальный видеоролик. Советы по подготовке к съёмке
Как снять уникальный видеоролик. Советы по подготовке к съёмке Урок «Заботы и любви»
Урок «Заботы и любви» Advert
Advert Презентация на тему Звуковые волны в различных средах
Презентация на тему Звуковые волны в различных средах Новогодний бал-маскарад«В ночь перед рождеством!»
Новогодний бал-маскарад«В ночь перед рождеством!» Положение о наставничестве АО ОДК-СТАР
Положение о наставничестве АО ОДК-СТАР Персональное решение. Профессиональный аутсорсинг персонала в г. Сыктывкаре
Персональное решение. Профессиональный аутсорсинг персонала в г. Сыктывкаре Seasons of the year
Seasons of the year