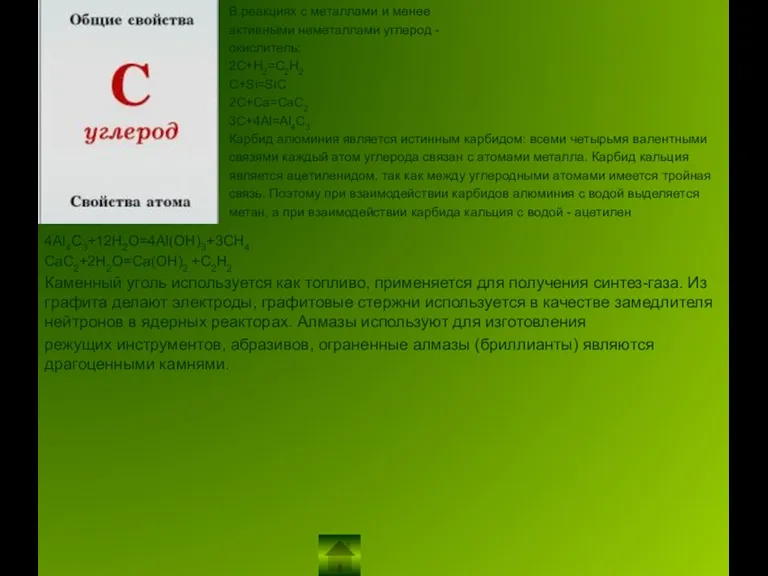
является истинным карбидом: всеми четырьмя валентными
связями каждый атом углерода связан с атомами металла. Карбид кальция
является ацетиленидом, так как между углеродными атомами имеется тройная
связь. Поэтому при взаимодействии карбидов алюминия с водой выделяется
метан, а при взаимодействии карбида кальция с водой - ацетилен
4Al4C3+12H2O=4Al(OH)3+3CH4
CaC2+2H2O=Ca(OH)2 +C2H2
Каменный уголь используется как топливо, применяется для получения синтез-газа. Из графита делают электроды, графитовые стержни используется в качестве замедлителя нейтронов в ядерных реакторах. Алмазы используют для изготовления
режущих инструментов, абразивов, ограненные алмазы (бриллианты) являются драгоценными камнями.
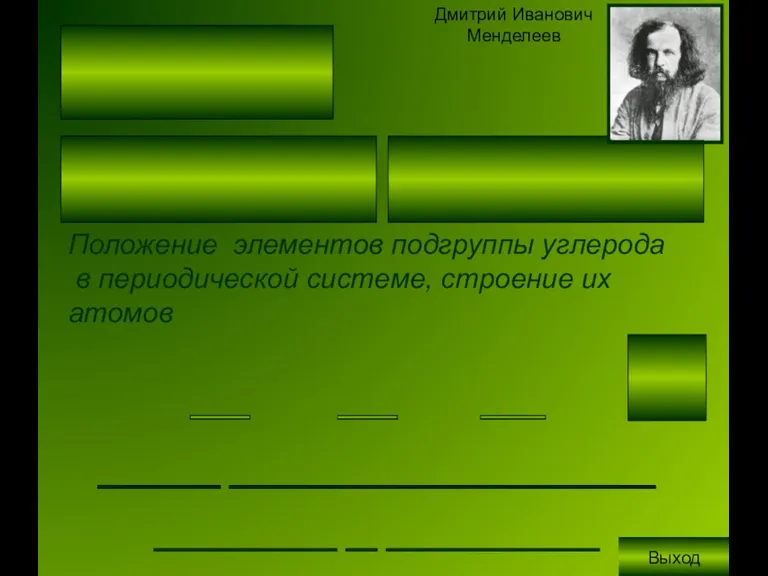








 Литературно-музыкальная композиция: «Подвиг народа бессмертен»
Литературно-музыкальная композиция: «Подвиг народа бессмертен» Презентация на тему Эпоха Просвещения XVIII век
Презентация на тему Эпоха Просвещения XVIII век  Система званий. Структура подразделений
Система званий. Структура подразделений Ким Акурвата Санджая
Ким Акурвата Санджая Первые шаги в ГТО
Первые шаги в ГТО Мужской традиционный костюм. Фронтовой фольклор. 7 класс
Мужской традиционный костюм. Фронтовой фольклор. 7 класс Презентация на тему Воздух, его состав и значение
Презентация на тему Воздух, его состав и значение  Прокариотическая клетка
Прокариотическая клетка Творческая биография Е.Е. Лансере
Творческая биография Е.Е. Лансере Педагогические чтения2007 год
Педагогические чтения2007 год Качество жизни в медицине и здравоохранении
Качество жизни в медицине и здравоохранении Культура и быт Руси XIV-XV вв
Культура и быт Руси XIV-XV вв Основные положения об образовании ФЗ Об образовании в Российской Федерации
Основные положения об образовании ФЗ Об образовании в Российской Федерации Жизнь дана на добрые дела
Жизнь дана на добрые дела Витамин В1
Витамин В1 Презентация на тему Падежные окончания имен существительных
Презентация на тему Падежные окончания имен существительных В гостях у сказки
В гостях у сказки Спортивные игры и упражнения в детском саду
Спортивные игры и упражнения в детском саду Система адаптации нового сотрудника ФГУП Почта России
Система адаптации нового сотрудника ФГУП Почта России ШМО учителей начальных классов
ШМО учителей начальных классов Роль родителей. РДШ
Роль родителей. РДШ Мотивация координатора-валидатора
Мотивация координатора-валидатора Презентация на тему Зима в неживой природе 2 класс
Презентация на тему Зима в неживой природе 2 класс Общечеловеческие ценности: истина, любовь, праведное поведение, внутренний покой, ненасилие
Общечеловеческие ценности: истина, любовь, праведное поведение, внутренний покой, ненасилие Тест на физические качества
Тест на физические качества 1презент СВЕТИ.pptновая
1презент СВЕТИ.pptновая Процесс организации летней производственной практики: программы бакалавриата и магистратуры по направлению «Менеджмент»
Процесс организации летней производственной практики: программы бакалавриата и магистратуры по направлению «Менеджмент» Внедрение электронного документооборота в грузовом коммерческом хозяйстве Укрзализныци
Внедрение электронного документооборота в грузовом коммерческом хозяйстве Укрзализныци