Слайд 2Факторы, влияющие на скорость химической реакции
Скорость химических реакций зависит от многих факторов.

Основными из них являются:
природа и концентрация реагирующих веществ,
давление (в реакциях с участием газов),
температура,
действие катализаторов,
поверхность реагирующих веществ в случае гетерогенных реакций.
Слайд 3Скорость реакции
Скорость гомогенной реакции определяется как изменение концентрации одного из

веществ в единицу времени:
υ = ∆ C / ∆ t ( моль/л с )
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности:
υ = ∆ n / ∆t S ( моль/с м2 )
Где S-площадь поверхности соприкосновения веществ ( м2 , см2 )
Слайд 4Зависимость скорости химической реакции от концентрации реагирующих веществ
Зависимость скорости химической реакции

от концентрации реагирующих веществ описывается основным законом химической кинетики – законом действующих масс.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
CN2 и CH2 – концентрации азота и водорода (моль/л)
k- коэффициент пропорциональности, называемый константой скорости реакции.
Слайд 5Правило Я.Х. Вант-Гоффа :
Правило Я.Х. Вант - Гоффа :
Повышение температуры на

каждые 10 С приводит к увеличению скорости реакции в 2-4 раза (эту величину называют температурным коэффициентом реакции).
Математически эта зависимость выражается соотношением:
υt2 = υt1 γ 10
υt2 , υt1 – скорости реакции соответственно при конечной t2 и начальной t1 температурах , γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 10 С.
Слайд 6Катализ
Катализаторами называются вещества, не расходующиеся в результате протекания реакции, но влияющие на

её скорость.
Явление изменения скорости реакции под действием таких веществ называется катализом.
Реакции, протекающие под действием катализаторов, называются каталитическими.
В зависимости от агрегатного состояния катализатора и реагирующих веществ различают катализ гомогенный и гетерогенный.
Слайд 7Итог деятельности деловой игры:
-расширены знания о скорости химической реакции и

о факторах, влияющих на неё;
-выявлены «болевые точки» в технологической линии по производству аммиака;
-предложены решения с целью предупреждения кризиса на предприятии.






 Замена щеток в двигателе
Замена щеток в двигателе Презентация на тему Тип Кольчатые черви
Презентация на тему Тип Кольчатые черви 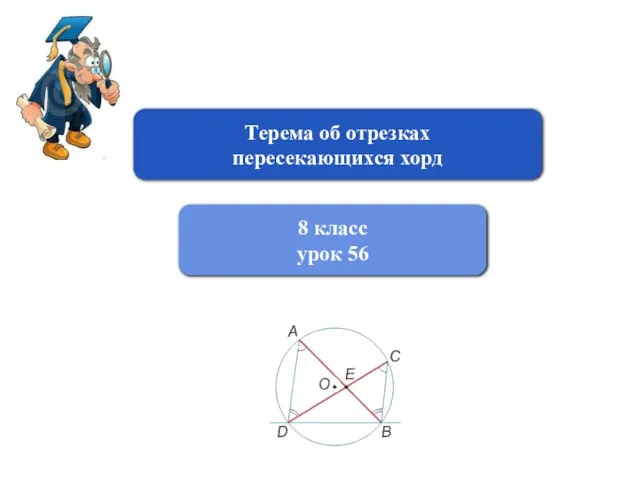 Терема об отрезках пересекающихся хорд
Терема об отрезках пересекающихся хорд Хиппи
Хиппи Нефритовый ковер. Ночь. Сон. Топчик
Нефритовый ковер. Ночь. Сон. Топчик 45 уроков жизни
45 уроков жизни Общество с ограниченной ответственностью «Страховая Компания «Согласие»
Общество с ограниченной ответственностью «Страховая Компания «Согласие» Наши спортивные достижения. Приёмная семья Фёдоровой Елены Фёдоровны
Наши спортивные достижения. Приёмная семья Фёдоровой Елены Фёдоровны Викторина по теме Государственные символы
Викторина по теме Государственные символы ИКТ- услуги в области медицины, здравоохранения и социального обеспечения
ИКТ- услуги в области медицины, здравоохранения и социального обеспечения Жизнь, творчество, личность М.А. Шолохова
Жизнь, творчество, личность М.А. Шолохова Тренинг сосковой резины Старение сосковой резины Июль 2004 Andreas Forster Дипл. Инженер sc. agr. Master of Business Marketing
Тренинг сосковой резины Старение сосковой резины Июль 2004 Andreas Forster Дипл. Инженер sc. agr. Master of Business Marketing Богоматерь Донская
Богоматерь Донская История торговой марки Торговая марка LEISTAG представляет российскому рынку широкий ассортимент высококачественных и современных
История торговой марки Торговая марка LEISTAG представляет российскому рынку широкий ассортимент высококачественных и современных  Моя майбутня професія
Моя майбутня професія Основы административного права
Основы административного права Лекция 6 (25).ЭЛЕМЕНТАРНЫЕ ЭВОЛЮЦИОННЫЕ ФАКТОРЫ и их ДЕЙСТВИЕ на ГЕНО(АЛЛЕЛО)ФОНДЫ ПРИРОДНЫХ и ЧЕЛОВЕЧЕСКИХ ПОПУЛЯЦИЙ.
Лекция 6 (25).ЭЛЕМЕНТАРНЫЕ ЭВОЛЮЦИОННЫЕ ФАКТОРЫ и их ДЕЙСТВИЕ на ГЕНО(АЛЛЕЛО)ФОНДЫ ПРИРОДНЫХ и ЧЕЛОВЕЧЕСКИХ ПОПУЛЯЦИЙ. Опыт внедрения системы управления информационной безопасностью в ESAB Россия
Опыт внедрения системы управления информационной безопасностью в ESAB Россия Исследование мышления
Исследование мышления “ Медицинская и биологическая физика ”
“ Медицинская и биологическая физика ” Готовимся к ЕГЭ по химии
Готовимся к ЕГЭ по химии Владимир Мономах 3 класс
Владимир Мономах 3 класс Дыхание. Заболевания органов дыхания и их предупреждения
Дыхание. Заболевания органов дыхания и их предупреждения Это гордое имя - Россия
Это гордое имя - Россия Английский Five o'clock
Английский Five o'clock Świeta Matka Teresa
Świeta Matka Teresa No excuses
No excuses Идеалы любви и верности в странах Германии и России
Идеалы любви и верности в странах Германии и России