Содержание
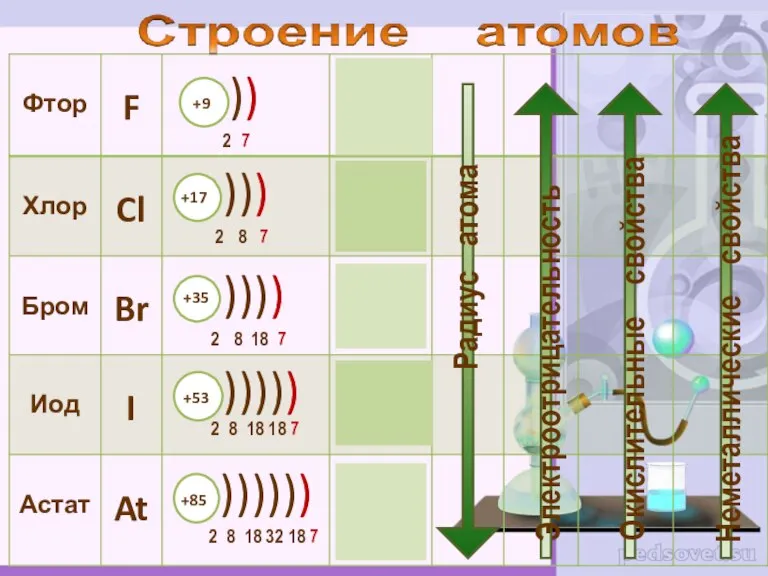
- 2. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
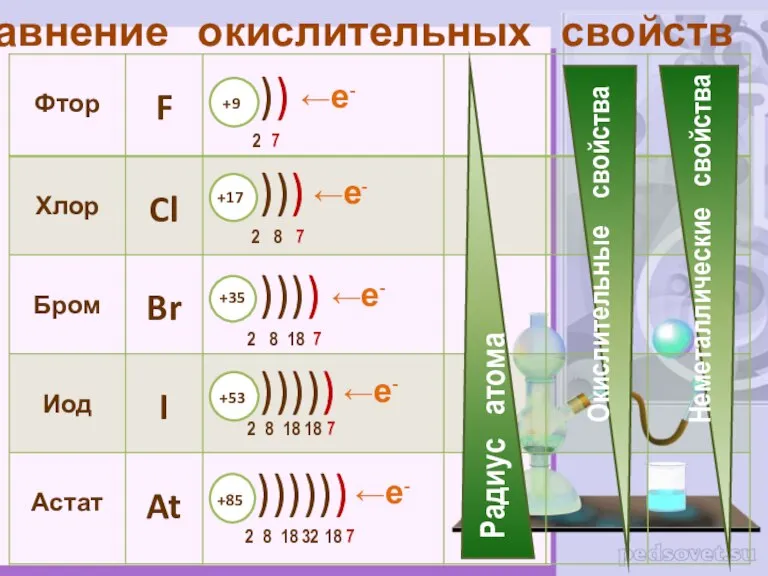
- 4. Сравнение окислительных свойств ←е- ←е- ←е- ←е- ←е-
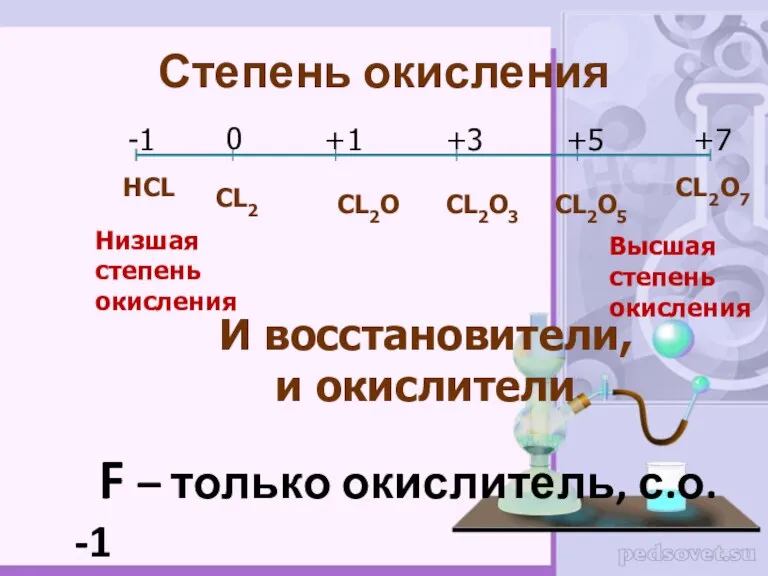
- 5. Степень окисления НCL CL2O7 F – только окислитель, с.о. -1 -1 0 +1 +3 +5 +7
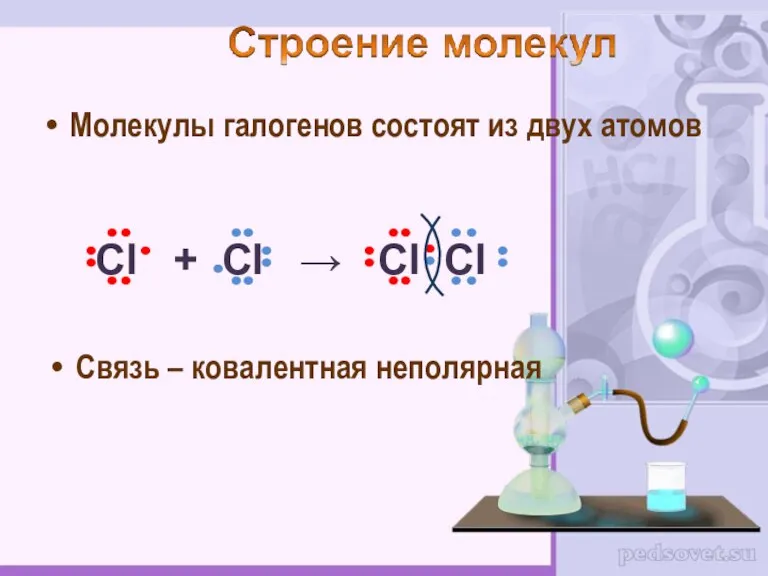
- 6. Молекулы галогенов состоят из двух атомов Связь – ковалентная неполярная
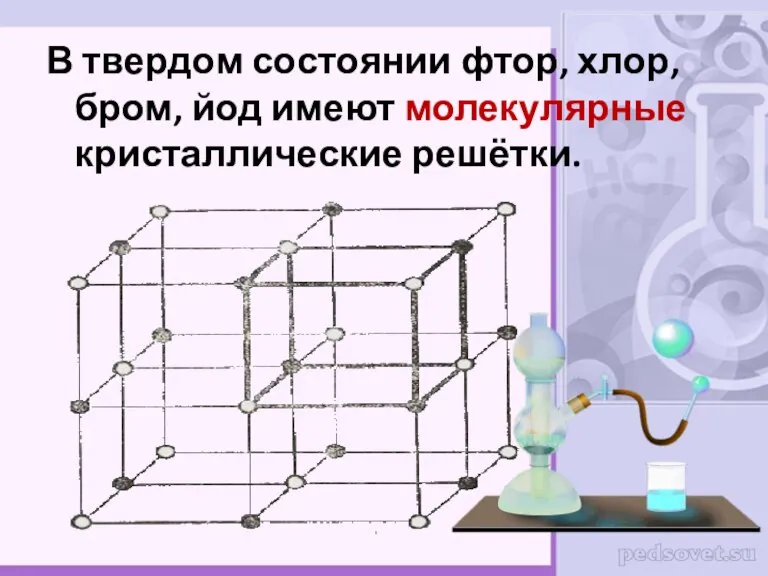
- 7. В твердом состоянии фтор, хлор, бром, йод имеют молекулярные кристаллические решётки.
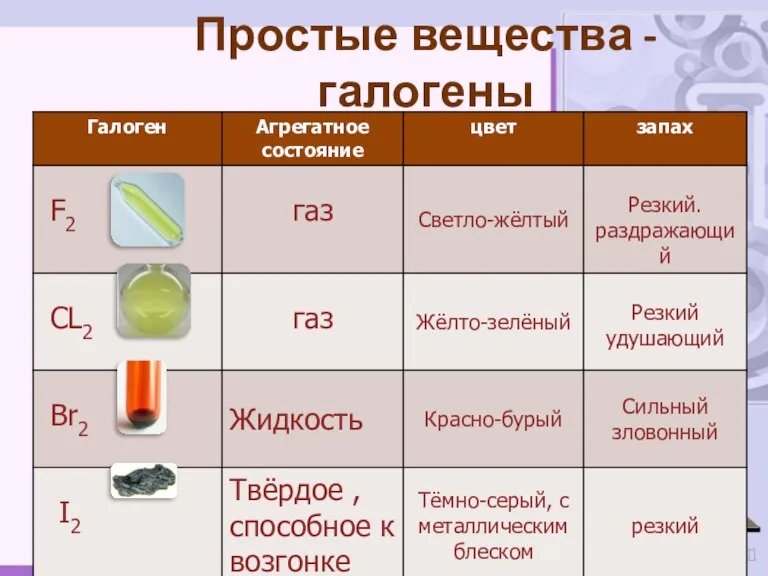
- 8. Простые вещества - галогены
- 9. 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии
- 10. H2 + F2 = 2HF (со взрывом) H2 + Cl2 = 2HCl (на свету) H2 +
- 11. 3. Взаимодействие с водой с образованием смеси кислот 4. Взаимодействие с солями других галогенов более активные
- 12. Историческая справка Слово «галогены» (“halogen”) ввел шведский химик Й.Я.Берцелиус галогены (греч. hals – соль, gen –
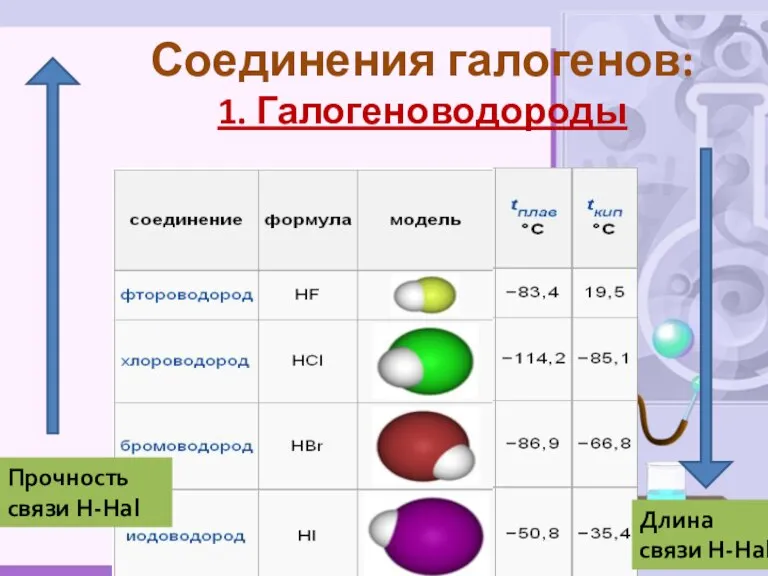
- 13. Соединения галогенов: 1. Галогеноводороды Длина связи Н-Hal Прочность связи Н-Hal
- 14. Бесцветные газы (HF при t С резким запахом Токсичны Хорошо растворяются в воде Дымят во влажном
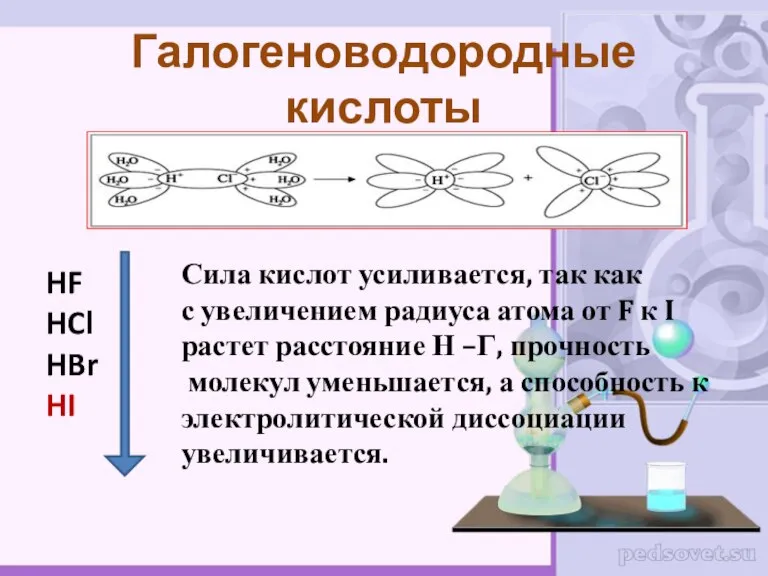
- 15. HF HCl HBr HI Галогеноводородные кислоты Сила кислот усиливается, так как с увеличением радиуса атома от
- 16. В промышленности: синтезом из водорода и хлора: H2 + Cl2 = 2HCl 2) В лаборатории: NaCl
- 17. Физические свойства: бесцветная, дымящая на воздухе жидкость, тяжелее воды Химические свойства: Типичная кислота Соляная кислота С
- 18. Используют для изготовления надписей и рисунков на стекле. SiO2 + 2HF = SiF4↑ + 2H2O Плавиковая
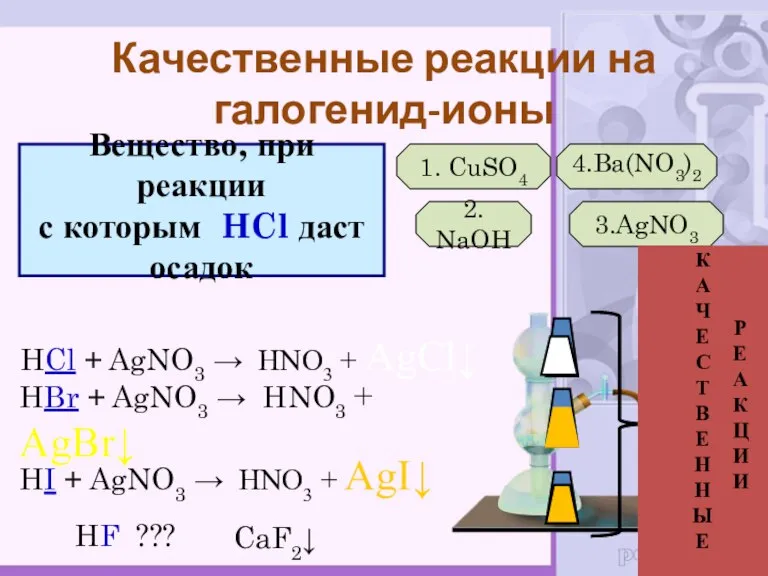
- 19. Вещество, при реакции с которым HCl даст осадок 1. CuSO4 2. NaOH 3.AgNO3 4.Ba(NO3)2 HCl +
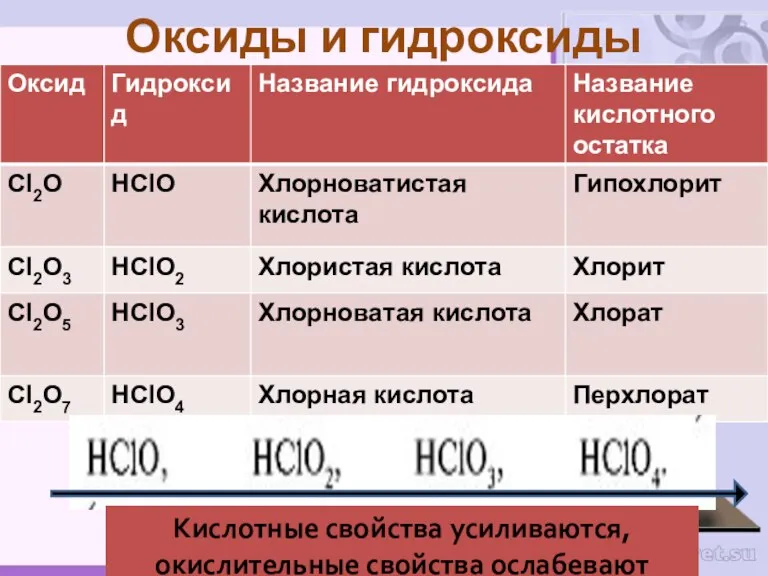
- 20. Оксиды и гидроксиды Кислотные свойства усиливаются, окислительные свойства ослабевают
- 21. Распространенность в природе галит NaCl сильвин KCl сильвинит KCl•NaCl Плавиковый шпат - флюорит CaF2
- 22. Получение галогенов: F2 и Cl2 в промышленности получают электролизом расплавов или растворов их солей: 2NaCl 2Na
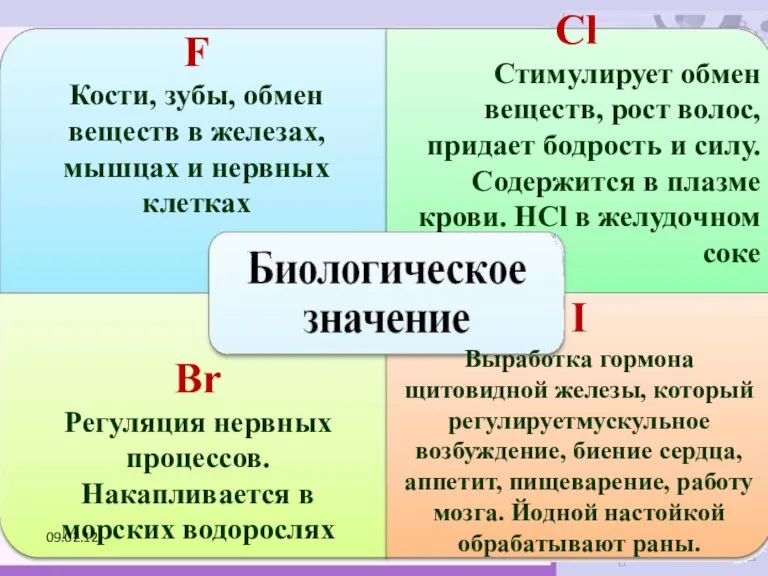
- 23. F Кости, зубы, обмен веществ в железах, мышцах и нервных клетках Сl Стимулирует обмен веществ, рост
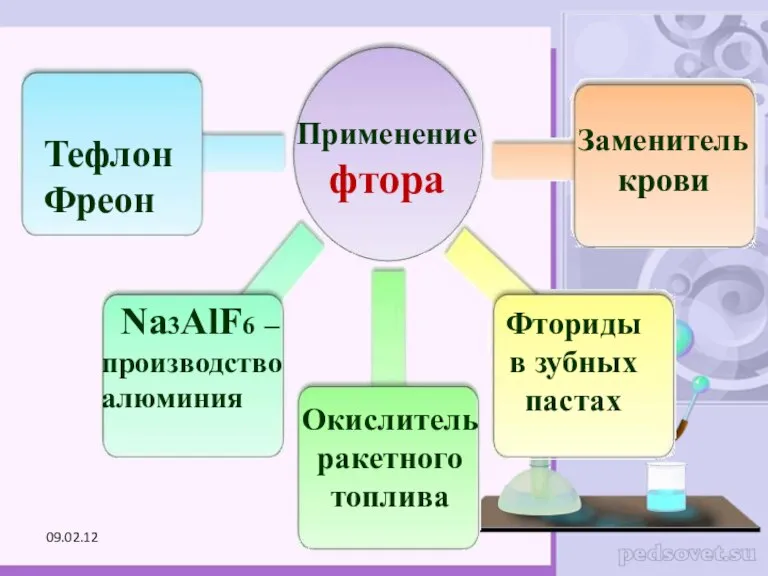
- 24. Применение фтора Тефлон Фреон Na3AlF6 – производство алюминия Окислитель ракетного топлива Заменитель крови Фториды в зубных
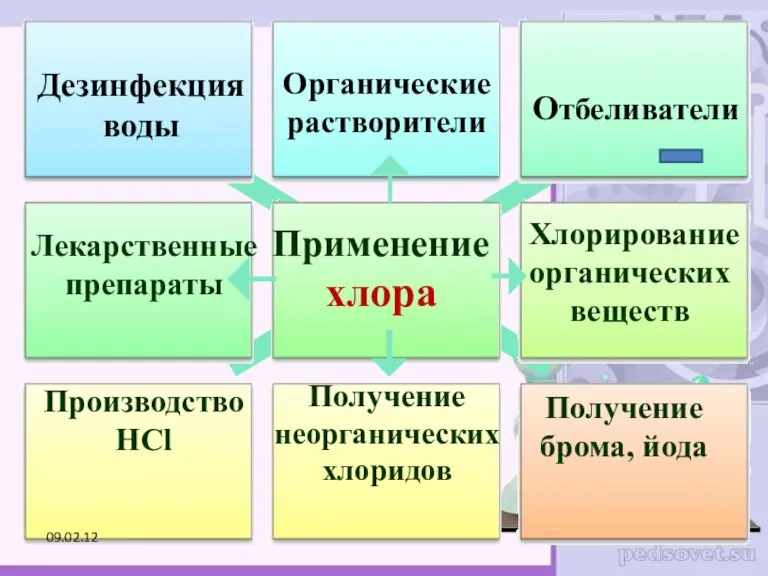
- 25. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
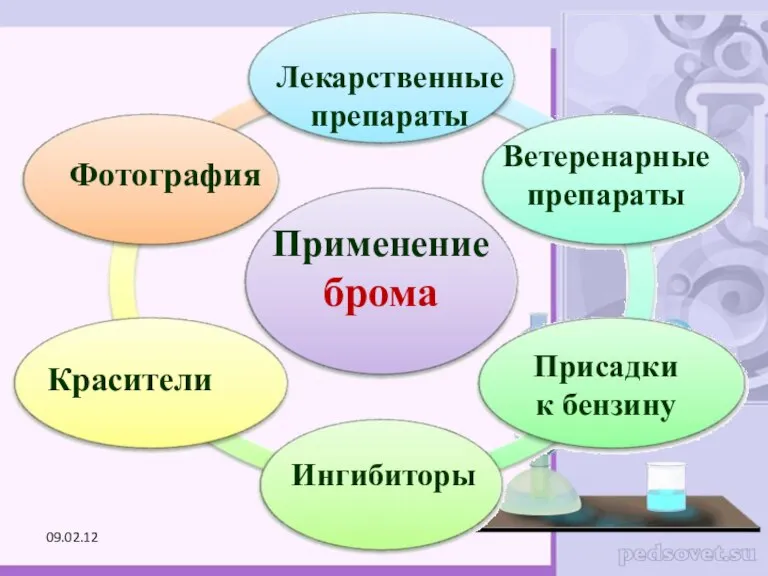
- 26. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину 09.02.12
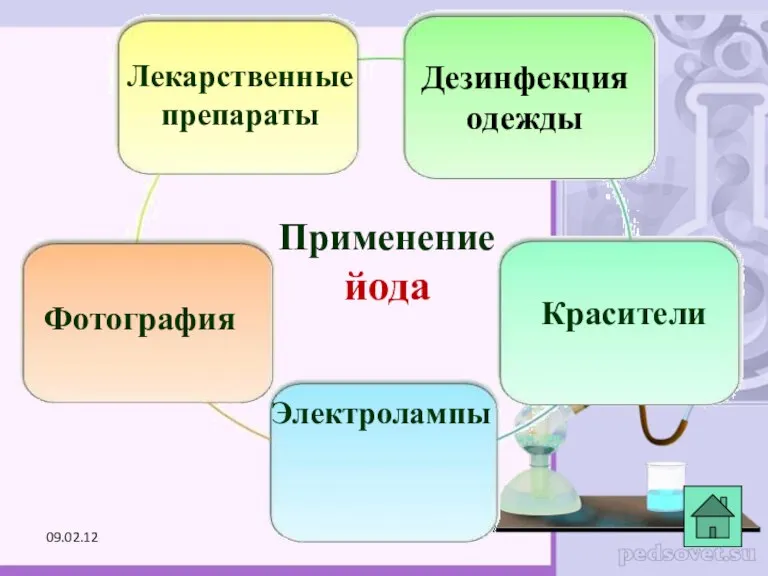
- 27. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы 09.02.12
- 28. Домашнее задание: П.19, №3-4 П.20, №1-3
- 30. Скачать презентацию












 Салон Dominum
Салон Dominum Презентация урока «Великая Отечественная…»
Презентация урока «Великая Отечественная…» Мир права. Медиаигра
Мир права. Медиаигра Поправки к конвенции СОЛАС и Кодекс ОСПС
Поправки к конвенции СОЛАС и Кодекс ОСПС РАБОЧАЯ ПРОГРАММАКОМПЛЕКСНОГО УЧЕБНОГО КУРСА 4 КЛАССА «ОСНОВЫ РЕЛИГИОЗНЫХ КУЛЬТУР И СВЕТСКОЙ ЭТИКИ»(НАЧАЛЬНОЕ ОБЩЕЕ ОБРАЗОВАНИ
РАБОЧАЯ ПРОГРАММАКОМПЛЕКСНОГО УЧЕБНОГО КУРСА 4 КЛАССА «ОСНОВЫ РЕЛИГИОЗНЫХ КУЛЬТУР И СВЕТСКОЙ ЭТИКИ»(НАЧАЛЬНОЕ ОБЩЕЕ ОБРАЗОВАНИ 90 дней учёта финансов
90 дней учёта финансов Передача Информации
Передача Информации The C language
The C language  Direct indirect speech
Direct indirect speech Рейтинги устойчивого развития регионов Российской Федерации
Рейтинги устойчивого развития регионов Российской Федерации The Krasnodar City
The Krasnodar City «Они приближали Победу» Исследовательская (творческая) работа
«Они приближали Победу» Исследовательская (творческая) работа Греко – персидские войны 500 – 449 гг. до н. э.
Греко – персидские войны 500 – 449 гг. до н. э. Развитие аптекарских садов как приема садово-паркового искусства
Развитие аптекарских садов как приема садово-паркового искусства Тушь для ресниц. Подводка для глаз
Тушь для ресниц. Подводка для глаз Шоколад
Шоколад Значение гипоксии в развитии резервных возможностей спортсмена
Значение гипоксии в развитии резервных возможностей спортсмена Телевидение как средство передачи информации
Телевидение как средство передачи информации Знакомство с буквой В
Знакомство с буквой В Железнодорожный транспорт России
Железнодорожный транспорт России Обзор информационных источников - одна из составляющих исследовательской работы. Виды обобщения информации
Обзор информационных источников - одна из составляющих исследовательской работы. Виды обобщения информации Л.Н.Толстой «Петя Ростов» ( фрагмент из романа-эпопеи)
Л.Н.Толстой «Петя Ростов» ( фрагмент из романа-эпопеи) Review of passing registration by Russian companies and eSDS generating in practice
Review of passing registration by Russian companies and eSDS generating in practice Тема труда в изобразительном искусстве
Тема труда в изобразительном искусстве АУЕ или новая опасная молодёжная субкультура в России
АУЕ или новая опасная молодёжная субкультура в России Образцы школьной формы
Образцы школьной формы Руководитель: Кудрина Ольга Петровна. Дневник класса.
Руководитель: Кудрина Ольга Петровна. Дневник класса. Compound Words
Compound Words