Содержание
- 2. Федеральный закон от 12 апреля 2010 г. №61-ФЗ «Об обращении лекарственных средств» Клинические исследования лекарственных препаратов
- 3. Государственная пошлина за совершение действий, связанных с клиническими исследованиями лекарственных препаратов До вступления в действие Федерального
- 4. Нормативные правовые акты в сфере регулирования клинических исследований лекарственных препаратов (I) Приказ МЗСР от 31.08.2010 №774
- 5. Нормативные правовые акты в сфере регулирования клинических исследований лекарственных препаратов (II) Приказ МЗСР от 26.08.2011 №752н
- 8. Страхование жизни, здоровья пациента, участвующего в клинических исследованиях (I) ICH GCP, п.5.8.2 : «Стандарты и процедуры
- 9. Страхование жизни, здоровья пациента, участвующего в клинических исследованиях (II) Федеральный закон от 12 апреля 2010 г.
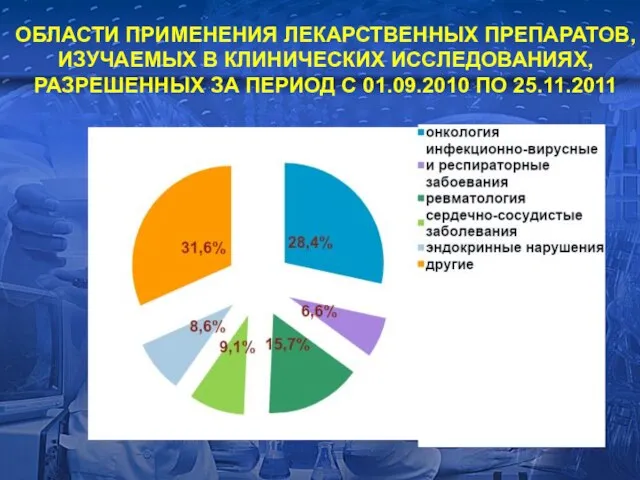
- 14. ОБЛАСТИ ПРИМЕНЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИЗУЧАЕМЫХ В КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ, РАЗРЕШЕННЫХ ЗА ПЕРИОД С 01.09.2010 ПО 25.11.2011
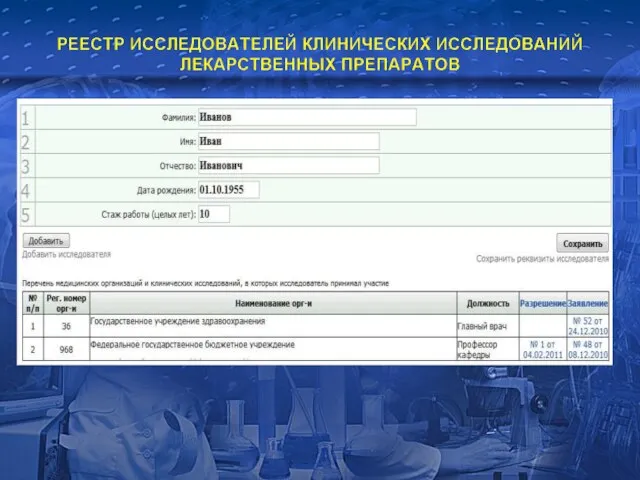
- 16. ТРЕБОВАНИЯ К ВРАЧАМ, ПРИНИМАЮЩИМ УЧАСТИЕ В КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ ЛП ОБЩИЕ ПРИНЦИПЫ ICH GCP: Ответственность за оказание
- 19. Скачать презентацию










 Итоговая контрольная работа по БД (1 семестр). Требования к содержанию
Итоговая контрольная работа по БД (1 семестр). Требования к содержанию Презентация на тему Мы вместа
Презентация на тему Мы вместа Презентация проекта
Презентация проекта Тема № 5. Интеллектуализация и поддержка принятия решений в геоинформатике. Занятие № 8. Технологии ис-кусственного интеллекта.
Тема № 5. Интеллектуализация и поддержка принятия решений в геоинформатике. Занятие № 8. Технологии ис-кусственного интеллекта. Cruise Ship
Cruise Ship Tekhnologia_MSL_12-9_Chernova_Sofia
Tekhnologia_MSL_12-9_Chernova_Sofia London Bridges
London Bridges Что мы знаем о насекомых?
Что мы знаем о насекомых? Прямоугольный треугольник
Прямоугольный треугольник Структура сбалансированной системы показателей
Структура сбалансированной системы показателей Музей «Русский быт: прошлое и настоящее»
Музей «Русский быт: прошлое и настоящее» Исследование слова «зима»
Исследование слова «зима» АИС Аптекарь 8.5 Интеграция программной функции
АИС Аптекарь 8.5 Интеграция программной функции Завершение сделки. Процесс оказания помощи клиенту в принятии решения
Завершение сделки. Процесс оказания помощи клиенту в принятии решения EXCITABLE TISSUES
EXCITABLE TISSUES НЕТРАДИЦІЙНІ ЛОГІКИ
НЕТРАДИЦІЙНІ ЛОГІКИ  Презентация на тему Изучение органов кровообращения человека
Презентация на тему Изучение органов кровообращения человека Les Etangs de Corot
Les Etangs de Corot 2 Автопарк ГФ
2 Автопарк ГФ Служба по контракту
Служба по контракту Селекция растений
Селекция растений file-320 (1)
file-320 (1) Supply update. Шаблон
Supply update. Шаблон Текстильные волокна. Производство ткани (5 класс)
Текстильные волокна. Производство ткани (5 класс) Попова Галина Викторовна МОУ СОШ № 31 г. Новочеркасск
Попова Галина Викторовна МОУ СОШ № 31 г. Новочеркасск Энергоресурс
Энергоресурс Китайская Народная Республика
Китайская Народная Республика Презентация на тему Путешествие в африку
Презентация на тему Путешествие в африку