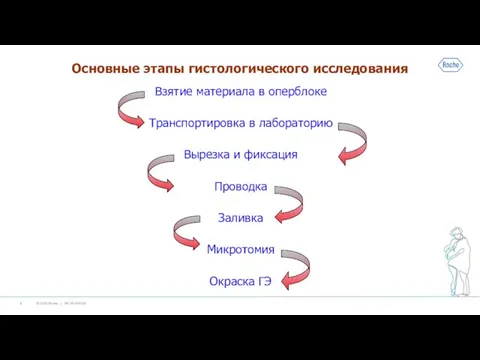
Слайд 2Основные этапы гистологического исследования
Взятие материала в оперблоке
Транспортировка в лабораторию
Вырезка и фиксация
Проводка
Заливка
Микротомия
Окраска ГЭ
Слайд 3Взятие материала в операционном блоке
Максимально быстрое погружение в фиксатор
Фиксация в 10% нейтральном

забуференном формалине
* Фиксация отдельного образца в 70% этаноле или Карнуа для молекулярного тестирования
* Сохранение в холоде и упаковка материала в вакуумные пакеты с соблюдением температурного режима.
Слайд 4Транспортировка материала в лабораторию
Максимально быстрая доставка (формалин не проникает глубже 1 см

от поверхности)
При упаковке в вакууме соблюдение температурного режима (максимум +4oС)
Четко и правильно заполненный бланк направления и маркировка контейнера с образцом
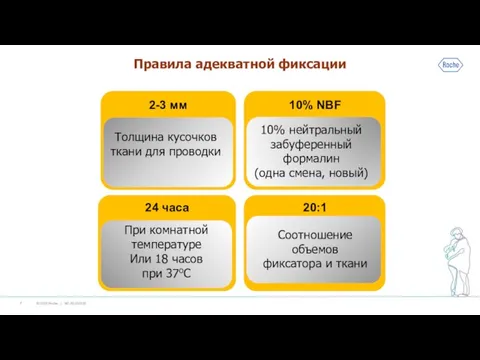
Слайд 5Вырезка и фиксация
Выполняется только патологом
Отсчет времени фиксации начинается с момента вырезки
Кассету не

заполнять более 75% объема
До 2 мм в диаметре – мелкие образцы
До 2.5 х 2.5 х 0.3 см – обычные образцы – лимитируются объемом кассеты (не более 75% объема)
Слайд 6Разделение потоков
Эндоскопические и любые мелкие биоптаты до 2 мм – короткое расписание
Мелкие

биоптаты должны быть информативными
Хирургические образцы до 3 мм – длинное расписание
Любые трудные образцы должны проводиться по обычному расписанию с отличным результатом
Слайд 8Уровни пропитывания и связывания формалина
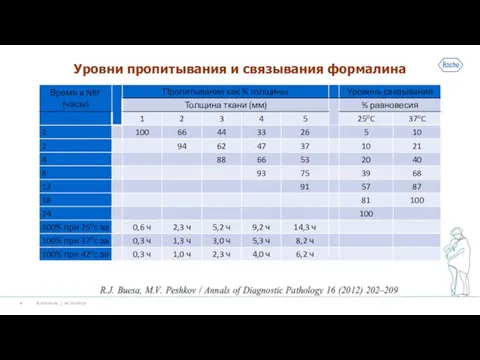
Слайд 9Фиксация кусочка ткани толщиной 3 мм

Слайд 10Почему важна фиксация?
Формалин образует очень прочные перекрестные связи между молекулами белков
Эти связи

помогают сохранить ткани в постоянных переходах от неполярных к полярным жидкостям и наоборот
Перекрестные связи разрываются при высокотемпературной демаскировке и антигены становятся доступными для ИГХ
Слайд 12Проводка ткани
Лучше щадящие и мягкие реактивы, дающие срезы толщиной 3-4 мкм без

складок и затруднений
Не передерживать ткани в реагентах
Не перегревать ткани во время проводки
Отсрочку проводки делать в первом спирте
Малые образцы проводить по короткому расписанию
Неверно проведенные и исправленные образцы могут дать ложноположительные или ложноотрицательные результаты
Не использовать для декальцинации кислотные декальцинаторы и электролиз, ультразвук, термостаты; не передерживать в растворах.
Слайд 13Заливка
Образцы заливаются в твердый парафин – он позволяет сделать более тонкие срезы
Нагрев

заливочного парафина в термостате или заливочном центре должен быть выше точки плавления парафина на 4-5оС
Залитый образец должен представлять единое целое с парафином, а не отделяться от него
Правила для ориентировки образцов – общие. Конкретные указания может дать патолог, вырезавший материал.
Слайд 14Контрольные образцы
Желательно использовать внутренние положительные контрольные структуры, поскольку фиксация разных объектов отличается
Контроль

можно и нужно располагать на одном и том же стекле, так как реактивы покрывают всю площадь стекла, кроме лейбла
Слайд 15Микротомия
Микротомия по общим правилам приготовления препаратов
Вода – чистая дистиллированная или деионизированная, с

добавкой ПАВ (tween20)
Срезы должны быть ровные, толщиной 3-4 мкм, без складок и пузырей под ними
Стекла: с поли-L-лизином, Super frost, +, подходящие для Ventana.
Сушить стекла: вертикально, термостат, 60 мин, 60оС.
Слайд 16Окраска ГЭ
Обязательная обзорная окраска перед ИГХ исследованием.
Отдельное стекло ГЭ должно быть сделано,

если ИГХ-архив хранится отдельно от основных случаев.
Слайд 17Кто ответственный за выполнение этапа?
Взятие – хирург
Подготовка к транспортировке – м/с оперблока
Транспортировка

– санитарка оперблока/курьер
Прием материала – лаборант/медрегистратор
Вырезка – вырезающий патолог
Проводка, микротомия, окраска – лаборант/медицинский лаб техник, отвечающий за работу с ИГХ-тестами и аппаратурой
Архивирование – лаборант/медрегистратор
Ответ – патолог/зав отделением
Слайд 18Пример СОП для подготовки к ИГХ
ЧЕК-ЛИСТ КОМПЕТЕНЦИЙ.
ГЛАВНАЯ ЗАДАЧА: ИММУНОГИСТОХИМИЧЕСКИЕ ПРОЦЕДУРЫ.
1 – Получить

запросы, распечатанные на компьютере для всех ИГХ-случаев за прошедший день
2 – извлечь из термостата высушенные стекла (сушить минимум с 7 часов прошлого вечера)
3 – Проверить, чтобы все срезы были на +стеклах
4 – При наличии некоторых «дополнительных стекол» из случаев для стекол, используемых для ИГХ, проверить наличие положительных контролей
5 – Сверить тип иммуноглобулина для каждого случая с типом имммуноглобулина, используемого в стеклах для отрицательного контроля
6 – Проверить, чтобы все требуемые стекла были срезаны
7 – Если пропущены какие-то запрошенные стекла, обратиться к старшему технику за причиной и дать заказ на их резку до 4 утра ночной смене
8 – Рассортировать стекла по случаям пока заполняются стейнеры (48 стекол/запуск)
9 – Подготовить рабочие программы, а также количества реагентов (мкл)
10- Запустить программу, распечатать все нужные лейблы
11 –Приклеить лейблы к стеклам и разместить стекла в пластиковые стойки

















 Либеральные реформы 60-70-х гг
Либеральные реформы 60-70-х гг Презентация на тему Профилактика сердечно-сосудистых заболеваний
Презентация на тему Профилактика сердечно-сосудистых заболеваний Информационное обеспечение инвестиционной деятельности Правительства Москвы
Информационное обеспечение инвестиционной деятельности Правительства Москвы Vegetables
Vegetables Оправданы ли вложения в технологическое образование? Гудзенко Дмитрий Юрьевич, к.т.н., CPP
Оправданы ли вложения в технологическое образование? Гудзенко Дмитрий Юрьевич, к.т.н., CPP 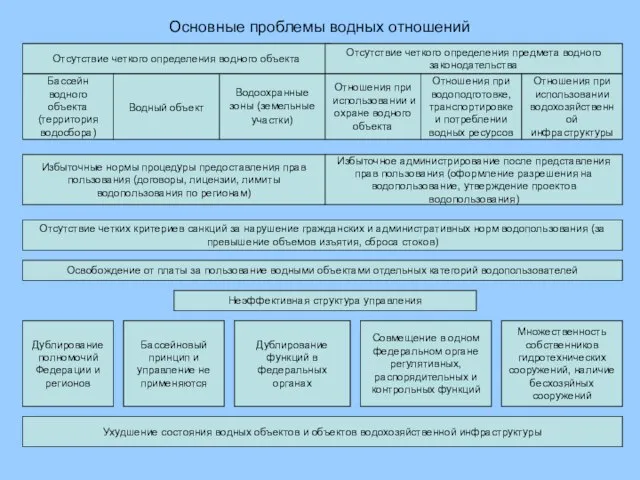 Основные проблемы водных отношений
Основные проблемы водных отношений Doctor Den®
Doctor Den® Болонский процесс и связанные с ним изменения в секторе высшего образования- К взаимному признанию и пониманию необходимости кул
Болонский процесс и связанные с ним изменения в секторе высшего образования- К взаимному признанию и пониманию необходимости кул ВАНЯ ДР-2022
ВАНЯ ДР-2022 ТЕОРИЯ КУЛЬТУРЫ
ТЕОРИЯ КУЛЬТУРЫ  "По тропинкам Теремка"
"По тропинкам Теремка" Узоры на посуде
Узоры на посуде Применение официально-делового стиля на практике. Учимся составлять персональное резюме
Применение официально-делового стиля на практике. Учимся составлять персональное резюме Ответственность за незаконную рубку новогодних елей
Ответственность за незаконную рубку новогодних елей ЛЕСТНИЦА ИАКОВА Бытие 28:10-22 БЫТИЕ 28:10-15 Иаков же вышел из Вирсавии и пошел в Харран, и пришел на [одно] место, и [остался] там ночевать,
ЛЕСТНИЦА ИАКОВА Бытие 28:10-22 БЫТИЕ 28:10-15 Иаков же вышел из Вирсавии и пошел в Харран, и пришел на [одно] место, и [остался] там ночевать,  Проектная работа «Кулинарная книга 1 – В класса».
Проектная работа «Кулинарная книга 1 – В класса». Технология производства кассетной рассады
Технология производства кассетной рассады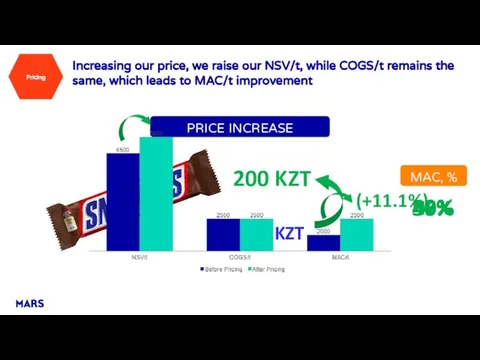 Pricing
Pricing Зомби в массовой культуре
Зомби в массовой культуре Детская мебель
Детская мебель Психологія вимушених переселенців
Психологія вимушених переселенців Сельскохозяйственный сбытовой снабженческий перерабатывающий потребительский кооператив Эко продукт
Сельскохозяйственный сбытовой снабженческий перерабатывающий потребительский кооператив Эко продукт РЕСУРСНЫЙ ПОТЕНЦИАЛ ВОЛГОГРАДСКОЙ ОБЛАСТИ
РЕСУРСНЫЙ ПОТЕНЦИАЛ ВОЛГОГРАДСКОЙ ОБЛАСТИ Черепахи
Черепахи Обработка информации текстовыми процессорами. Создание, редактирование и форматирование текстового документа
Обработка информации текстовыми процессорами. Создание, редактирование и форматирование текстового документа Технология активных продаж
Технология активных продаж Химия и проблемы окружающей среды
Химия и проблемы окружающей среды Профессия
Профессия