Содержание
- 2. Al Алюминий
- 3. Al 13 Алюминий (лат. Aluminium) 3 8 2 26,9815 3s2 3p1
- 4. Al 13 Алюминий (лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Был впервые получен датским физиком
- 5. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Порядковый номер. Химический
- 6. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Атомная масса элемента
- 7. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Электронная конфигурация элемента
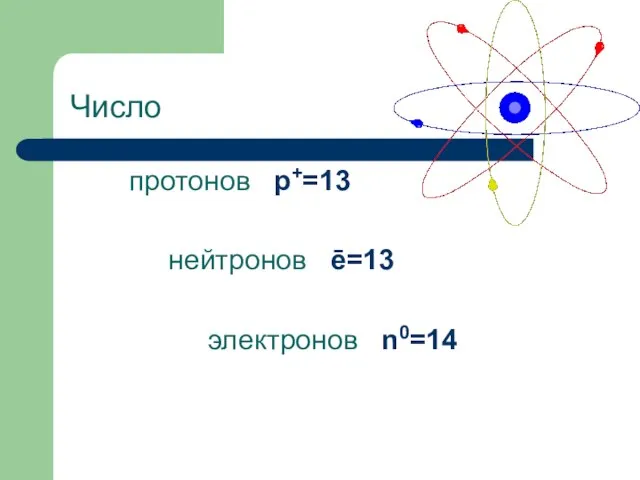
- 8. Число протонов p+=13 нейтронов ē=13 электронов n0=14
- 9. Изотопы алюминия В природе представлен лишь один стабильный изотоп 27Al. Искусственно получен ряд радиоактивных изотопов алюминия,
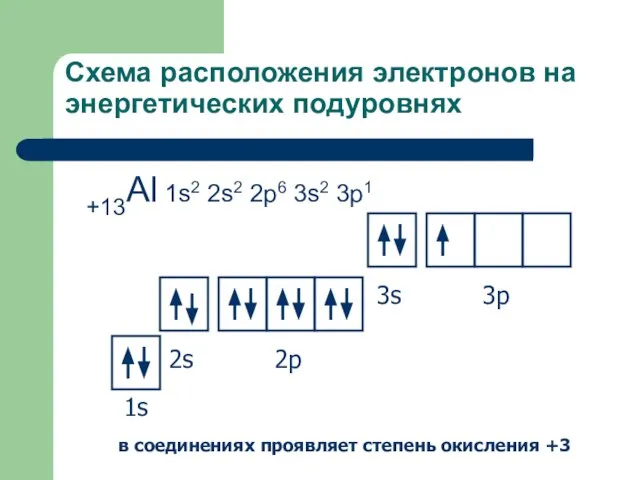
- 10. Схема расположения электронов на энергетических подуровнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s
- 11. Главные квантовые числа Главное квантовое число n=3 Орбитальное квантовое число l=1 Магнитное квантовое число ml=-1 Спиновое
- 12. Al – типичный металл Схема образования вещества Al 0- 3ē ↔ Al+3 Тип химической связи -металлическая
- 13. Физические свойства вещества Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает
- 14. Химические свойства вещества Al активный металл восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду
- 15. Алюминий реагирует: 1. 2Al+3O2 = 2Al2O3 + O – покрывается пленкой оксида, но в мелкораздроблен-ном виде
- 16. Получение вещества Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6), электролизом расплава AlCl3 (расходуется около
- 17. Применение Al
- 18. Ряд факторов применения алюминия: Алюминий – самый распространенный металл земной коры. Его ресурсы практически неисчерпаемы. Обладает
- 19. Оксид алюминия Al2О3: Очень твердый (корунд, рубин) порошок белого цвета, тугоплавкий - 20500С. Не растворяется в
- 20. Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl
- 21. Влияние соединений алюминия на загрязнение окружающей среды. Почти все загрязняющие вещества, которые первоначально попали в атмосферу,
- 23. Скачать презентацию

















 Проектирование полуботинок с настрочными берцами
Проектирование полуботинок с настрочными берцами Бюджет для граждан на 2022 год
Бюджет для граждан на 2022 год Ластоногие и Китообразные, Парнокопытные и Непарнокопытные, Хоботные
Ластоногие и Китообразные, Парнокопытные и Непарнокопытные, Хоботные РЕЗУЛЬТАТЫ РАБОТЫПОДСИСТЕМЫ «ВЕДЕНИЯ»
РЕЗУЛЬТАТЫ РАБОТЫПОДСИСТЕМЫ «ВЕДЕНИЯ» Переход к предоставлению услуги «Социальная поддержка ветеранов труда, лиц, проработавших в тылу в период Великой Отечественной в
Переход к предоставлению услуги «Социальная поддержка ветеранов труда, лиц, проработавших в тылу в период Великой Отечественной в Ивановское сельское поселение. Исполнение бюджета
Ивановское сельское поселение. Исполнение бюджета О компании Jura Elektroapparate AG
О компании Jura Elektroapparate AG The flag of the uk
The flag of the uk Желаем Вам приятного просмотра! Для смены слайдов нажимайте клавишу ПРОБЕЛ.
Желаем Вам приятного просмотра! Для смены слайдов нажимайте клавишу ПРОБЕЛ. На пути к Библиотеке 2.0: освоение перспективных интернет-технологий
На пути к Библиотеке 2.0: освоение перспективных интернет-технологий Расчёт на прочность при изгибе
Расчёт на прочность при изгибе Видеонаблюдение при проведении выборов депутатов Государственной Думы
Видеонаблюдение при проведении выборов депутатов Государственной Думы В царстве грибов
В царстве грибов Бизнес планирование предприятий
Бизнес планирование предприятий План мероприятий на каникулы
План мероприятий на каникулы Н. В. Гоголь в разделе «Что такое слово и словесность» пишет: "Говорится все, записывается немногое, и только то, что нужно. Отсюда зн
Н. В. Гоголь в разделе «Что такое слово и словесность» пишет: "Говорится все, записывается немногое, и только то, что нужно. Отсюда зн Значение природных ресурсов
Значение природных ресурсов Презентация 6-7 СРО Шевченко Д.В
Презентация 6-7 СРО Шевченко Д.В Как выполняли арифметические действия в Древнем Риме?
Как выполняли арифметические действия в Древнем Риме? Мастер-класс
Мастер-класс Презентация на тему: Проблемы подросткового возраста и его особенности
Презентация на тему: Проблемы подросткового возраста и его особенности Телекоммуникации
Телекоммуникации Сварные соединения и швы
Сварные соединения и швы Цапина Елена Михайловна Классный руководитель6 «а» класса Школа №9 г.Можга
Цапина Елена Михайловна Классный руководитель6 «а» класса Школа №9 г.Можга Презентация на тему Обучение грамоте и развитие речи
Презентация на тему Обучение грамоте и развитие речи Les meilleures montres dans le monde
Les meilleures montres dans le monde Презентация на тему Открытия Ломоносова в области физики
Презентация на тему Открытия Ломоносова в области физики  Маньяки… кто есть кто
Маньяки… кто есть кто