Содержание
- 2. ядро електрони “+” “-” Атом - найдрібніша складова речовини Атом (з грецької “неподільний”) – найдрібніша, хімічно
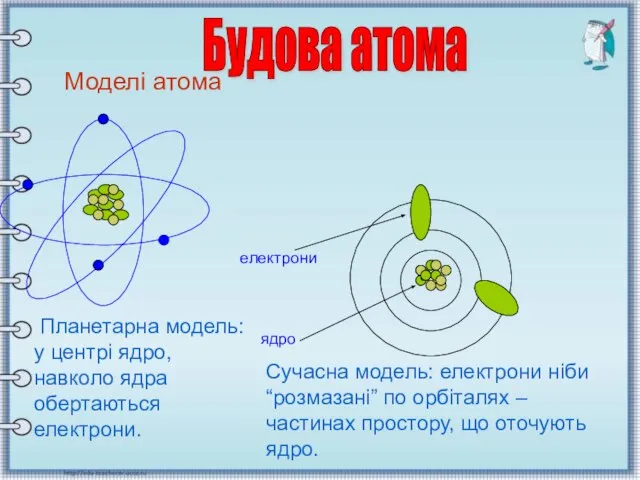
- 3. Моделі атома Моделі атома Планетарна модель: у центрі ядро, навколо ядра обертаються електрони. електрони ядро Сучасна
- 4. Будова атома Атоми надзвичайно малі, а їх ядро ще у 10-100 разів менші за сам атом.
- 5. Ім’я: Атом – найдрібніша частинка речовини. Батьки: Демокріт, Левкіпп – 2500р. тому, давньогрецькі вчені (гіпотеза про
- 6. Розміри атомів приблизно дорівнюють 0,0000000001м. Розміри атомів приблизно дорівнюють 0,0000000001м. Якби всі люди нашої планети проводили
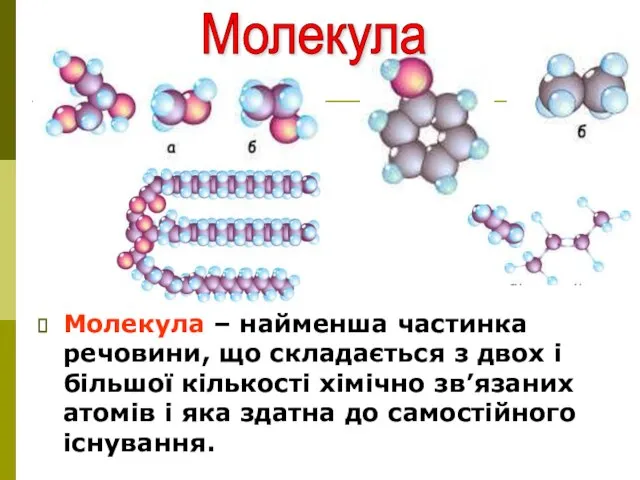
- 7. Молекула – найменша частинка речовини, що складається з двох і більшої кількості хімічно зв’язаних атомів і
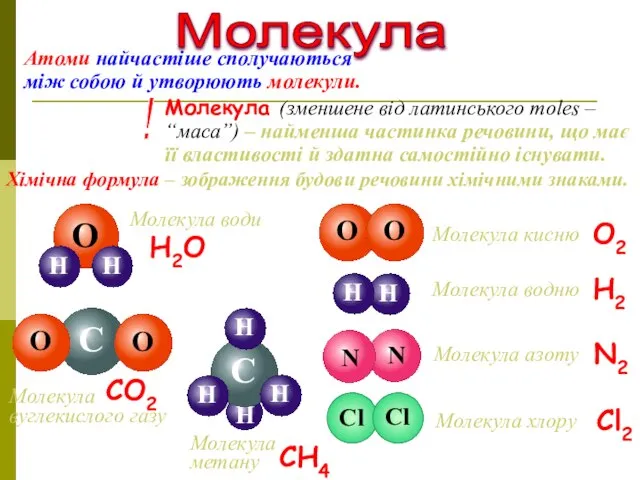
- 8. Молекула Молекула (зменшене від латинського moles – “маса”) – найменша частинка речовини, що має її властивості
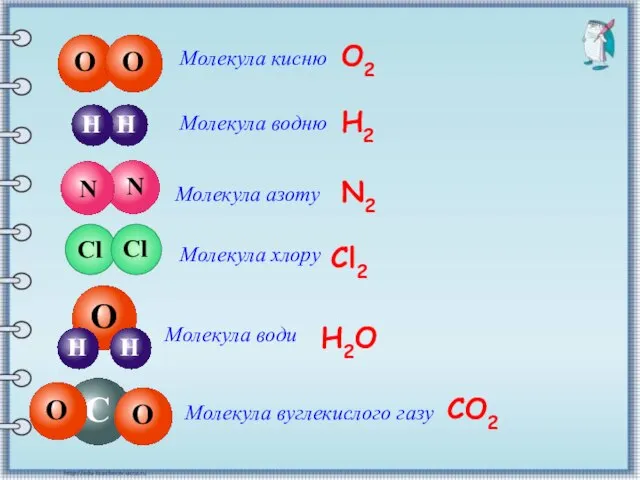
- 9. О Молекула кисню Молекула водню Молекула азоту Молекула хлору О2 Н2 N2 Cl2 Молекула води Н2O
- 10. 1. Всі тіла складаються з частинок. 2. Ці частинки перебувають у безперервному хаотичному русі. 3. Частинки
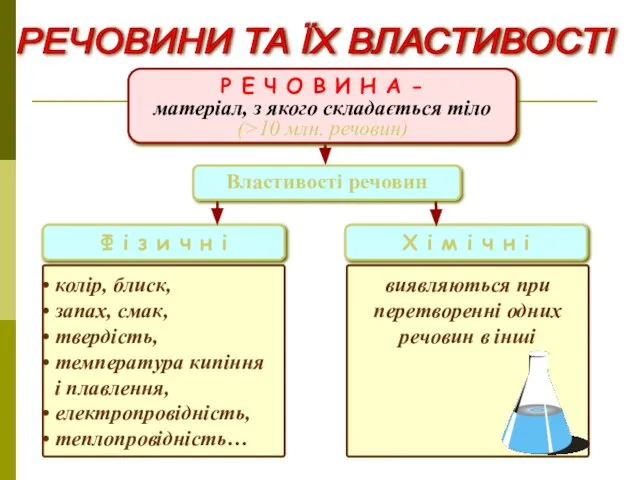
- 11. РЕЧОВИНИ ТА ЇХ ВЛАСТИВОСТІ Р Е Ч О В И Н А - матеріал, з якого
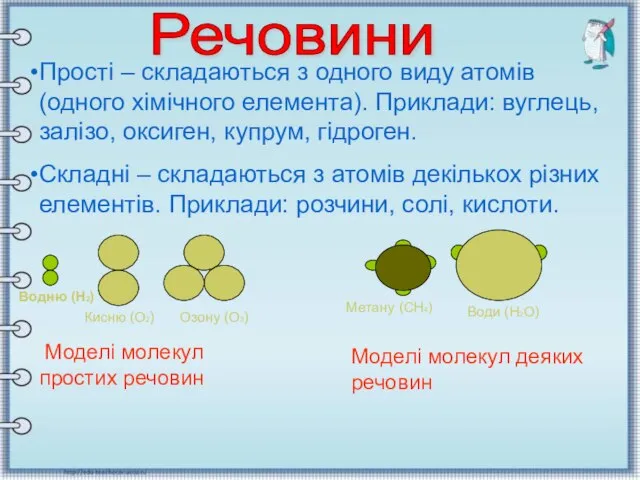
- 12. Прості – складаються з одного виду атомів (одного хімічного елемента). Приклади: вуглець, залізо, оксиген, купрум, гідроген.
- 13. Хімічні елементи Хімічний елемент (з латинської “стихія”, “первинна речовина”) – певний за будовою тип атома. Йєнс
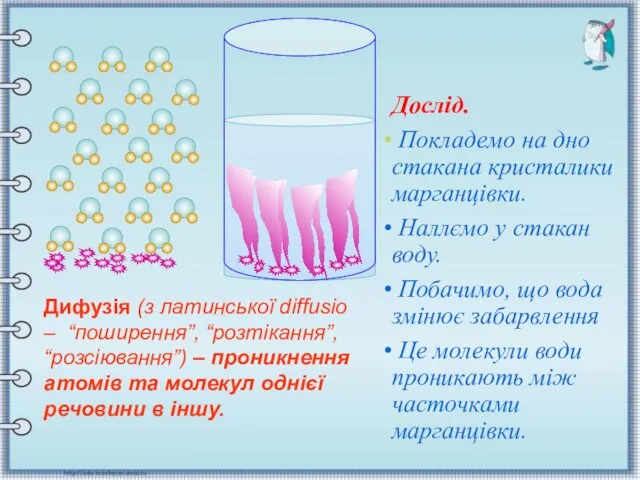
- 14. Англійський ботанік Броун (ХІХст.) Англійський ботанік Броун (ХІХст.) Дифузією називають взаємне проникнення дотичних речовин одна в
- 15. Дослід. Покладемо на дно стакана кристалики марганцівки. Наллємо у стакан воду. Побачимо, що вода змінює забарвлення
- 16. Між молекулами є проміжки. Молекули рухаються хаотично. Зі збільшенням температури збільшується швидкість молекул. Явище дифузії існує
- 17. * Усі речовини складаються з: води; повітря; з молекул і атомів. Речовина – це: те, з
- 19. Скачать презентацию









 КУЛЬТУРА МОСКВЫ 2012-2016 г.г.
КУЛЬТУРА МОСКВЫ 2012-2016 г.г. Анализ и оценка стоимости дебиторской задолженности предприятия
Анализ и оценка стоимости дебиторской задолженности предприятия Презентация на тему Расцвет древнерусского государства. Русское общество в XI веке
Презентация на тему Расцвет древнерусского государства. Русское общество в XI веке  Арабы в средние века. Возникновение ислама
Арабы в средние века. Возникновение ислама Группа «НЕПОСЕДЫ»
Группа «НЕПОСЕДЫ» Россия- наша Родина
Россия- наша Родина RS DigiTac Light
RS DigiTac Light Политика
Политика Презентация на тему Человек и информация
Презентация на тему Человек и информация Мой вклад в волонтерское движение
Мой вклад в волонтерское движение Административно-хозяйственная деятельность. Безопасность
Административно-хозяйственная деятельность. Безопасность Презентация на тему Проектная деятельность в детском саду
Презентация на тему Проектная деятельность в детском саду Психологическая готовность учащихся 4-х классов при переходе на основную ступень общего образования
Психологическая готовность учащихся 4-х классов при переходе на основную ступень общего образования Край, в котором я живу. Номинация: Моя семья в истории земли Благоварской
Край, в котором я живу. Номинация: Моя семья в истории земли Благоварской ПРИРОДА И РУКОТВОРНОЕ. ЖИВАЯ И НЕЖИВАЯ ПРИРОДА
ПРИРОДА И РУКОТВОРНОЕ. ЖИВАЯ И НЕЖИВАЯ ПРИРОДА Номинации российской премии Студент года для образовательных организаций высшего образования
Номинации российской премии Студент года для образовательных организаций высшего образования Пуфы
Пуфы 20141023_prezentatsiya12_kalinina_t.v
20141023_prezentatsiya12_kalinina_t.v Обучение удалённой работе. Очерк: понятие, разновидности, история развития жанра, примеры
Обучение удалённой работе. Очерк: понятие, разновидности, история развития жанра, примеры Экспертная оценка конспекта урока по методике В.Д. Шадрикова
Экспертная оценка конспекта урока по методике В.Д. Шадрикова Русские
Русские Дизайн календарів
Дизайн календарів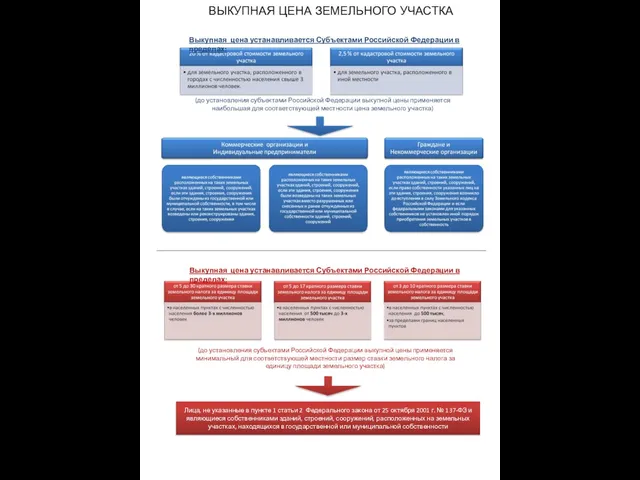 ВЫКУПНАЯ ЦЕНА ЗЕМЕЛЬНОГО УЧАСТКА
ВЫКУПНАЯ ЦЕНА ЗЕМЕЛЬНОГО УЧАСТКА Sales manager
Sales manager Классификация ЧС техногенного характера
Классификация ЧС техногенного характера Математический диктант №4
Математический диктант №4 ИТОГИ РАБОТЫ 2010-2011 учебный год
ИТОГИ РАБОТЫ 2010-2011 учебный год Шалаев Ю.Н. каф. Информатики и проектирования систем. Институт кибернетикиТеория случайных функций
Шалаев Ю.Н. каф. Информатики и проектирования систем. Институт кибернетикиТеория случайных функций