Содержание
- 2. Тема: КИСЛОРОД. ОБЩАЯ ХАРАКТЕРИСТИКА. НАХОЖДЕНИЕ В ПРИРОДЕ. ПОЛУЧЕНИЕ
- 3. I.Кислород – химический элемент 1. Химический знак 2.Положение в периодической системе 3.Относительная атомная масса 4.Валентность 4.В
- 4. I.Кислород – химический элемент Химический знак – О Положение в период. Сист.- Z=8, 2 период, IVA-Группа
- 5. Содержание кислорода в природе Распространение элементов в природе (по массе, в %) 1 - кислород -
- 6. Кремний ( IV) оксиды– SiO2
- 7. Алюминий оксиды- Al2O3
- 8. Атмосфера 21 % кислорода (1\5 часть).
- 9. Чистая вода – 88,8 %, Лед – 85,8 %
- 10. Кислород – в организме Белки, жиры, углеводы, гормоны, ферменты
- 11. II.Кислород –простое вещество 1.Химическая формула - О2 2.Молекулярная и молярная массы Mr(О2)=32; М =32 г/моль. 3.Получение
- 12. Карл Шееле, Швеция 1772 год: «Атмосферный воздух состоит из двух частей: «огненный воздух» - поддерживает дыхание
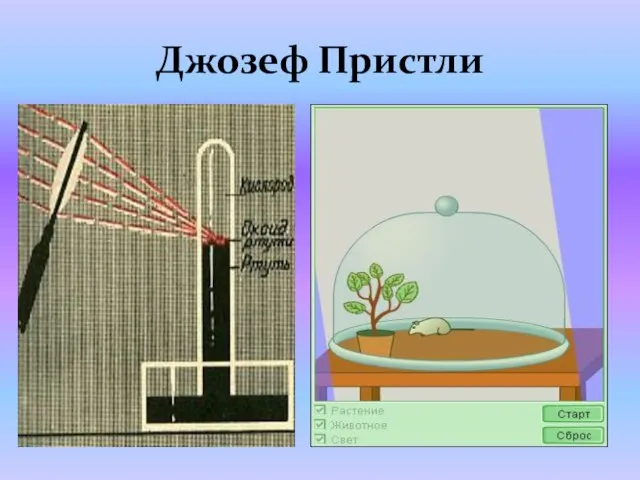
- 13. Джозеф Пристли, Англия, 1774 год Терекөмеш оксидын таркатып кислород таба 2HgO = 2Hg + O2
- 14. Джозеф Пристли
- 15. Антуан Лоран Лавуазье, Франция, 1777 год Подлинная природа этого газа была установлена во Франции. Название Oxygenium
- 16. Сказка 2 KMnO4 = K2MnO4 + MnO2 + O2 ↑ КМnO4 – перманганат калия ; 1-
- 17. Физические войства: Газ Без цвета, запаха, вкуса Малорастворим в воде Һавадан бераз авыр 32> 29 тяж.возд.
- 18. Химические свойства Реакции горения неметаллов С+ O2 = С O2 S + O2 = S O2
- 19. Химические свойства Реакции горения сложных веществ СН4+ 2O2 = СO2 + 2H2O СS2 + 3O2 =
- 21. Повторим 1. Охарактеризуйте кислород как химический элемент. 2.Где содержится кислород? 3. Кто открыл кислород? 4.Как получают
- 22. Задания для закрепления 1.Сколько молекул содержится в 2 моль кислорода? 2.В каком природном соединении больше кислорода
- 24. Скачать презентацию




















 Настройка сетевой карты в Windows XP
Настройка сетевой карты в Windows XP Графика. Язык графики
Графика. Язык графики Стихи современных поэтов о Родине.
Стихи современных поэтов о Родине. Местная религиозная организация мусульман Иман
Местная религиозная организация мусульман Иман ГК Содружество
ГК Содружество ОБЗОР СУДЕБНОЙ ПРАКТИКИ ГЕРМАНИИ, ВЕЛИКОБРИТАНИИ, ИТАЛИИ, Австарии
ОБЗОР СУДЕБНОЙ ПРАКТИКИ ГЕРМАНИИ, ВЕЛИКОБРИТАНИИ, ИТАЛИИ, Австарии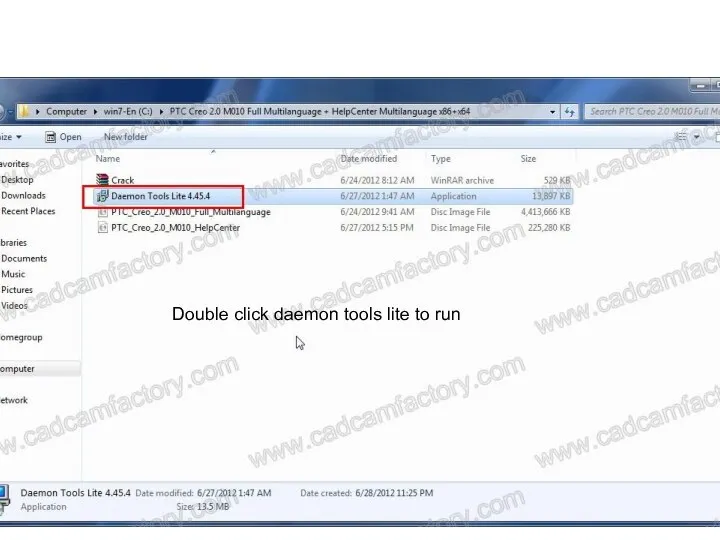 ptc creo 2.0 m010 installation guide
ptc creo 2.0 m010 installation guide Дети и проблема школьной дисциплины
Дети и проблема школьной дисциплины Лингвистический рыцарский турнир
Лингвистический рыцарский турнир Презентация на тему Алюминий и сплавы алюминия
Презентация на тему Алюминий и сплавы алюминия Что вокруг нас может быть опасным
Что вокруг нас может быть опасным Вероисповедание
Вероисповедание Презентация на тему Возникновение ислама и Арабский халифат
Презентация на тему Возникновение ислама и Арабский халифат  Оздоровительная гимнастика. Занятие 21
Оздоровительная гимнастика. Занятие 21 Российская империя
Российская империя Основные ошибки при работе над 1 частью КП
Основные ошибки при работе над 1 частью КП 1908 - 1976
1908 - 1976 Медузы
Медузы Галогены и их соединения
Галогены и их соединения Presentation Title Your company information
Presentation Title Your company information  Деспиде эът
Деспиде эът Презентация на тему Найди свое дело и стань самым лучшим
Презентация на тему Найди свое дело и стань самым лучшим  Формирование личности средствами физической культуры
Формирование личности средствами физической культуры Технические условия размещения и крепления грузов в вагонах и контейнерах
Технические условия размещения и крепления грузов в вагонах и контейнерах Показатели эффективности инновационной деятельности предприятия
Показатели эффективности инновационной деятельности предприятия  Центр дистанционных автоматизированных учебных лабораторий
Центр дистанционных автоматизированных учебных лабораторий Ценообразование. Практика по маркетингу
Ценообразование. Практика по маркетингу Управление конфликтами в коллективе
Управление конфликтами в коллективе