Содержание
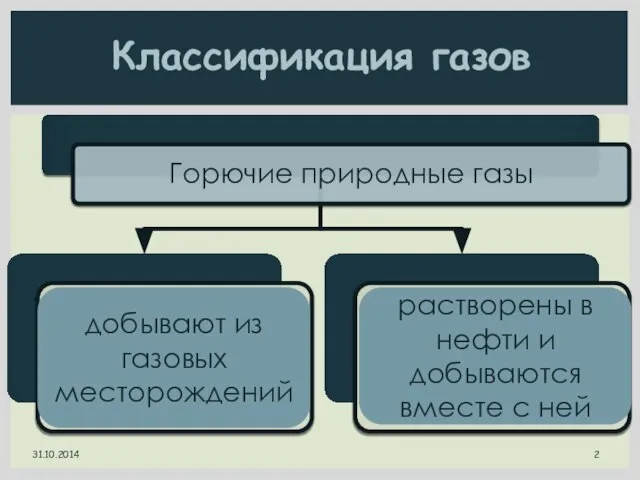
- 2. Классификация газов добывают из газовых месторождений растворены в нефти и добываются вместе с ней
- 3. Классификация газов
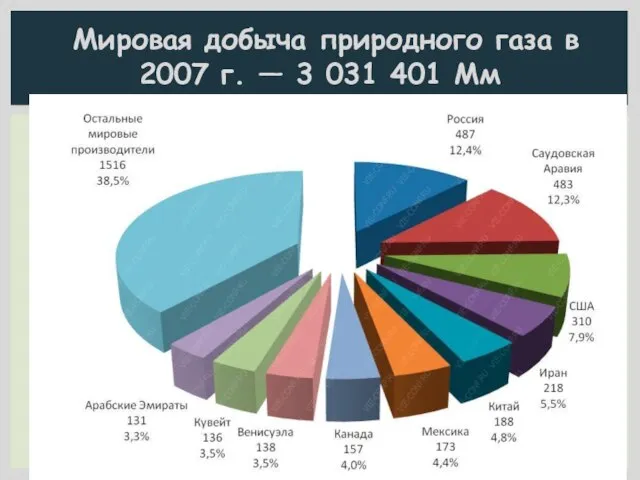
- 4. Мировая добыча природного газа в 2007 г. — 3 031 401 Мм
- 5. Россия занимает 1–е место в мире по добыче и экспорту природного газа (35% мировой добычи газа);
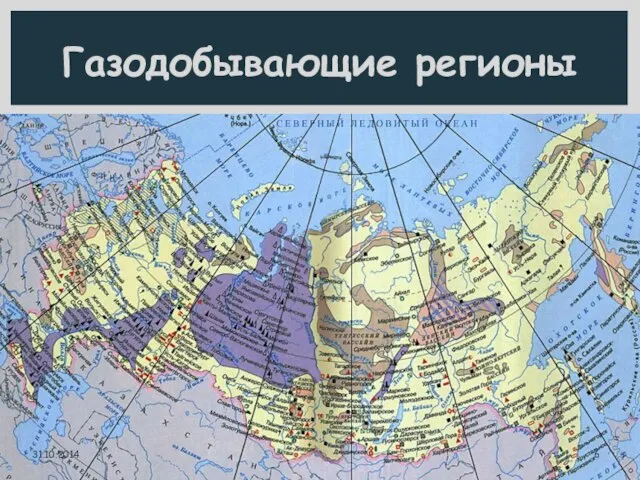
- 6. Газодобывающие регионы
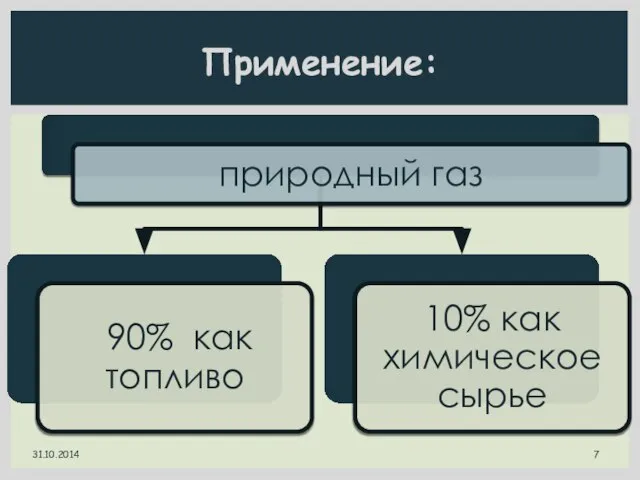
- 7. Применение:
- 8. Природный газ - топливо
- 9. подачу газа в печь легко регулировать; теплота сгорания газа выше, чем у др. видов топлива (при
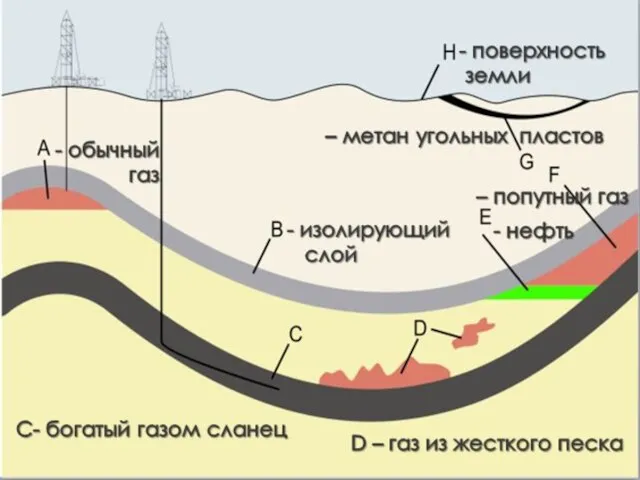
- 10. Природный газ зависит от месторождения
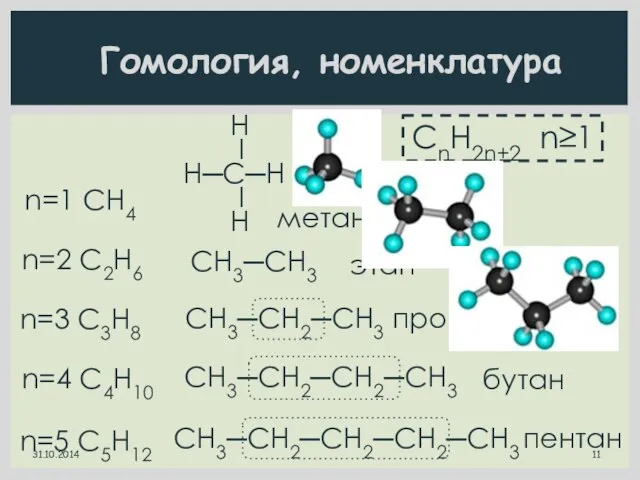
- 11. Гомология, номенклатура CnH2n+2 n≥1 n=2 C2H6 этан СН3─СН3 n=3 C3H8 СН3─СН2─СН3 пропан n=4 C4H10 СН3─СН2─СН2─СН3 бутан
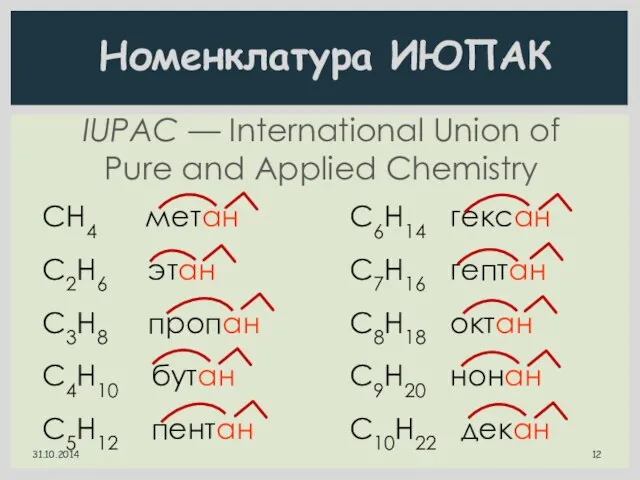
- 12. IUPAC — International Union of Pure and Applied Chemistry Номенклатура ИЮПАК СН4 метан С2H6 этан C3H8
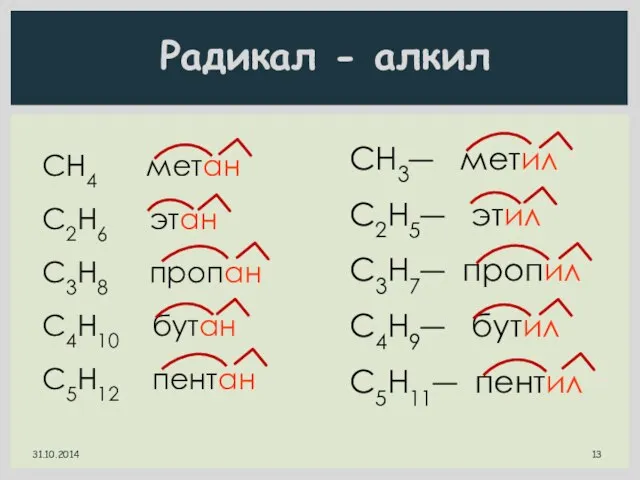
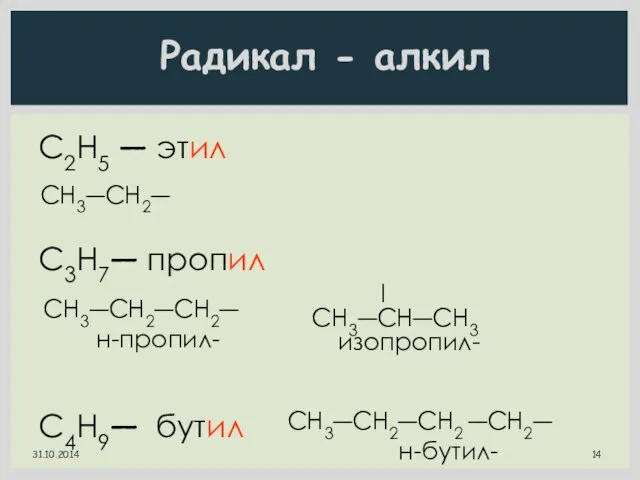
- 13. Радикал - алкил СН4 метан С2H6 этан C3H8 пропан C4H10 бутан C5H12 пентан CH3― метил C2H5―
- 14. С2Н5 ― этил C3H7― пропил C4H9― бутил CH3―CH2― CH3―CH2―CH2― н-пропил- l CH3―CH―CH3 изопропил- CH3―CH2―CH2 ―CH2― н-бутил-
- 15. Гомология, изомерия для алканов характерны явления гомологии и изомерии. Гомологи - вещества, имеющие сходное строение и
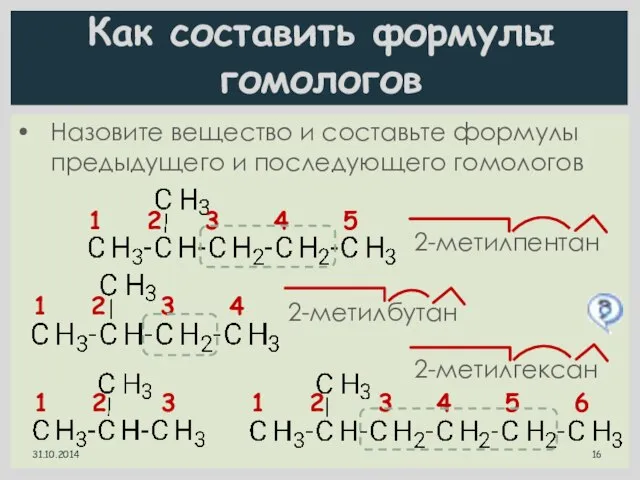
- 16. Как составить формулы гомологов Назовите вещество и составьте формулы предыдущего и последующего гомологов 1 2 3
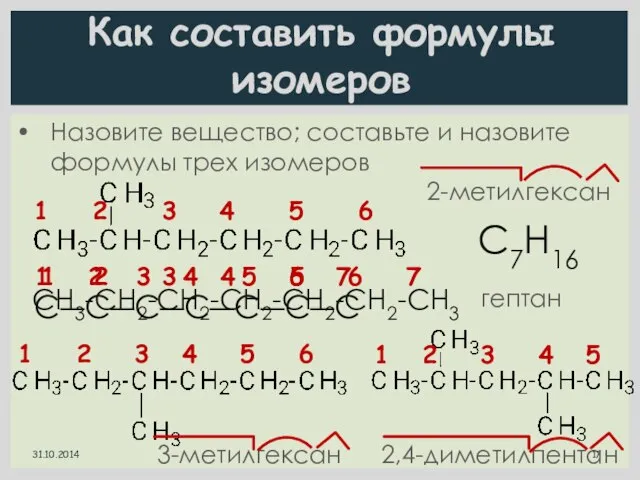
- 17. Как составить формулы изомеров Назовите вещество; составьте и назовите формулы трех изомеров 1 2 3 4
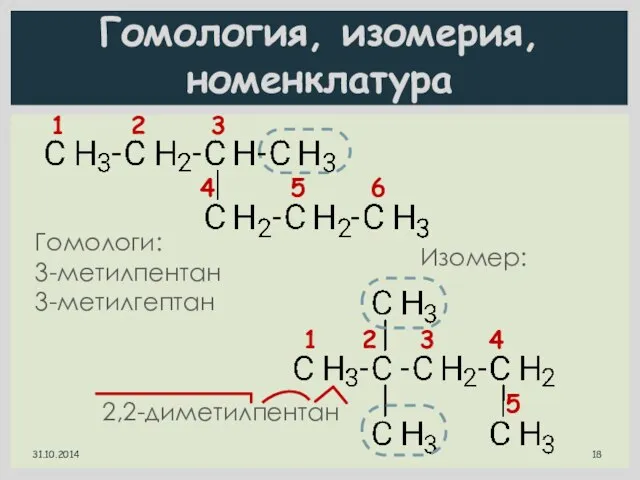
- 18. Гомология, изомерия, номенклатура 1 2 3 4 5 6 3-метилгексан Гомологи: 3-метилпентан 3-метилгептан Изомер: 1 2
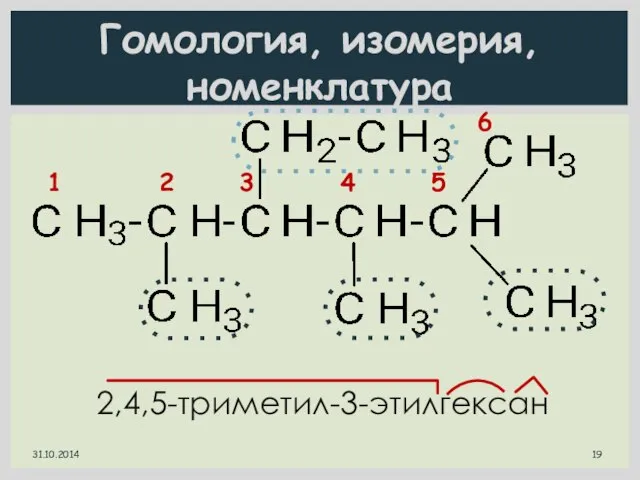
- 19. Гомология, изомерия, номенклатура 1 2 3 4 5 6 2,4,5-триметил-3-этилгексан
- 20. Гомология, изомерия, номенклатура 2,3,4-триметилгексан 4 5 6 1 2 3
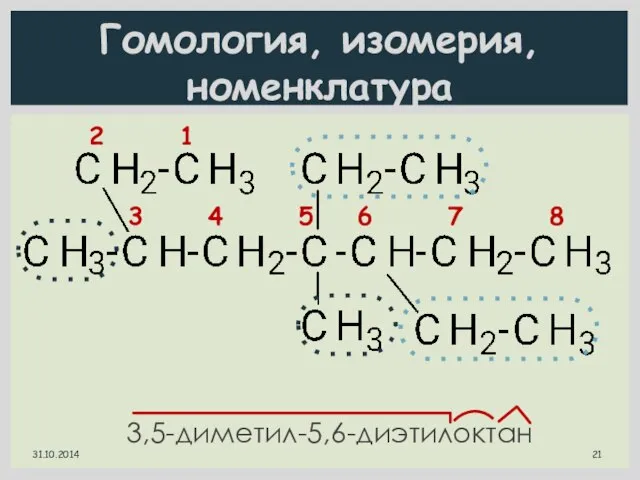
- 21. Гомология, изомерия, номенклатура 3,5-диметил-5,6-диэтилоктан 2 1 3 4 5 6 7 8
- 22. Физические и химические свойства алканов. Применение. Природный газ – химическое сырье
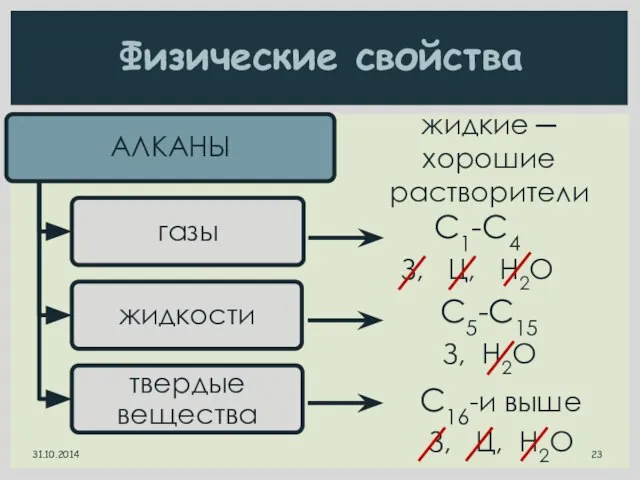
- 23. Физические свойства С1-С4 З, Ц, H2O С5-С15 З, H2O С16-и выше З, Ц, H2O жидкие ─
- 24. Получение алканов в лаборатории CH3COONa + NaOH Na2CO3 + CH4 прокаливание
- 25. Химические свойства Алканы - парафины (химически мало активные вещества): все реакции протекают в «жестких» условиях
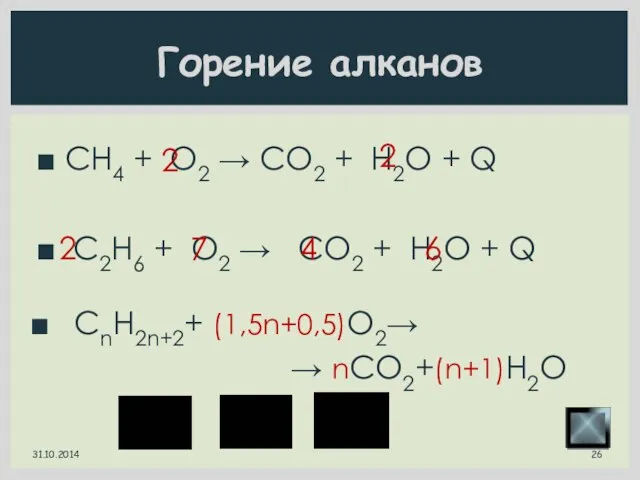
- 26. CH4 + O2 → CO2 + H2O + Q C2H6 + O2 → CO2 + H2O
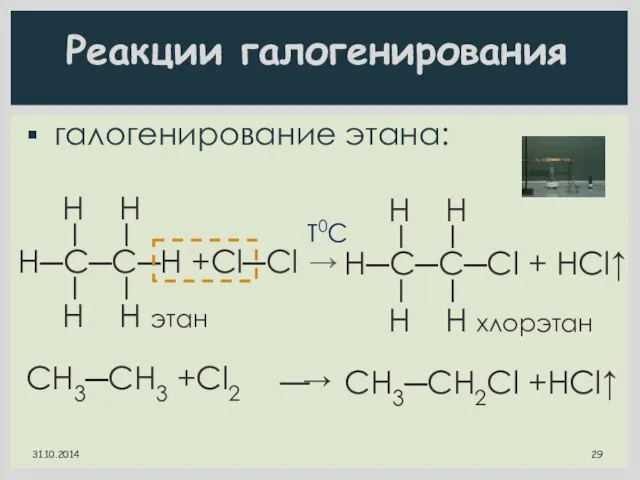
- 27. Реакции галогенирования – реакция, в результате которой происходит замещение атомов Н в молекулах алканов атомами галогенов.
- 28. Реакции галогенирования – ступенчатый процесс:
- 29. Реакции галогенирования H H I I Н─С─С─Н +Cl─Cl I I H H этан T0C H
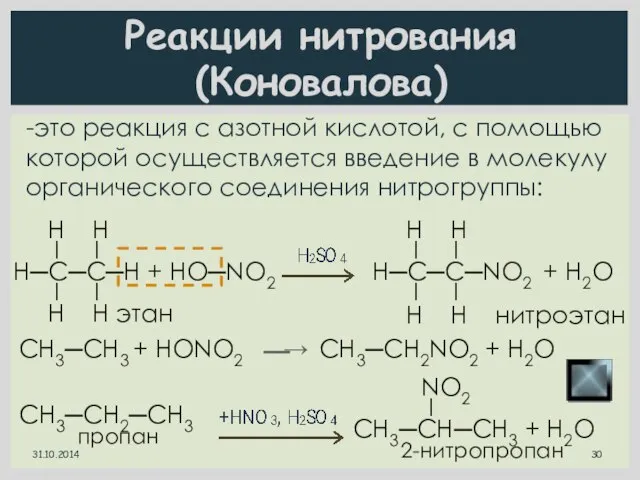
- 30. Реакции нитрования (Коновалова) -это реакция с азотной кислотой, с помощью которой осуществляется введение в молекулу органического
- 31. Термическое разложение СН4 С + 2H2 сажа (полное разложение) дегидрирование: 10000С 2СН4 С2H2 + 3H2
- 32. CН3 l C4H10 → CН3-СН-СН3 н-бутан изобутан (2-метилпропан) C6H14 → CН3-СН-СН-СН3 н-гексан l l CН3 CН3
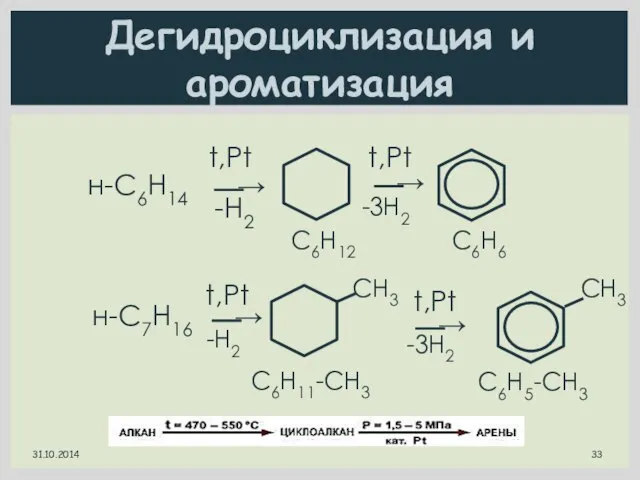
- 33. Дегидроциклизация и ароматизация н-С6Н14 t,Pt t,Pt -Н2 -3Н2 C6Н12 C6Н6 н-С7Н16 t,Pt CН3
- 34. C32H66 → C16H34 + C16H32 C16H34 → C8H18 + C8H16 гексадекан октан октен C8H18 → C4H10
- 36. Скачать презентацию













 Установление империи в Риме
Установление империи в Риме Шаблон презентации
Шаблон презентации Моя родина - Россия 4 класс
Моя родина - Россия 4 класс Семинар 1. Знакомство с языками программирования
Семинар 1. Знакомство с языками программирования Оценка инвестиционных проектов
Оценка инвестиционных проектов Презентация на тему "Формы работы с активом детских организаций (Методические рекомендации организаторам детского движения )&quo
Презентация на тему "Формы работы с активом детских организаций (Методические рекомендации организаторам детского движения )&quo 2 сентября 2009 г.
2 сентября 2009 г. Презентация на тему Мой любимый Волгодонск
Презентация на тему Мой любимый Волгодонск Международная Инвестиционная Премия «Инвестиционный Ангел»
Международная Инвестиционная Премия «Инвестиционный Ангел» Импульс
Импульс Розробити технологічний процес складання та ремонту противопожежної системи двигунів АІ-450М вертольота МІ-2МСБ
Розробити технологічний процес складання та ремонту противопожежної системи двигунів АІ-450М вертольота МІ-2МСБ Противоэрозионные мероприятия
Противоэрозионные мероприятия Природа Европейского Севера
Природа Европейского Севера ИНДИКАТОРНЫЙ АНАЛИЗ
ИНДИКАТОРНЫЙ АНАЛИЗ  Дифференциация букв и звуков О-У
Дифференциация букв и звуков О-У Особенности развития современных дошкольников
Особенности развития современных дошкольников Рецепт успешного политического лидера
Рецепт успешного политического лидера Социально-психологическое сопровождение детей с ограничеными возможностями
Социально-психологическое сопровождение детей с ограничеными возможностями Допинг
Допинг тестирование обучающихся образовательных учреждений Санкт-Петербурга с использованием АИС «Знак» по общеобразовательным пред
тестирование обучающихся образовательных учреждений Санкт-Петербурга с использованием АИС «Знак» по общеобразовательным пред ПРИЗНАКИ ТЕКСТА
ПРИЗНАКИ ТЕКСТА 22 марта 2011 г. Процедура проведения закупок кафедрами и подразделениями в 2011 году
22 марта 2011 г. Процедура проведения закупок кафедрами и подразделениями в 2011 году Наши соседи - белки
Наши соседи - белки Седация в анестезиологии и интенсивной терапии
Седация в анестезиологии и интенсивной терапии но
но Предстартовый синдром. Психологическая подготовка спортсмена
Предстартовый синдром. Психологическая подготовка спортсмена The Political Consequences of Brexit
The Political Consequences of Brexit УРОК - презентация "Олимпийские чемпионы"
УРОК - презентация "Олимпийские чемпионы"