Содержание
- 2. Реакции окисления-восстановления реакции, в ходе которых происходит изменение степени окисления одного или нескольких атомов углерода.
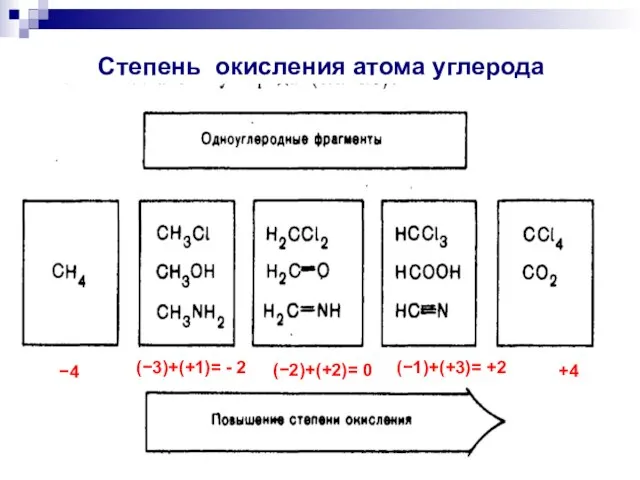
- 3. 4 (3)+(+1)= - 2 (2)+(+2)= 0 (1)+(+3)= +2 +4 Степень окисления атома углерода
- 4. Окисление Процесс удаления водорода образование кратной связи или замена связей СН на связи с другими
- 5. Восстановление замена связей с электроотрицательными элементами на новые связи СН. степень окисления С уменьшается. Восстановление
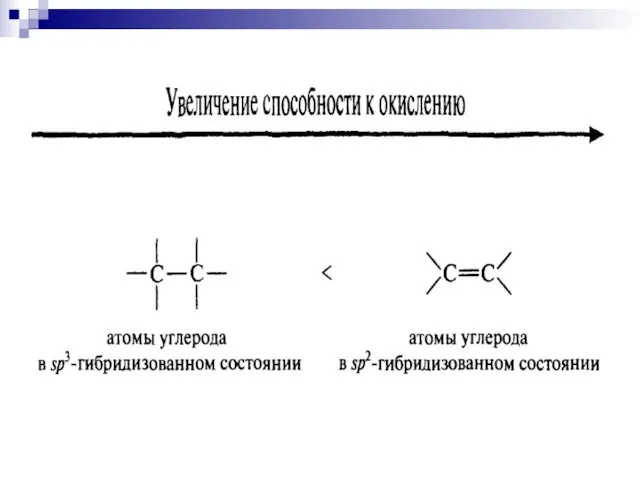
- 6. Окисление органического соединения протекает тем легче, чем больше выражена в нём тенденция к передаче электронов.
- 7. (97 ккал/моль) (94 ккал/моль) (91 ккал/моль) .
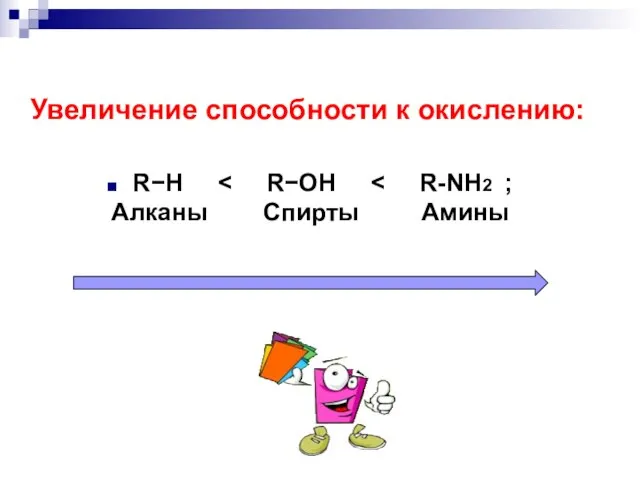
- 9. Увеличение способности к окислению: RH Алканы Спирты Амины
- 10. Горение алканов СН4 + О2 СО2 + H2О + выделение тепла и света Окисление алканов
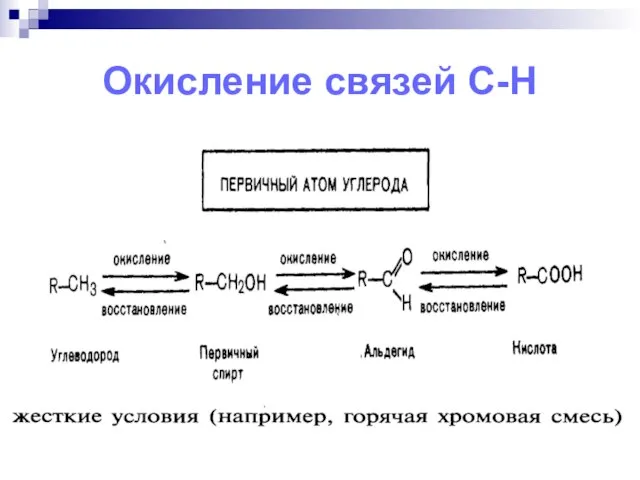
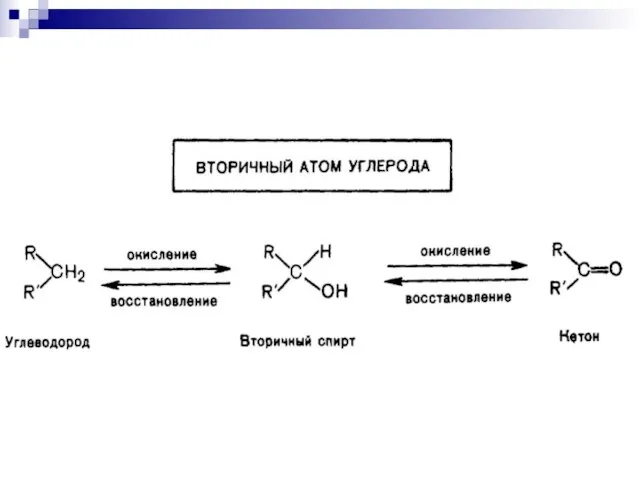
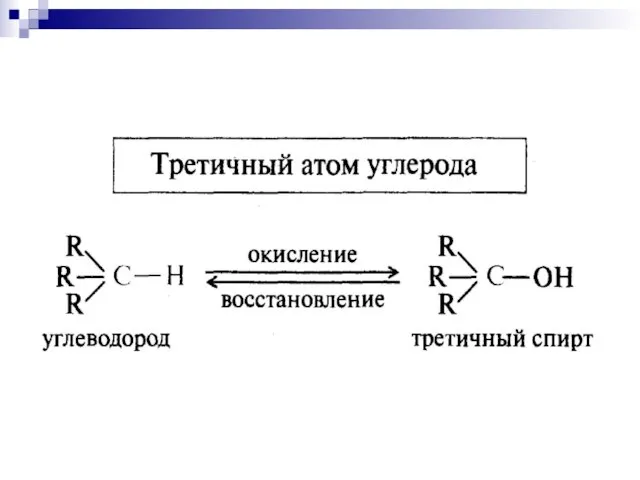
- 11. Окисление связей С-Н
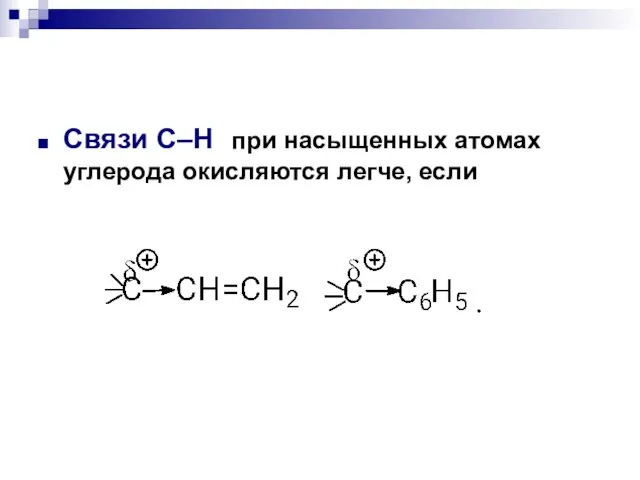
- 14. Связи С–Н при насыщенных атомах углерода окисляются легче, если
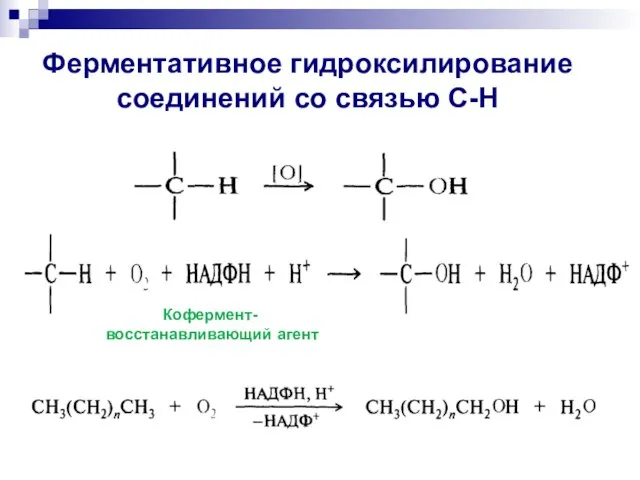
- 15. Окисление в мягких условиях ( в условиях организма) :
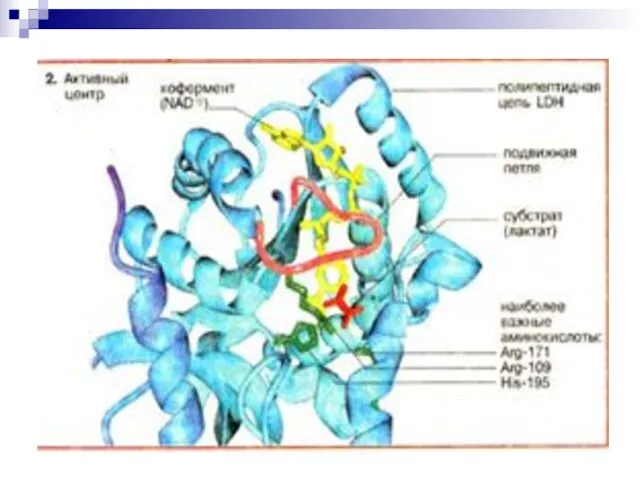
- 16. Ферментативное гидроксилирование соединений со связью С-Н Кофермент- восстанавливающий агент
- 17. Коферменты: функции Вспомогательные органические соединения небелковой природы, входящие в состав некоторых ферментов. Соединяясь с ферментом, коферменты
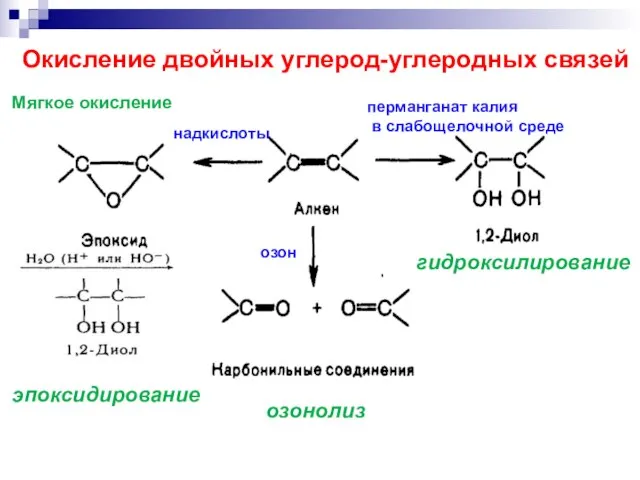
- 18. озонолиз эпоксидирование гидроксилирование озон надкислоты Окисление двойных углерод-углеродных связей перманганат калия в слабощелочной среде Мягкое окисление
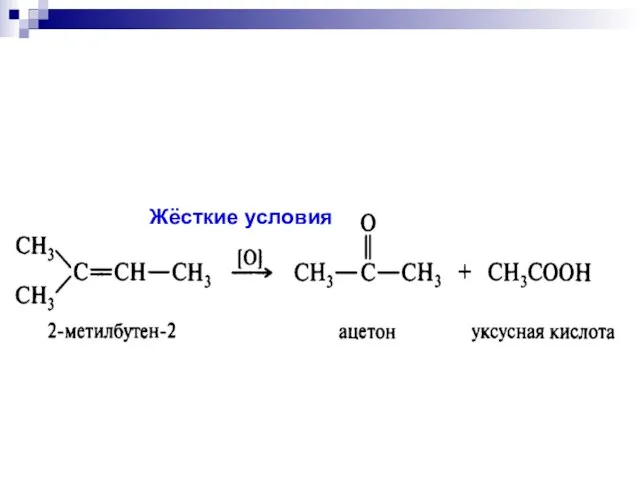
- 19. Жёсткие условия
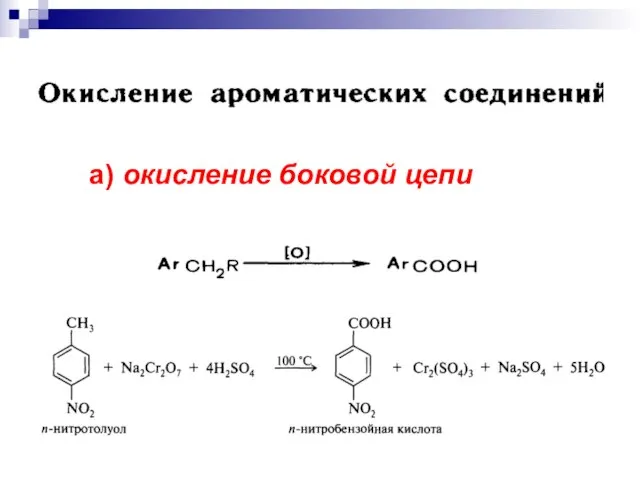
- 20. а) окисление боковой цепи
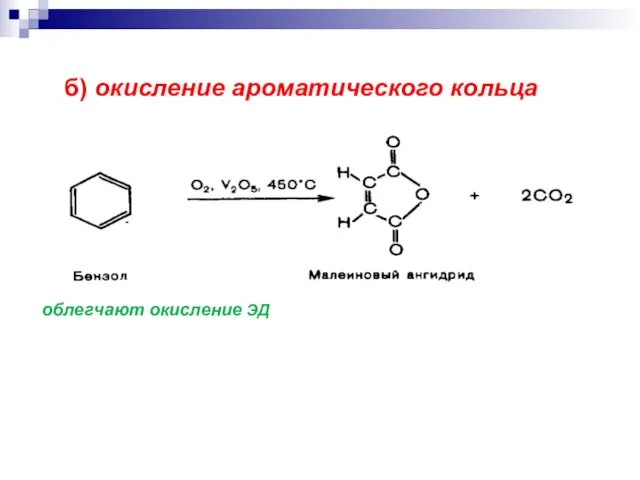
- 21. б) окисление ароматического кольца облегчают окисление ЭД
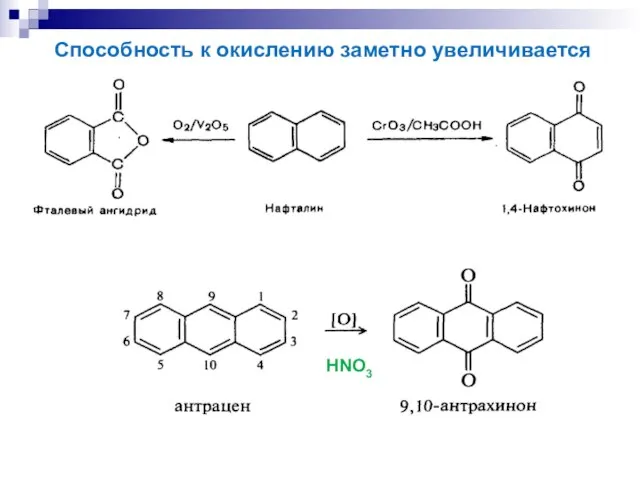
- 22. HNO3 Способность к окислению заметно увеличивается
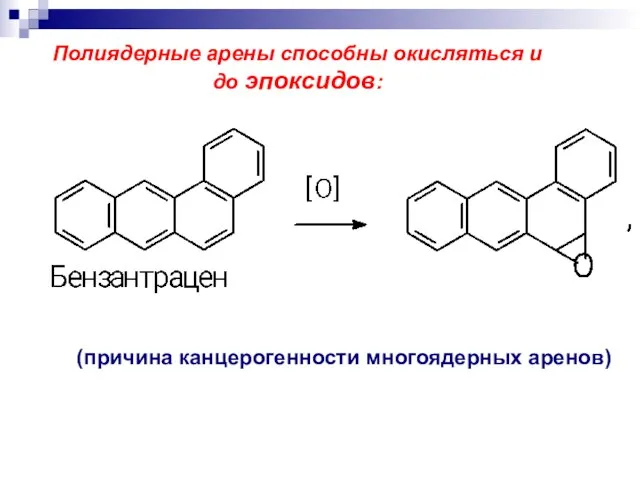
- 24. (причина канцерогенности многоядерных аренов) Полиядерные арены способны окисляться и до эпоксидов:
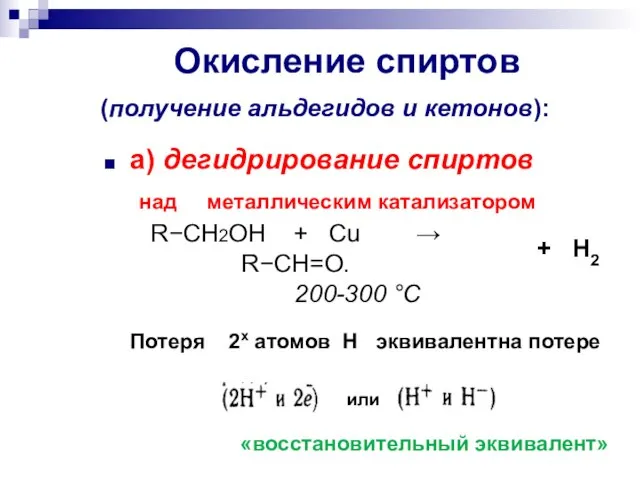
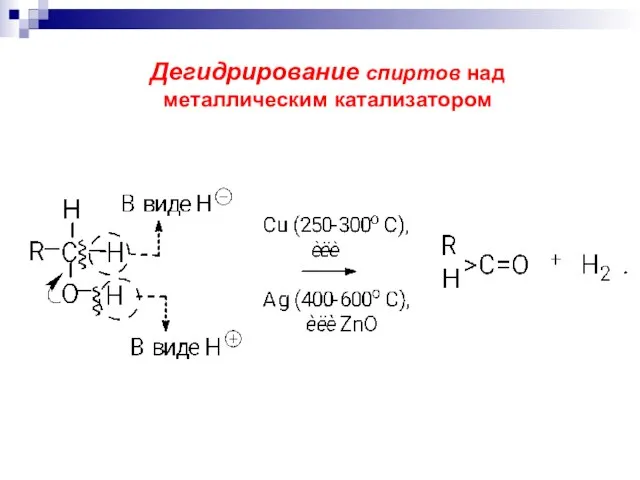
- 25. Окисление спиртов (получение альдегидов и кетонов): а) дегидрирование спиртов над металлическим катализатором RCH2OH + Cu
- 26. Дегидрирование спиртов над металлическим катализатором
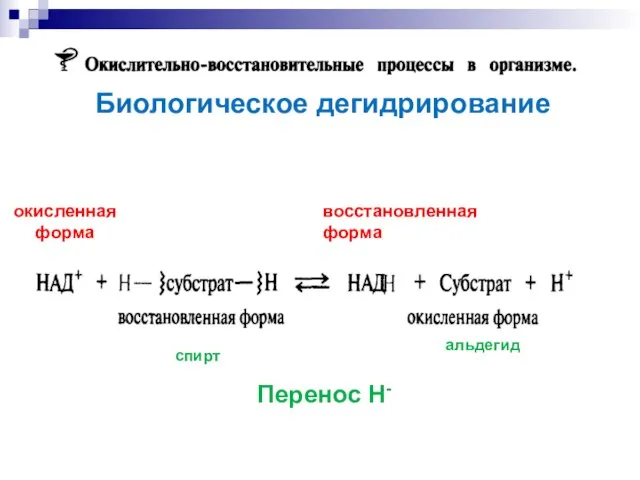
- 27. Биологическое дегидрирование окисленная форма восстановленная форма Перенос Н- спирт альдегид
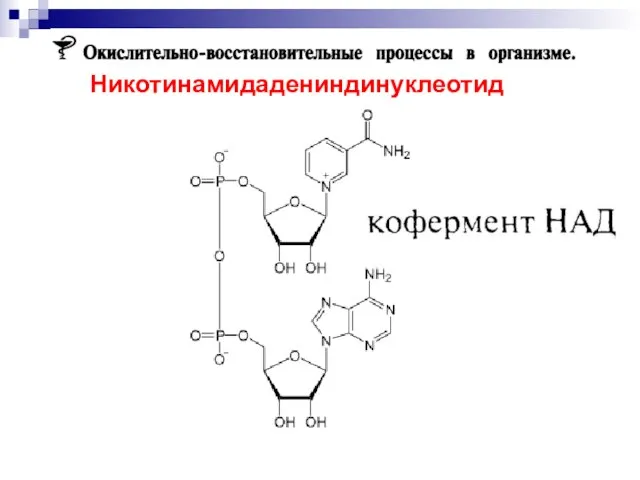
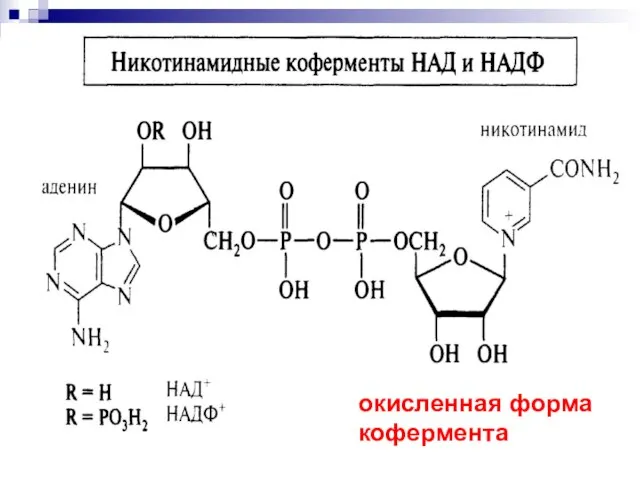
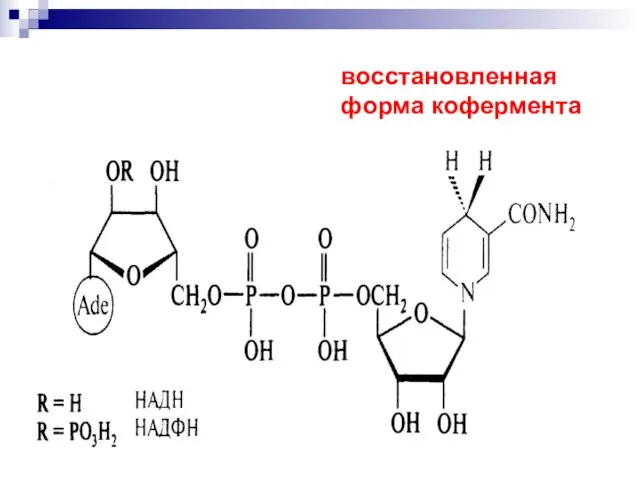
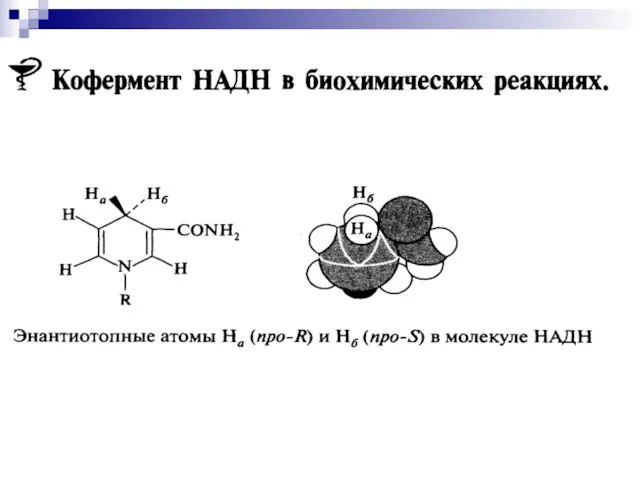
- 28. Никотинамидадениндинуклеотид
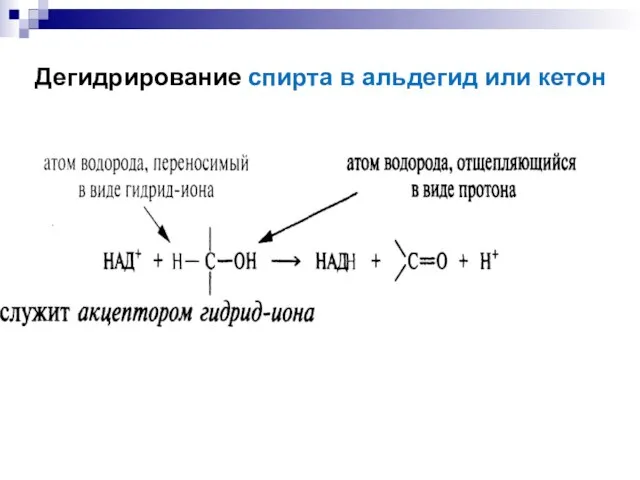
- 29. Дегидрирование спирта в альдегид или кетон
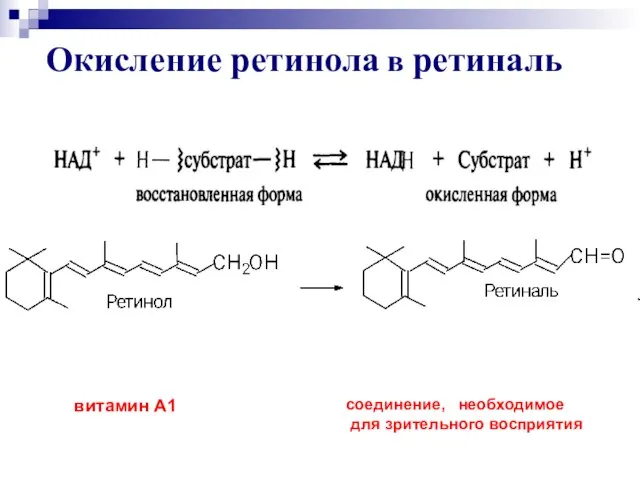
- 30. Окисление ретинола в ретиналь витамин А1 соединение, необходимое для зрительного восприятия
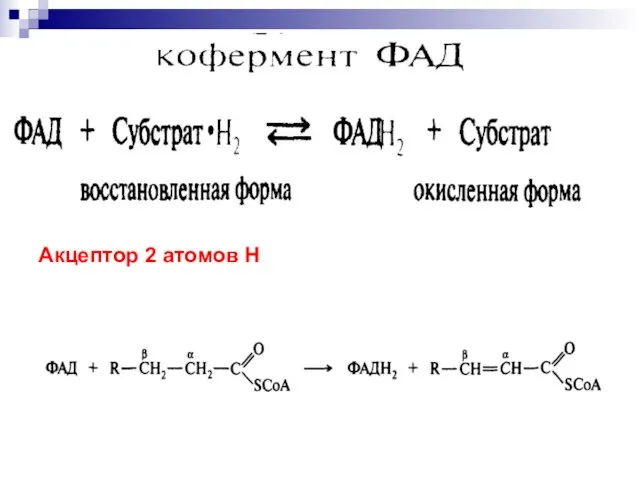
- 31. Акцептор 2 атомов Н
- 32. б) окисление спиртов сильными окислителями RCH2OH + KMnO4 / H2O RCOOK+ + MnO2 Третичные спирты
- 33. Окисление альдегидов RCH=O + [Ag(NH3)2]OH RCOONH4 + Ag Реактив Толленса Реакция "серебряного зеркала" RCH=O +
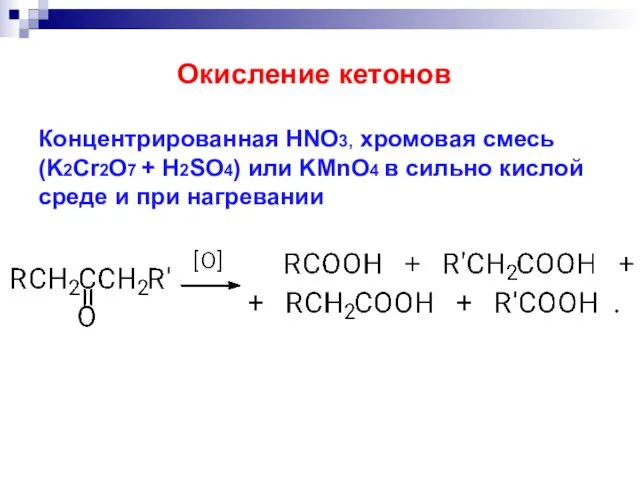
- 34. Концентрированная HNO3, хромовая смесь (K2Cr2O7 + H2SO4) или KMnO4 в сильно кислой среде и при нагревании
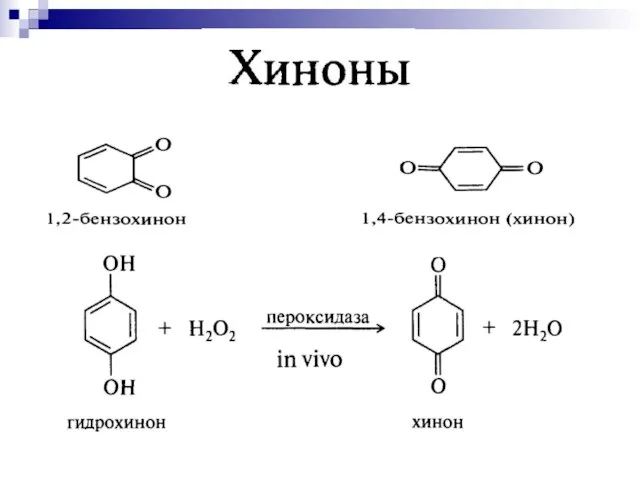
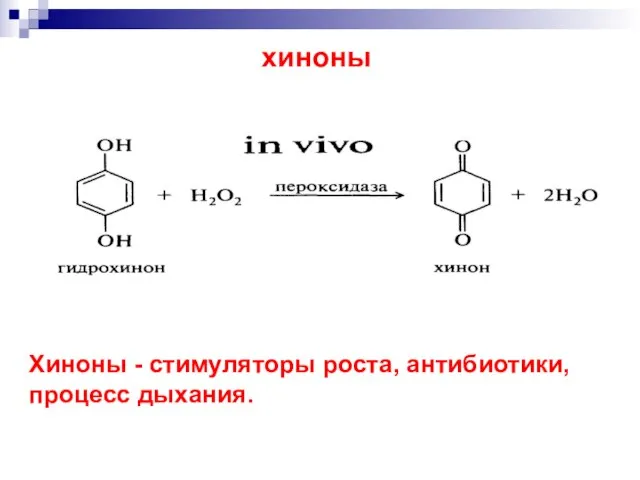
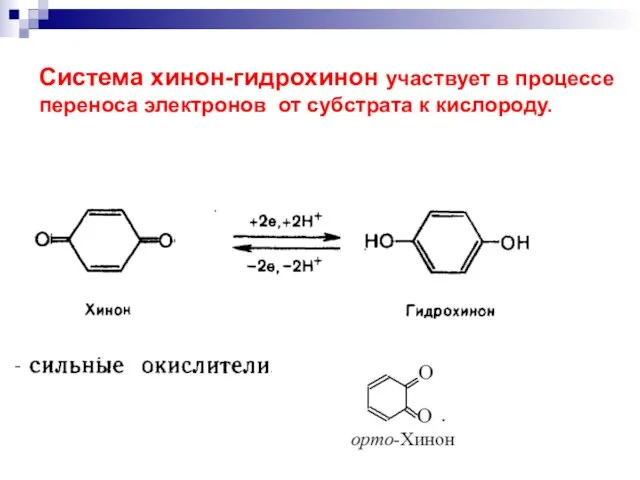
- 35. до двухатомных фенолов: Гидрохинон Окисление фенолов [O]
- 36. хиноны Хиноны - стимуляторы роста, антибиотики, процесс дыхания.
- 37. Система хинон-гидрохинон участвует в процессе переноса электронов от субстрата к кислороду.
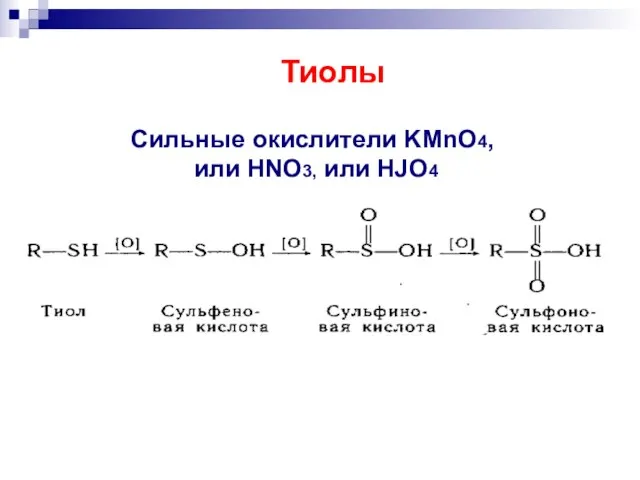
- 38. RSH + H2O2, или CuCl2, или O2 RSSR . Тиолы Мягкое окисление
- 39. Сильные окислители KMnO4, или HNO3, или HJO4 Тиолы
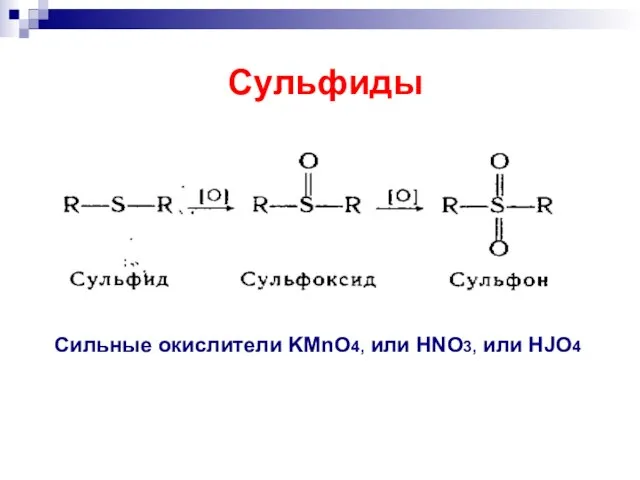
- 40. Сильные окислители KMnO4, или HNO3, или HJO4 Сульфиды
- 41. Окисление аминов
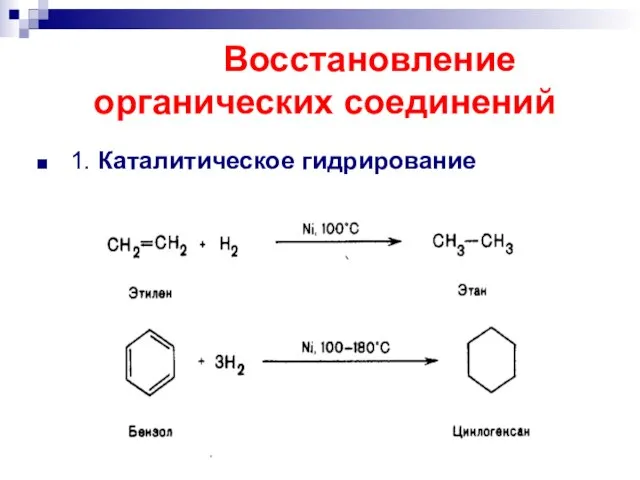
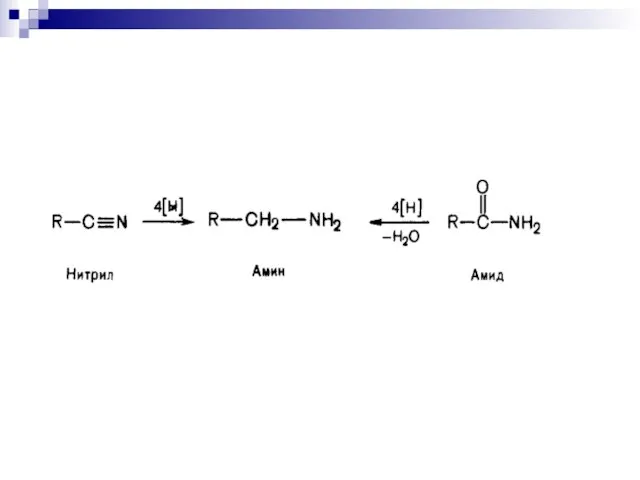
- 42. Восстановление органических соединений 1. Каталитическое гидрирование
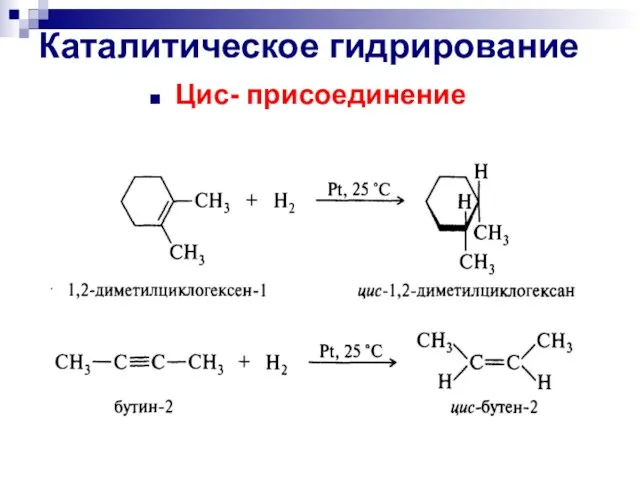
- 43. Каталитическое гидрирование Цис- присоединение
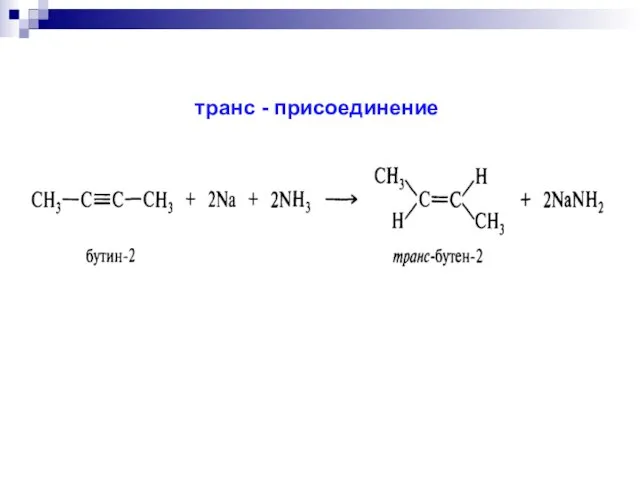
- 44. транс - присоединение
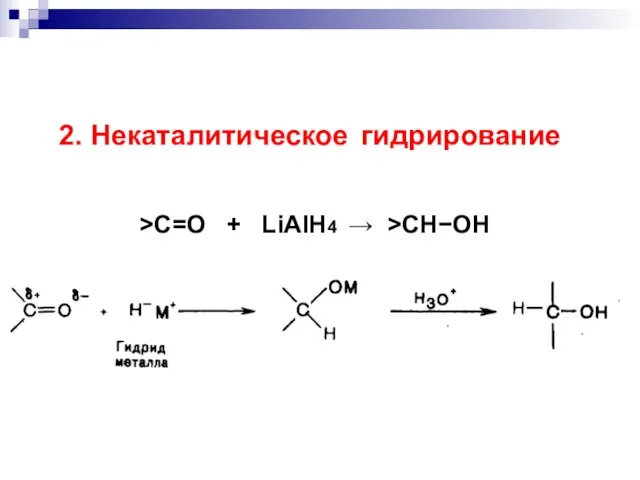
- 45. 2. Некаталитическое гидрирование >C=O + LiAlH4 >CHOH
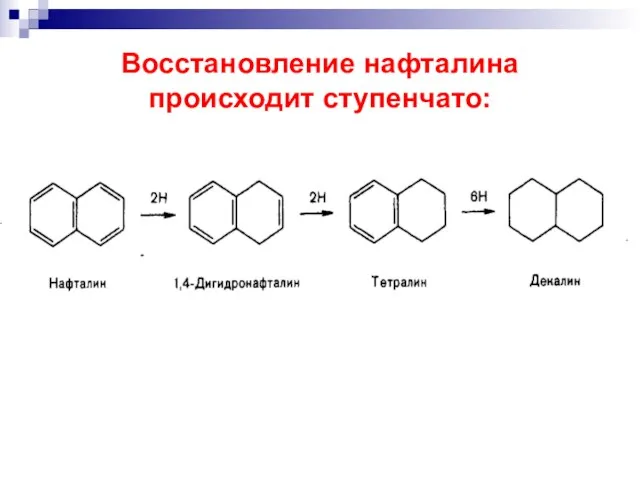
- 46. Восстановление нафталина происходит ступенчато:
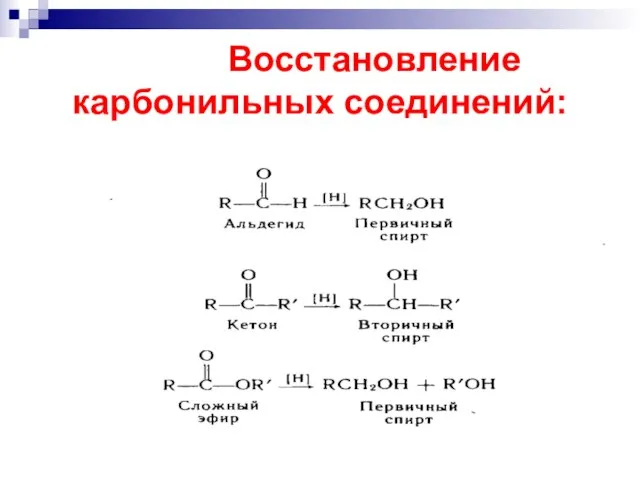
- 47. Восстановление карбонильных соединений:
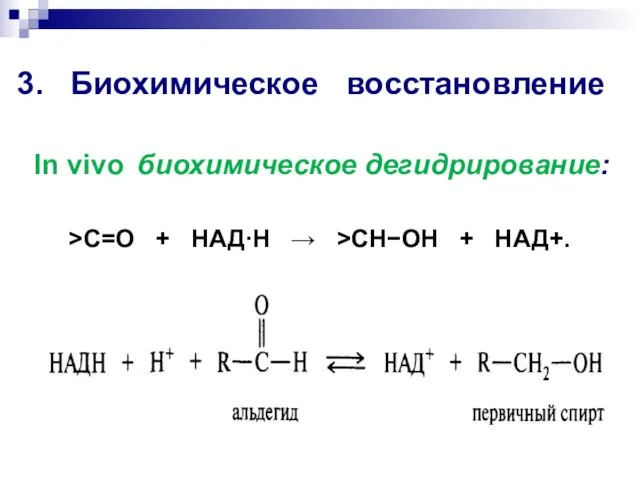
- 49. 3. Биохимическое восстановление >C=O + НАДН >CHOH + НАД+. In vivo биохимическое дегидрирование:
- 50. Никотинамидадениндинуклеотид кофермент, присутствующий во всех живых клетках; входит в состав ферментов группы дегидрогеназ, катализирующих окислительно-восстановительные реакции.
- 51. ОТТО ГЕНРИХ ВАРБУРГ (1883–1970), немецкий биохимик и физиолог, удостоенный в 1931 Нобелевской премии по физиологии и
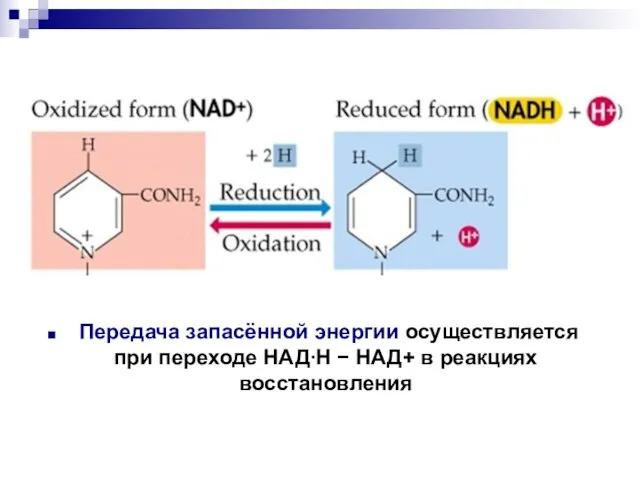
- 52. окисленная форма кофермента
- 53. восстановленная форма кофермента
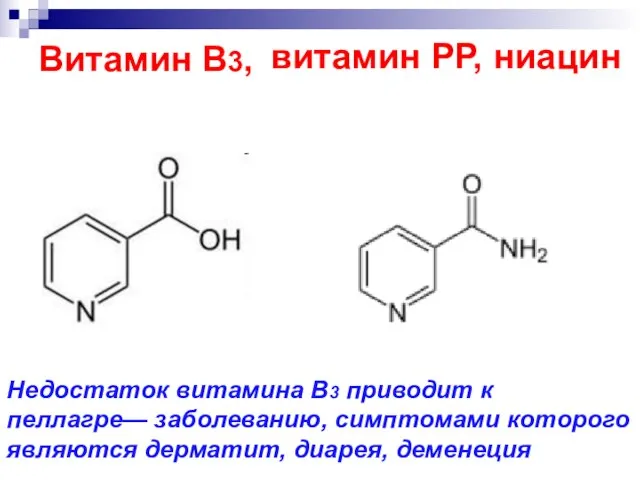
- 54. Витамин В3, витамин РР, ниацин Недостаток витамина B3 приводит к пеллагре— заболеванию, симптомами которого являются дерматит,
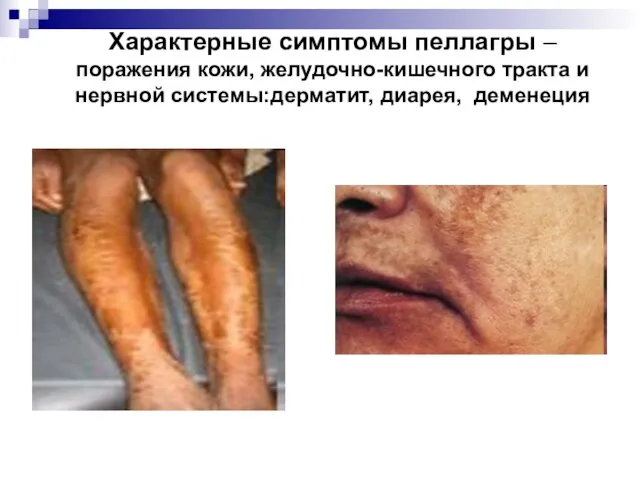
- 55. Характерные симптомы пеллагры – поражения кожи, желудочно-кишечного тракта и нервной системы:дерматит, диарея, деменеция
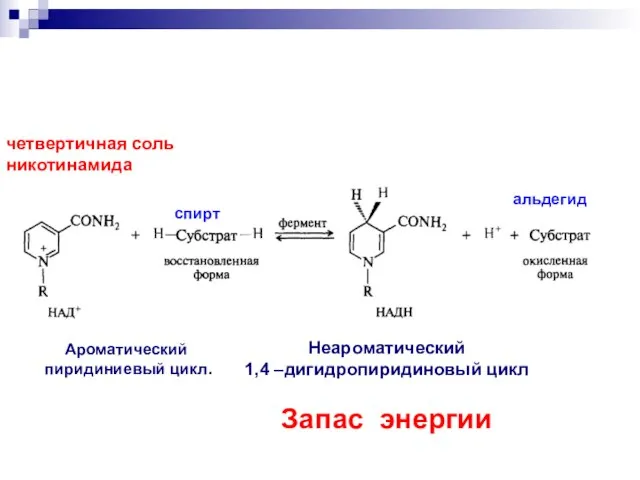
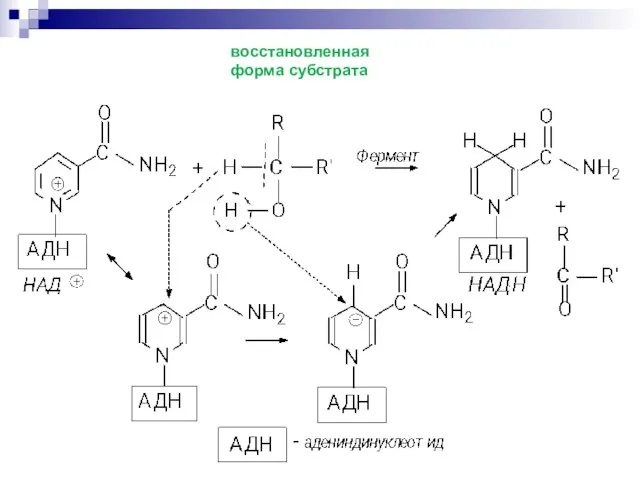
- 56. Ароматический пиридиниевый цикл. Неароматический 1,4 –дигидропиридиновый цикл Запас энергии четвертичная соль никотинамида спирт альдегид
- 57. восстановленная форма субстрата
- 58. Передача запасённой энергии осуществляется при переходе НАДН НАД+ в реакциях восстановления
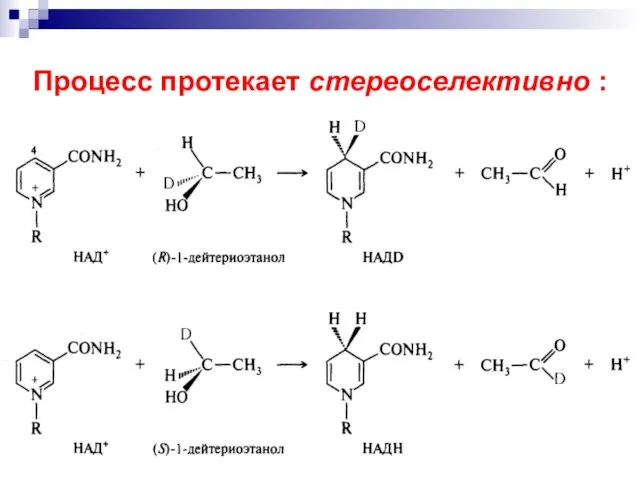
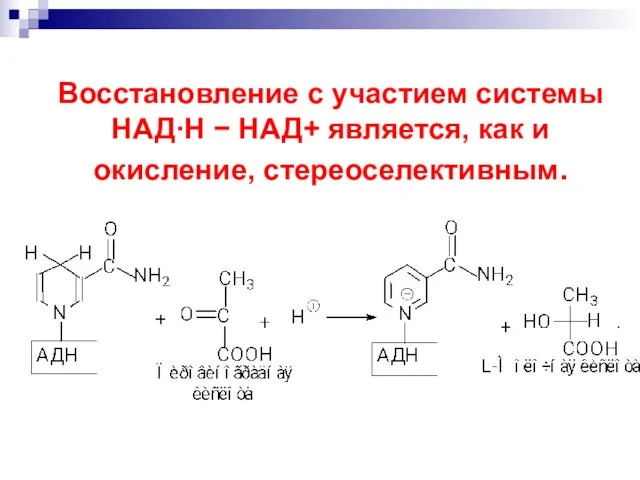
- 60. Процесс протекает стереоселективно :
- 62. Восстановление с участием системы НАДН НАД+ является, как и окисление, стереоселективным.
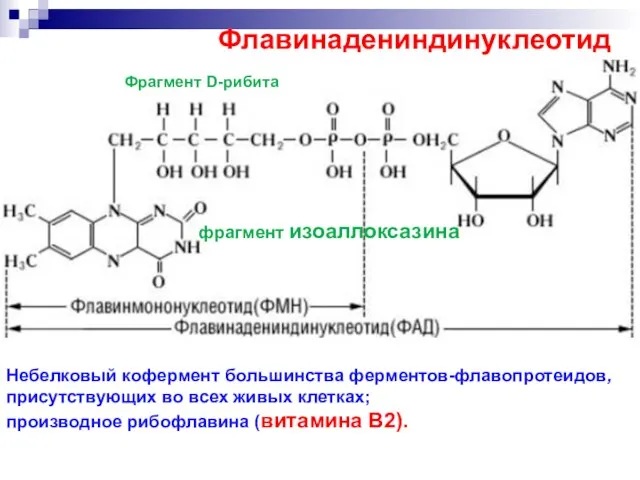
- 64. Флавинадениндинуклеотид Небелковый кофермент большинства ферментов-флавопротеидов, присутствующих во всех живых клетках; производное рибофлавина (витамина В2). Фрагмент D-рибита
- 65. Флавинадениндинуклеотид.
- 66. ФАД выполняет роль окислителя FAD FADH2 ФАД ФАДН2 Окисленная форма Восстановленная форма
- 67. Витамин В2 Функции: энергетический обмен; зрение; кожа, ногти, слизистые оболочки; образование красных кровяных клеток; окислительно-восстановительные реакции;
- 68. Источники: дрожжи, листовые зелёные овощи, крупы (гречневая и овсяная), горох, зародыши и оболочки зерновых культур, хлеб;
- 69. Последствия дефицита: поражения слизистых оболочек и кожного покрова; жжение и зуд в глазах, катаракты, чувствительность к
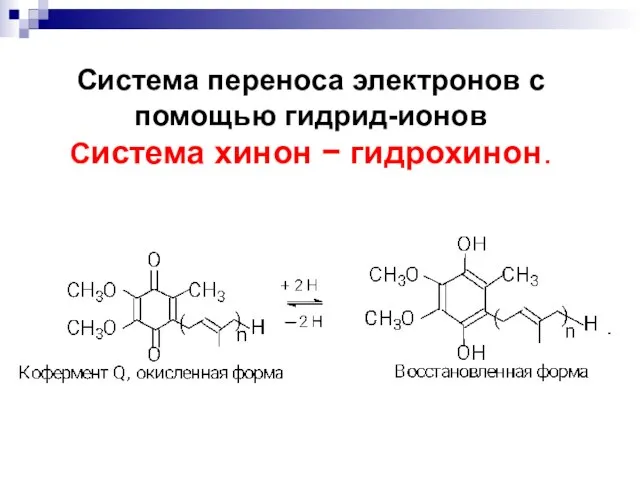
- 70. Система переноса электронов с помощью гидрид-ионов Система хинон гидрохинон. В биологических системах этот перенос осуществляется
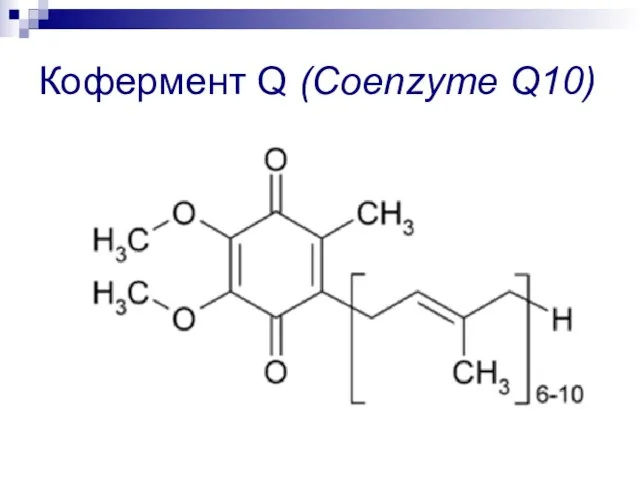
- 71. Кофермент Q (Coenzyme Q10)
- 72. Система переноса электронов с помощью гидрид-ионов Система хинон гидрохинон.
- 73. Функции в организме: *Обеспечивает выработку энергии на клеточном уровне *Положительно влияет на сердечно-сосудистую систему, головной мозг
- 74. Богатые источники CoQ10 говяжье сердце и другие внутренние органы, яичный желток, печень, треска, молочный жир, различные
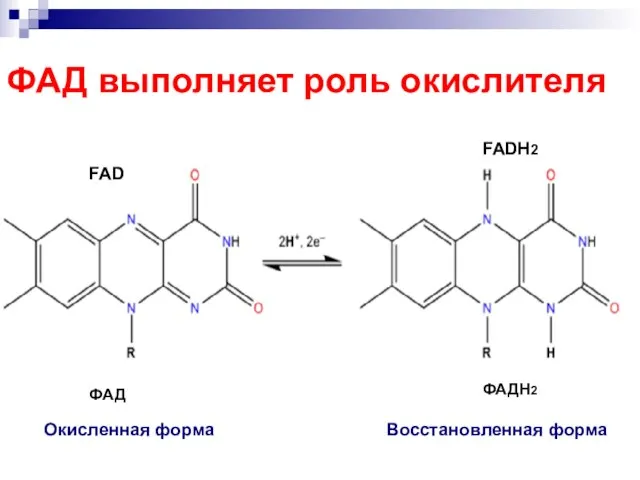
- 77. Скачать презентацию









![Окисление альдегидов RCH=O + [Ag(NH3)2]OH RCOONH4 + Ag Реактив Толленса Реакция](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/278979/slide-32.jpg)
![до двухатомных фенолов: Гидрохинон Окисление фенолов [O]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/278979/slide-34.jpg)












 Никто не забыт! Ничто не забыто!
Никто не забыт! Ничто не забыто! Презентация на тему Корни и корневые системы
Презентация на тему Корни и корневые системы  Муравей – это студия семейного и детского творчества
Муравей – это студия семейного и детского творчества Лаунж-зона на Бульваре Фонтанов
Лаунж-зона на Бульваре Фонтанов Онлайн-радио Kartina Media Kit
Онлайн-радио Kartina Media Kit Информатизация школьного образовательного пространства
Информатизация школьного образовательного пространства География и современность
География и современность Презентация на тему Русские лингвисты
Презентация на тему Русские лингвисты ИТОГИ ОТЧЕТА ФОРМЫ 5-ФК учреждений дополнительного образования детей физкультурно - спортивной направленностиза 2011 год
ИТОГИ ОТЧЕТА ФОРМЫ 5-ФК учреждений дополнительного образования детей физкультурно - спортивной направленностиза 2011 год Юджин Смит
Юджин Смит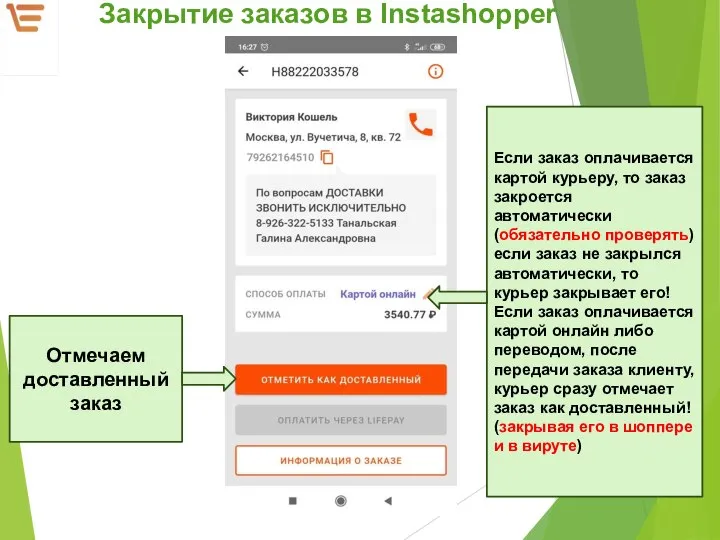 Завершение заказов в Instashopper и в VeeRoute (курьеры)
Завершение заказов в Instashopper и в VeeRoute (курьеры) Итоги работы детского объединения «Солнышко» (1 – 4 кл.) за 2009 – 2010 учебный год /руководитель: Л.А. Лобаскина/
Итоги работы детского объединения «Солнышко» (1 – 4 кл.) за 2009 – 2010 учебный год /руководитель: Л.А. Лобаскина/ Борьба с огнем - дело общее!
Борьба с огнем - дело общее! Науки и искусства Древнего Египта
Науки и искусства Древнего Египта Звезды арабской математики
Звезды арабской математики Кавказские Минеральные Воды
Кавказские Минеральные Воды Сложение и вычитание дробей
Сложение и вычитание дробей Монокристаллы
Монокристаллы Технология работы сценарии (бандлы)
Технология работы сценарии (бандлы) Синтаксические нормы. Нормы согласования и управления
Синтаксические нормы. Нормы согласования и управления Палехская роспись, палехские иконы
Палехская роспись, палехские иконы Presentation Title
Presentation Title  "РИФМЫ"
"РИФМЫ" Энциклопедия слова «мороз»
Энциклопедия слова «мороз» данте сальери божественная комедия
данте сальери божественная комедия Ремонт спортзала
Ремонт спортзала Услуги из облака: спектр выбора
Услуги из облака: спектр выбора Православные храмы Кубани
Православные храмы Кубани