Содержание
- 2. Щелочны́е мета́ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы
- 4. МЕТАЛЛИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА Металлы серебристо-белого цвета с незначительными оттенками, легкие (легче воды) и легкоплавкие, мягкие (можно
- 5. Х И М И Ч Е С К И Е С В О Й С Т
- 6. Все щелочные металлы активно реагируют с водой, образуя щелочи и восстанавливая воду до водорода: 2М0 +
- 7. Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое
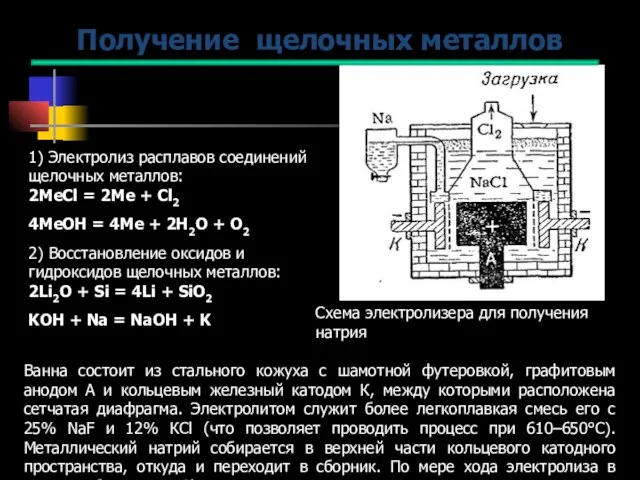
- 8. 1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О
- 9. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 10. Литий был открыт в 1817 г. А. Арфведсоном в минерале петалите. Берцелиус предложил назвать ее литионом
- 11. Сподуменн
- 12. Получение В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный
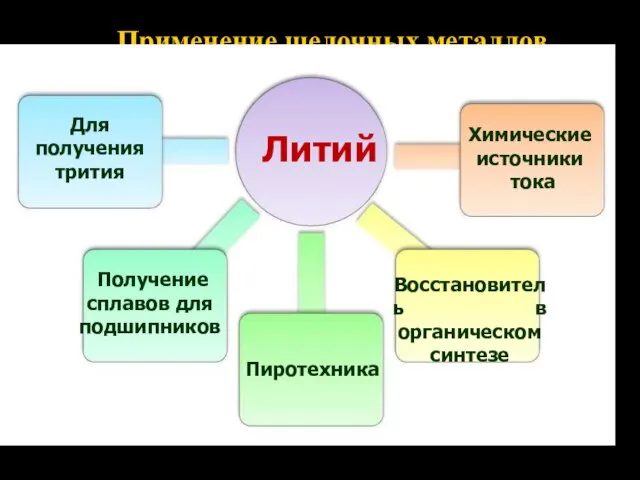
- 13. Применение щелочных металлов Литий Для получения трития Получение сплавов для подшипников Восстановитель в органическом синтезе Химические
- 14. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 15. Натрий (Natrium, от англ. и франц. Sodium, нем. Natrium от древнеевр. neter — бурлящее вещество. В
- 16. Галит
- 17. Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью
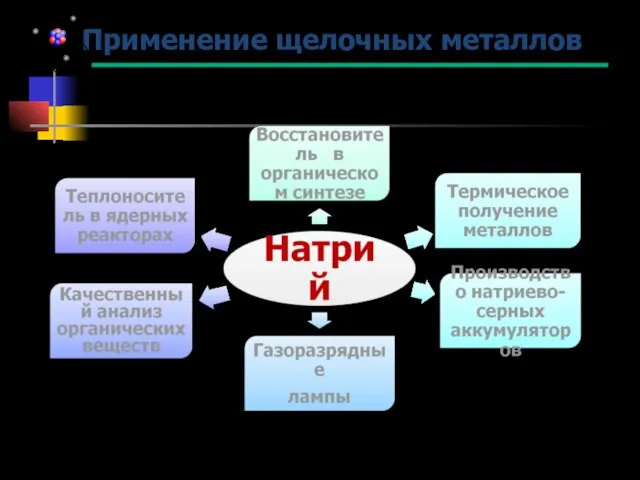
- 18. Применение щелочных металлов
- 19. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 20. Калий (англ. Potassium, франц. Potassium, нем. Kalium) открыл в 1807 г. Г.Дэви, производивший электролиз твердого, слегка
- 21. Природные соединения калия Сильвин
- 22. Получение Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды
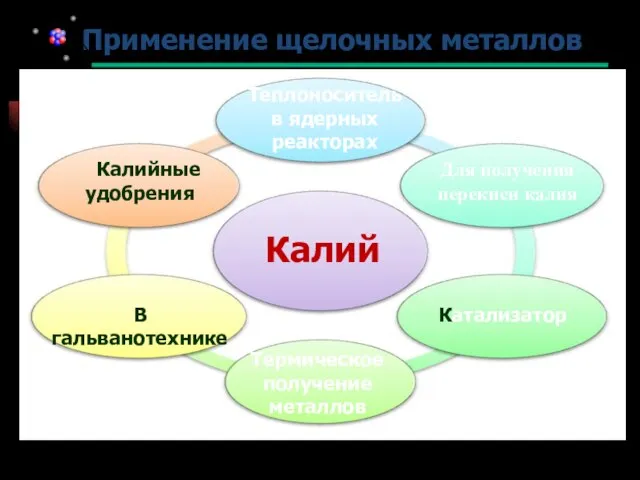
- 23. Применение щелочных металлов Калий В гальванотехнике Калийные удобрения Для получения перекиси калия Катализатор Термическое получение металлов
- 24. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 25. При спектроскопическом анализе минерала лепидолит (фторсиликат лития и алюминия) и обнаружились две новые красные линии в
- 26. Получение Большую часть добываемого рубидия получают как побочный продукт при производстве лития из лепидолита. После выделения
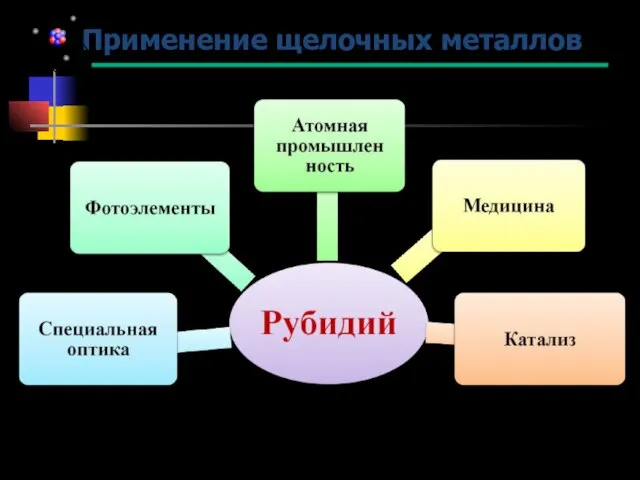
- 27. Применение щелочных металлов
- 28. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
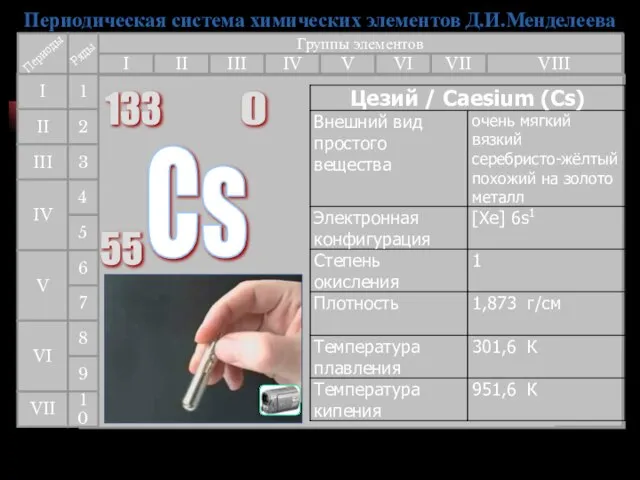
- 29. Цезий (англ. Cesium, франц. Cesium, нем. Caesium) - первый элемент, открытый с помощью спектрального анализа. Р.Бунзен
- 30. Получение Основными цезиевыми минералами являются поллуцит и очень редкий авогадрит (K,Cs)[BF4]. Кроме того, в виде примесей
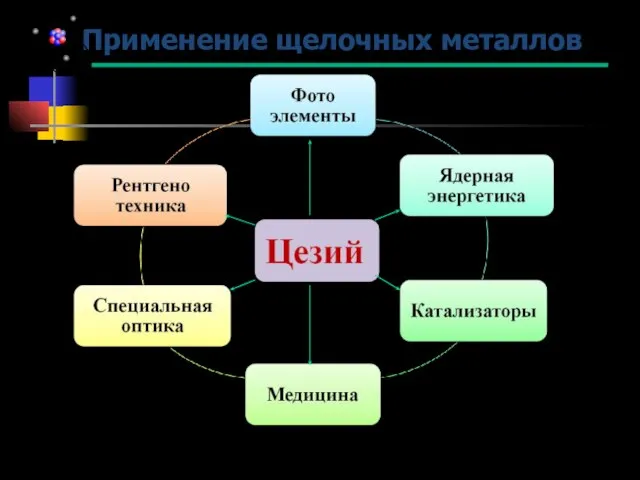
- 31. Применение щелочных металлов
- 32. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
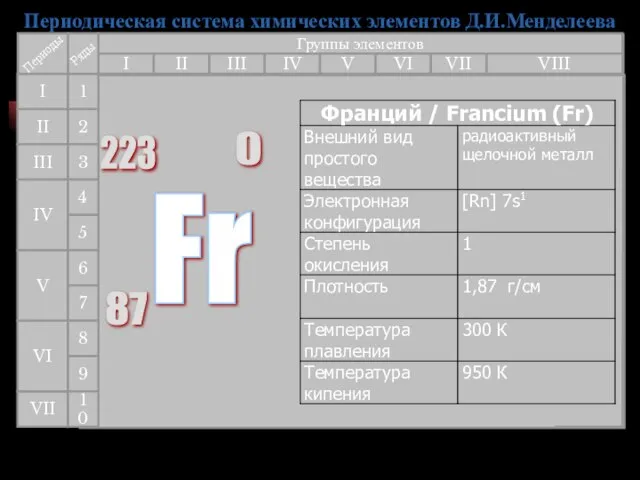
- 33. Этот элемент был предсказан Д.И.Менделеевым (как Эка-цезий), и был открыт (по его радиоактивности) в 1939 г.
- 35. Скачать презентацию






















![Получение Основными цезиевыми минералами являются поллуцит и очень редкий авогадрит (K,Cs)[BF4]. Кроме](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/276421/slide-29.jpg)

 Программирование
Программирование  Новогодняя маска
Новогодняя маска Автосервис. Описание продукта
Автосервис. Описание продукта 20171011_madagaskar_-
20171011_madagaskar_- Мультимедийная творческая студия «Стейджинг»
Мультимедийная творческая студия «Стейджинг» Органы цветковых растений
Органы цветковых растений Президент РФ в системе государственного управления
Президент РФ в системе государственного управления Мобильное телевидение в России и Беларуси прогнозы, мнения, опыт
Мобильное телевидение в России и Беларуси прогнозы, мнения, опыт Чернобыль… Черная быль…
Чернобыль… Черная быль… Физические законы,важные дляанестезиологаК.М. Лебединский, СПб МАПО
Физические законы,важные дляанестезиологаК.М. Лебединский, СПб МАПО Храмовое зодчество Византии
Храмовое зодчество Византии Н. М. Карамзин и Симбирск
Н. М. Карамзин и Симбирск Методические особенности развития физических качеств у хоккейного вратаря
Методические особенности развития физических качеств у хоккейного вратаря Презентация на тему возникновение искусства и религиозных верований 5 класс
Презентация на тему возникновение искусства и религиозных верований 5 класс Физика в живой природе
Физика в живой природе Биосфера: структура и функции
Биосфера: структура и функции Зарисовки предметов быта, имеющих призматическую форму с натуры и по памяти
Зарисовки предметов быта, имеющих призматическую форму с натуры и по памяти Патриотизм
Патриотизм This presentation has been IRM protected by policy
This presentation has been IRM protected by policy Правки по сайту Андрею
Правки по сайту Андрею Изучение английского языка в начальных классах. Обучение через игру.
Изучение английского языка в начальных классах. Обучение через игру. Стили общения
Стили общения Авторы проекта:
Авторы проекта: Базы данных в отечестве – могила, и наш ДМ ее себе роет
Базы данных в отечестве – могила, и наш ДМ ее себе роет Hausratversicherung
Hausratversicherung Масленица праздник
Масленица праздник Долгушева Анастасия
Долгушева Анастасия Формы бухгалтерского учета. Тема №11
Формы бухгалтерского учета. Тема №11