Слайд 2Закономерности броуновского движения
1905 год - А.Эйнштейн на основе МКТ разработал теорию броуновского

движения и доказал, что смещение частицы от начального положения пропорционально квадратному корню из времени.
1908 году Ж. Перрен полностью подтвердил этот теоретический результат своими наблюдениями.
Слайд 3Распределение молекул по скоростям
В 1860 году Дж. Максвелл пришел к фундаментальному выводу:

молекулы газа движутся с различными скоростями(ранее считалось, что они движутся с одинаковыми скоростями). Он также вывел закон распределения молекул газа по скоростям.
Слайд 4График распределения
Из графика видно, что большее число молекул движется со скоростью, близкой
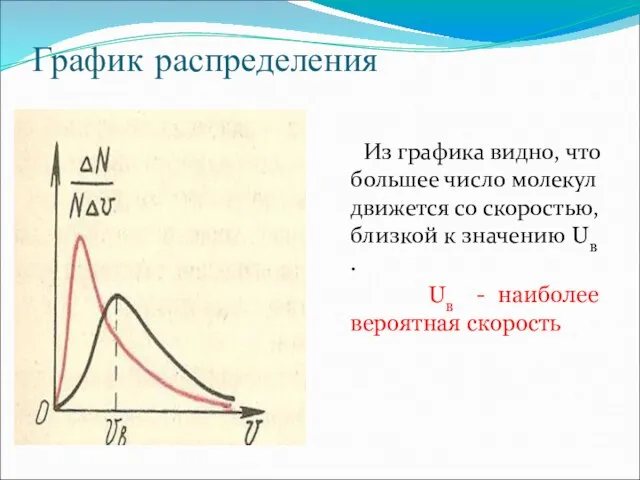
к значению Uв .
Uв - наиболее вероятная скорость
Слайд 5Свойства газов
Основу КТГ составляют положения:
Газы способны неограниченно расширяться и занимать любой предоставленный

им объем
Смесь газов оказывает на стенки сосуда давление, равное сумме давлений каждого газа взятого в отдельности (закон Дальтона)
При постоянной температуре давление данной массы газа обратно пропорционально его объему (закон Бойля-Мариотта)
При постоянном объеме давление данной массы газа линейно зависит от температуры (закон Шарля)
При постоянном давлении объем данной массы газа линейно зависит от температуры (закон Гей-Люссака)
Слайд 6Идеальный газ
М.В.Ломоносов считал, что вещества состоят из корпускул, находящихся во вращательном движении.
Д.Джоуль

в 1852 году предложил более точную модель, приписав молекулам газа поступательное движение.
В 1857 году немецкий физик Р.Клаузиус, используя модель идеального газа, впервые систематически изложил кинетическую теорию газов.
Слайд 7Модель Клаузиуса
Идеальным Клаузиус назвал газ, удовлетворяющий следующим условиям:
Объемом всех молекул газа можно

пренебречь по сравнению с объемом сосуда, в котором этот газ находится
Время столкновения молекул друг с другом пренебрежимо мало по сравнению со временем между двумя столкновениями
Молекулы взаимодействую между собой только при непосредственном соприкосновении, при этом они отталкиваются
Силы притяжения между молекулами идеального газа ничтожно малы и ими можно пренебречь
Слайд 8Давление идеального газа
Давление идеального газа равно 2/3 произведения концентрации молекул n на

среднее значение кинетической энергии хаотического поступательного движения молекул Ek
p = 1/3 nm0Ū2
= 2/3n(m0Ū2)/2 =
2/3Ēk
(уравнение Клаузиуса)
Слайд 9Решим задачу
Считая воздух идеальным газом, состоящим из одинаковых молекул, оцените скорость теплового

движения молекул газа при нормальных условиях.
Дано: Формула: Решение:
P = 1.01•105 Па U = √ Ū2 = U = √ (1,01*105)/1,29 =
= 280 м/с
= √ 3p/ρ
ρ = 1,29 кг•м-3
Слайд 10Домашнее задание:
Учебник стр. 72-79 §14,15
Разобрать примеры решения задач
Решить задачи № 15.1,

15.4, 15.5 (стр. 80)










 Легенда о Змеиной горе
Легенда о Змеиной горе Обучение защитным действиям в баскетболе
Обучение защитным действиям в баскетболе Страдательные причастия настоящего времени
Страдательные причастия настоящего времени Повышение качества преподавания математики, информатики
Повышение качества преподавания математики, информатики Вакансии банка Открытие
Вакансии банка Открытие ПРОДВИЖЕНИЕ В ПОИСКОВЫХ СИСТЕМАХ Роскошь или эффективное средство развития бизнеса? Реалии современного Рунета
ПРОДВИЖЕНИЕ В ПОИСКОВЫХ СИСТЕМАХ Роскошь или эффективное средство развития бизнеса? Реалии современного Рунета Высокотехнологичные методы лечения ревматоидного артритаКардиологический диспансерИлюшина Лариса Викторовнаг. Сыктывкар
Высокотехнологичные методы лечения ревматоидного артритаКардиологический диспансерИлюшина Лариса Викторовнаг. Сыктывкар Ятрогенные преступления
Ятрогенные преступления МЁД «Лесные Угодья»
МЁД «Лесные Угодья» Бог и человек
Бог и человек Вторжение на советскую землю началось На улицах осажденного Ленинграда.
Вторжение на советскую землю началось На улицах осажденного Ленинграда. Презентация на тему Переживания, испытанные временем (4 класс)
Презентация на тему Переживания, испытанные временем (4 класс) Кейс из Курска. Из местной компании в международную франшизу за 3 года
Кейс из Курска. Из местной компании в международную франшизу за 3 года Методы хроматографии. Ионообменная хроматография
Методы хроматографии. Ионообменная хроматография Методикаразработки административных регламентов предоставления государственных услуг и административных регламентов исполнен
Методикаразработки административных регламентов предоставления государственных услуг и административных регламентов исполнен Народное творчество
Народное творчество Рунические миры Свартальфхейм
Рунические миры Свартальфхейм ЭКСПЕРТНАЯ СИСТЕМА FILTEX32 ДЛЯ АВТОМАТИЗИРОВАННОГО ПРОЕКТИРОВАНИЯ ПОЛОСНО-ПРОПУСКАЮЩИХ МИКРОПОЛОСКОВЫХ ФИЛЬТРОВ Беляев Б.А., Б
ЭКСПЕРТНАЯ СИСТЕМА FILTEX32 ДЛЯ АВТОМАТИЗИРОВАННОГО ПРОЕКТИРОВАНИЯ ПОЛОСНО-ПРОПУСКАЮЩИХ МИКРОПОЛОСКОВЫХ ФИЛЬТРОВ Беляев Б.А., Б Когда появилась одежда?
Когда появилась одежда? 20171028_trudovye_resursy._rynok_truda
20171028_trudovye_resursy._rynok_truda Планета Юпитер
Планета Юпитер Презентация на тему Перпендикуляр и наклонная
Презентация на тему Перпендикуляр и наклонная  Таня Савичева
Таня Савичева Токарный станок и режущий инструмент
Токарный станок и режущий инструмент  Атмосферные фронты. Циклоны и антициклоны 8 класс
Атмосферные фронты. Циклоны и антициклоны 8 класс За нами – Москва! 7 класс
За нами – Москва! 7 класс Оформление изделий в технике Декупаж
Оформление изделий в технике Декупаж Контактная сеть
Контактная сеть