Содержание
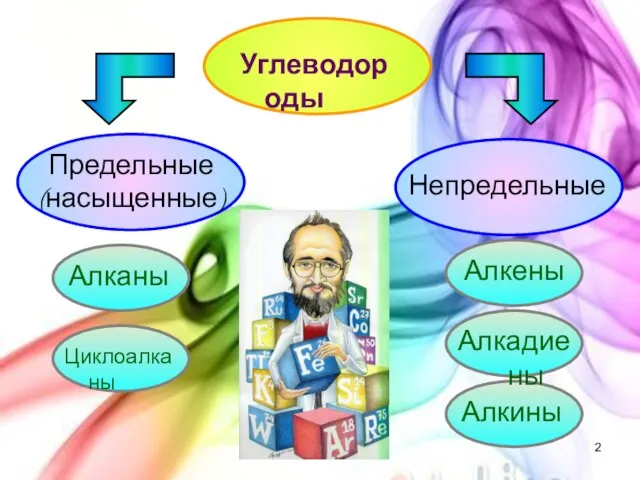
- 2. Углеводороды Предельные (насыщенные) Непредельные Алканы Циклоалканы Алкены Алкадиены Алкины
- 3. Алканы (парафины) К алканам (парафинам) относятся соединения с открытой цепью, в которых атомы углерода соединены друг
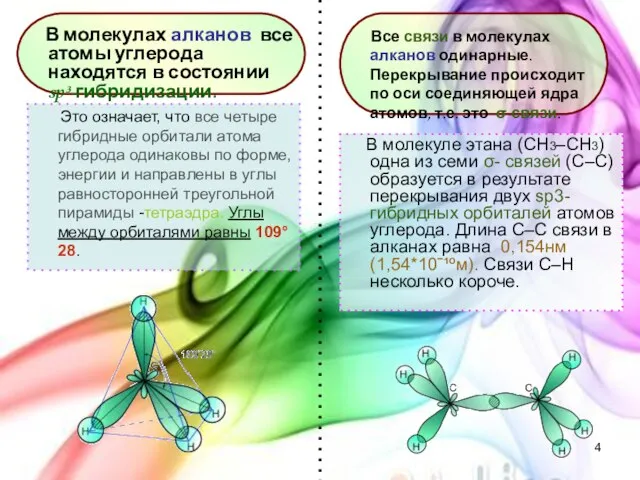
- 4. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в
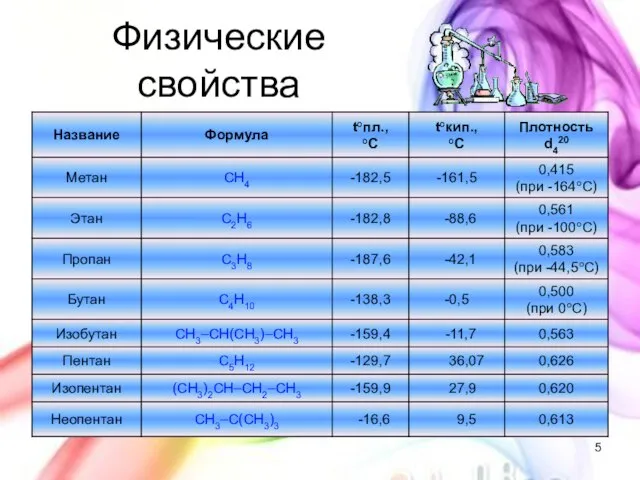
- 5. Физические свойства
- 6. Химические свойства Реакции замещения: Галогенирование: CH4+ Cl2 →CH3Cl +HCl Дегидрирование (отщепление водорода):CH3–CH3 → CH2 ═ CH2
- 7. Применение Первый в ряду алканов – метан – является основным компонентом природных и попутных газов и
- 8. Циклоалканы (циклопарафины) Общая формула CnH2n В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют
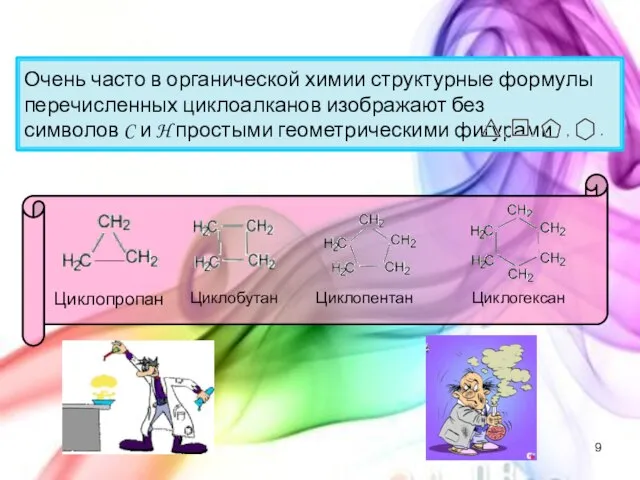
- 9. Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми
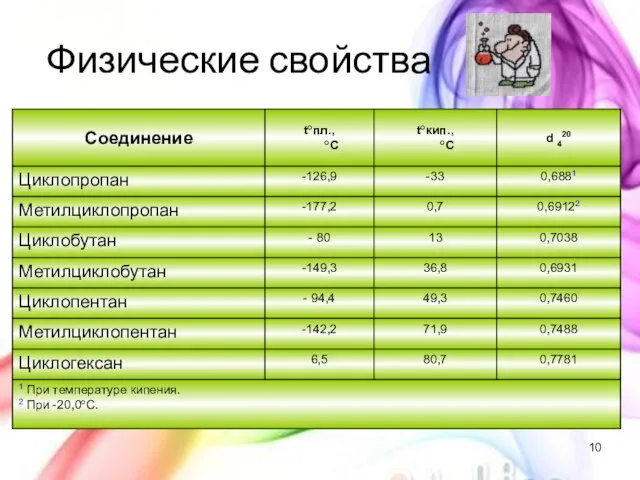
- 10. Физические свойства
- 11. Химические свойства Гидрирование: Галогенирование: Гидрогалогенирование: Дегидрирование: (циклопропан) + H2 ––120ºC,Ni® CH3–CH2–CH3(пропан) + Br2 ® BrCH2–CH2–CH2Br (1,3-
- 12. Применение Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама,
- 13. Алкены Общая формула CnH2n Алкенами или олефинами, или этиленовыми углеводородами называются углеводороды, содержащие в молекуле одну
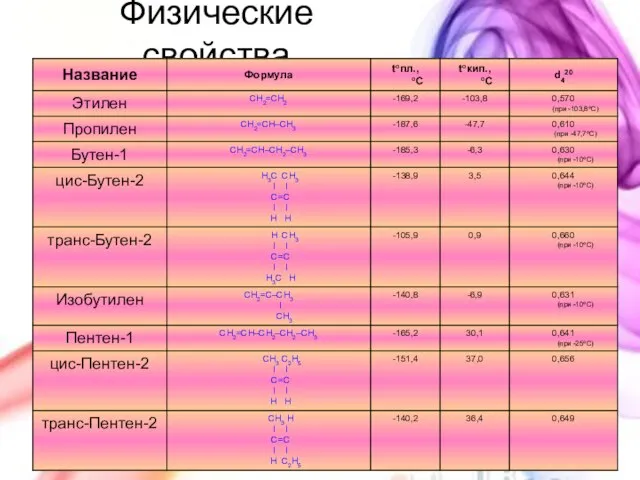
- 14. Физические свойства
- 15. Химические свойства Галогенирование: H2C=CH2 + Br2 → BrCH2–CH2Br (1,2-дибромэтан) Гидрирование: CH3–CH=CH2 + H2 ––Ni→ CH3–CH2–CH3 (пропан)
- 16. Применение Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры
- 17. Диеновые углеводороды (Алкадиены) Непредельные Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод
- 18. В зависимости от взаимного расположения двойных связей диены подразделяются на три типа: 1) углеводороды с кумулированными
- 19. Физические свойства Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C; растворяется
- 20. Алкины Общая формула CnH2n-2 Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную
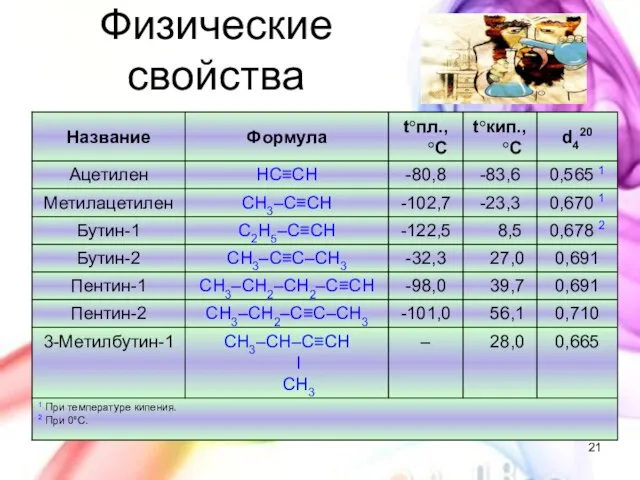
- 21. Физические свойства
- 22. Химические свойства Реакции присоединения: Гидрирование: Галогенирование: Гидрогалогенирование: Тримеризация : 3HC≡CH → С6 Н6 (бензол) CH3–C≡CH (пропин)
- 23. Применение При горении ацетилена в кислороде температура пламени достигает 3150°C, поэтому ацетилен используют для резки и
- 25. Скачать презентацию















 Отдельные виды договорных отношений в жилищном праве
Отдельные виды договорных отношений в жилищном праве Организация велостоянки для гимназии №1
Организация велостоянки для гимназии №1 О компании Основным направлением деятельности группы компаний InstaForex является предоставление услуг online-трейдинга клиентам с 2007 го
О компании Основным направлением деятельности группы компаний InstaForex является предоставление услуг online-трейдинга клиентам с 2007 го Урок русского языка в 6 классе по теме: «Правописание сложных существительных»
Урок русского языка в 6 классе по теме: «Правописание сложных существительных» Ярмарка инноваций в образовании Секция: Инновации в дошкольном образовании
Ярмарка инноваций в образовании Секция: Инновации в дошкольном образовании Невидимые нити в весеннем лесу (2 класс)
Невидимые нити в весеннем лесу (2 класс) Игрушки из носочков своими руками №7
Игрушки из носочков своими руками №7 Введение в специальность
Введение в специальность Герцог Ами
Герцог Ами Трение. Вредно или полезно
Трение. Вредно или полезно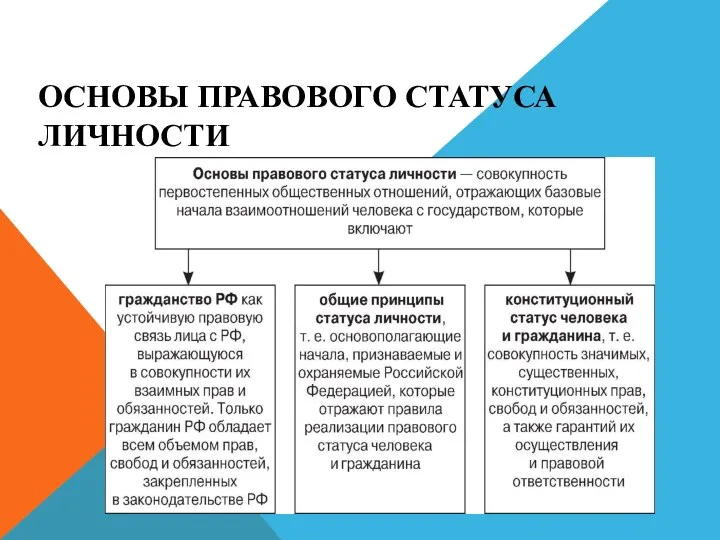 Правовой статус личности. Гражданство РФ
Правовой статус личности. Гражданство РФ Социальная психология
Социальная психология Презентация на тему АФАНАСИЙ НИКИТИН
Презентация на тему АФАНАСИЙ НИКИТИН  Теория обучения
Теория обучения Презентация на тему Our Environment (Наша окружающая среда)
Презентация на тему Our Environment (Наша окружающая среда) Универсальный программный комплекс для информационно-аналитического сопровождения (УПК ИАС)
Универсальный программный комплекс для информационно-аналитического сопровождения (УПК ИАС) Презентация по информатике на тему: «Устройства вывода информации, монитор.»
Презентация по информатике на тему: «Устройства вывода информации, монитор.» Круглопольское сельское поселение
Круглопольское сельское поселение Прайс косметологических услуг салона Забота о вас
Прайс косметологических услуг салона Забота о вас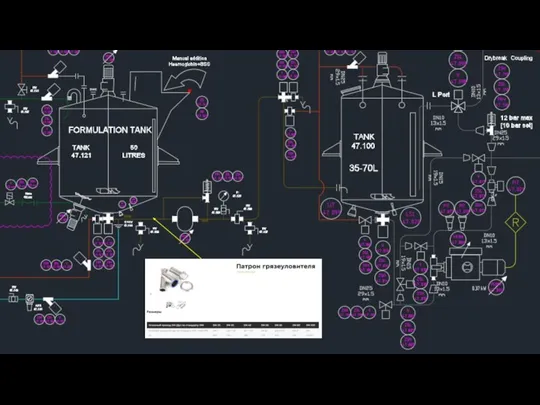 Патрон грязеуловителя
Патрон грязеуловителя Назначение изделия и его описание
Назначение изделия и его описание Планирование и организация процесса закупок материальных ресурсов промышленного предприятия
Планирование и организация процесса закупок материальных ресурсов промышленного предприятия Распространение объектно-ориентированного подхода на информационную безопасность
Распространение объектно-ориентированного подхода на информационную безопасность Определите тему произведения по моделям Дмитрий Наркисович Мамин - Сибиряк.
Определите тему произведения по моделям Дмитрий Наркисович Мамин - Сибиряк. Пейзаж в графике
Пейзаж в графике Рогожка. Коллекция однотонных штор
Рогожка. Коллекция однотонных штор _Презентация. Предоставление
_Презентация. Предоставление Презентация
Презентация