Содержание
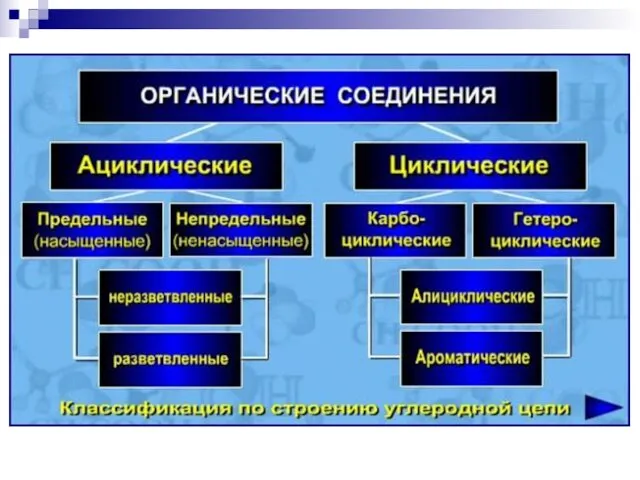
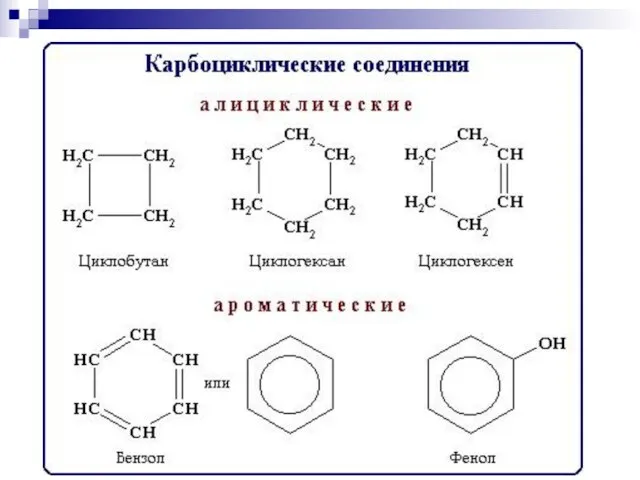
- 2. БИООРГАНИЧЕСКАЯ ХИМИЯ изучает строение и свойства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием
- 3. «Целью курса «Биоорганическая химия», как учебной дисциплины, является формирование знаний взаимосвязи строения и химических свойств биологически
- 4. « Конечная цель изучения курса «Биоорганическая химия» в медицинских вузах состоит в формировании системных знаний о
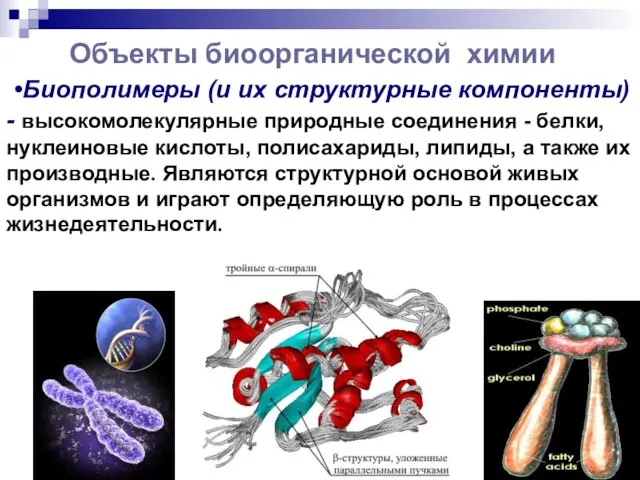
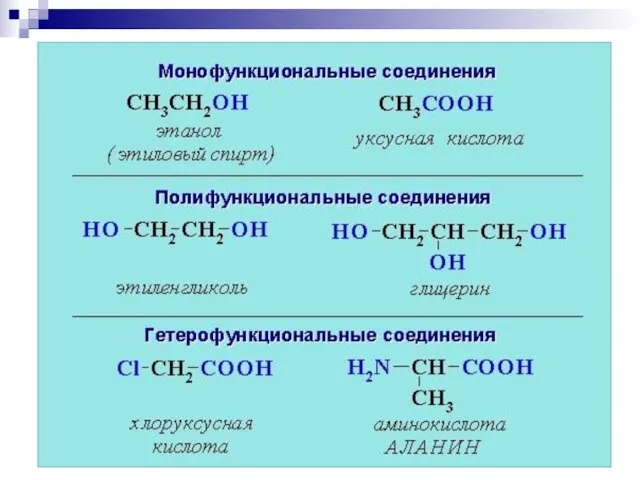
- 5. Объекты биоорганической химии •Биополимеры (и их структурные компоненты) - высокомолекулярные природные соединения - белки, нуклеиновые кислоты,
- 6. •Биорегуляторы—природные вещества, обладающие биорегулирующей векторностью (терпеноиды,стероиды,витамины,алкалоиды, простагландины,флавоноиды и др.). •Метаболиты—промежуточные продукты обмена веществ в живых клетках.
- 7. «Жизнь – это особая форма существования биополимерных тел (систем), характеризующихся хиральной чистотой и способностью к самоорганизации
- 8. “Натура тем паче всего удивительна, что в простоте своей многохитростна и от малого числа причин производит
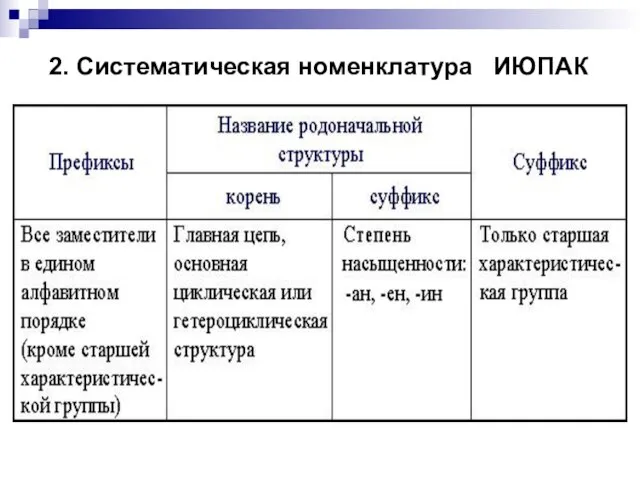
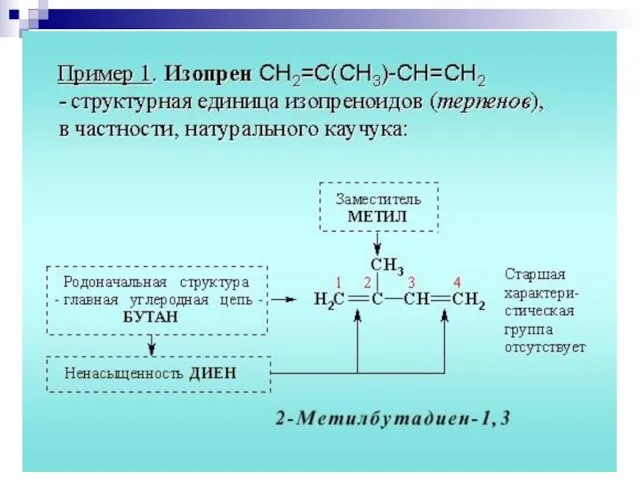
- 9. 2. Систематическая номенклатура ИЮПАК
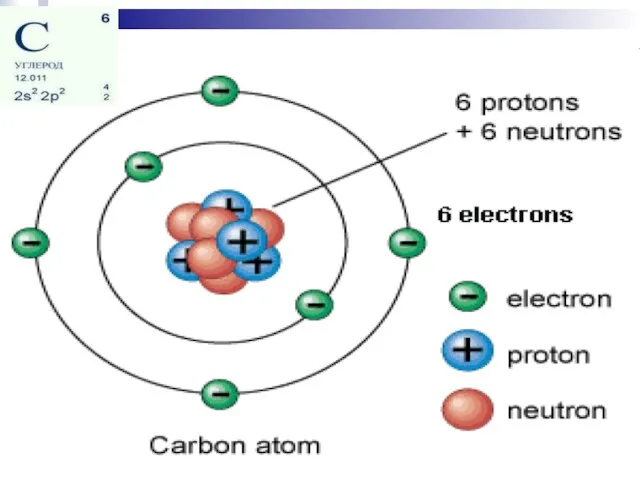
- 11. СТРОЕНие АТОМА
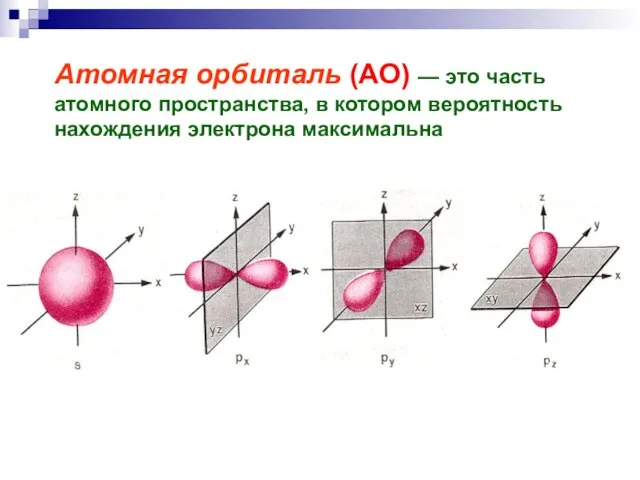
- 13. Атомная орбиталь (АО) — это часть атомного пространства, в котором вероятность нахождения электрона максимальна
- 14. Правило Хунда (Гунда): Орбитали данного подуровня заполняются сначала по одному электрону. Правило Паули: на орбитали могут
- 15. Электронный паспорт Р15 15 Фосфор P 30,974 3s23p3
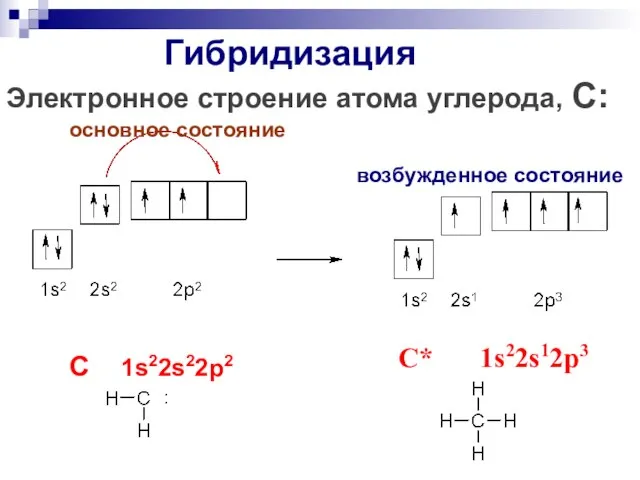
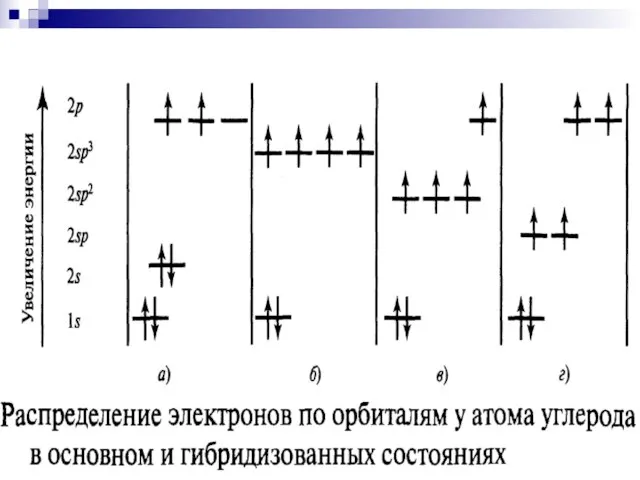
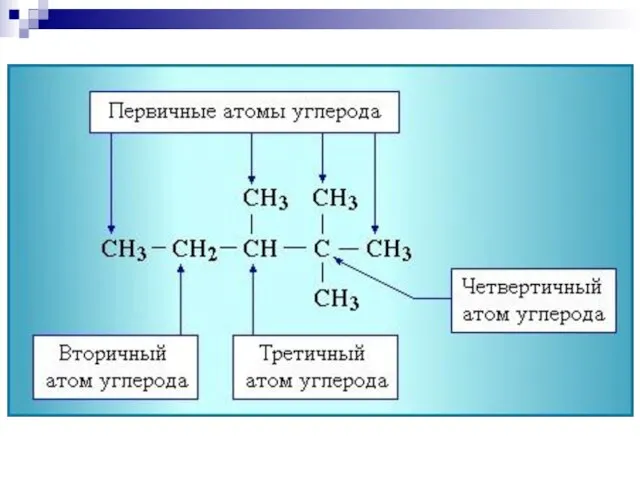
- 16. Гибридизация Электронное строение атома углерода, С: основное состояние возбужденное состояние C 1s22s22p2 C* 1s22s12p3
- 17. . Гибридизация - смешивание волновых функций различных валентных электронов атома, в результате которого волновые функции всех
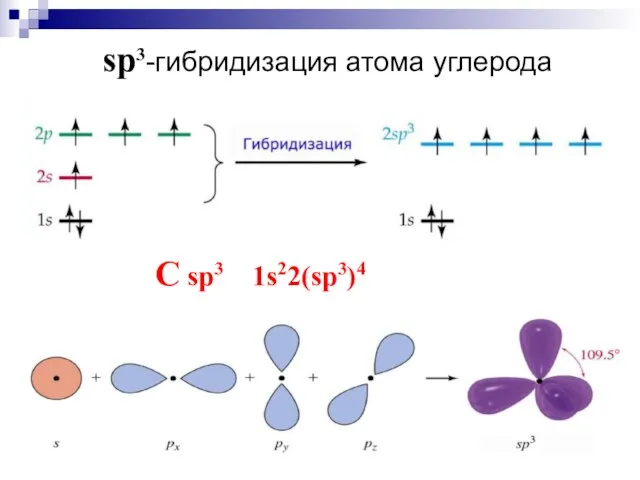
- 18. sp3-гибридизация атома углерода C sp3 1s22(sp3)4
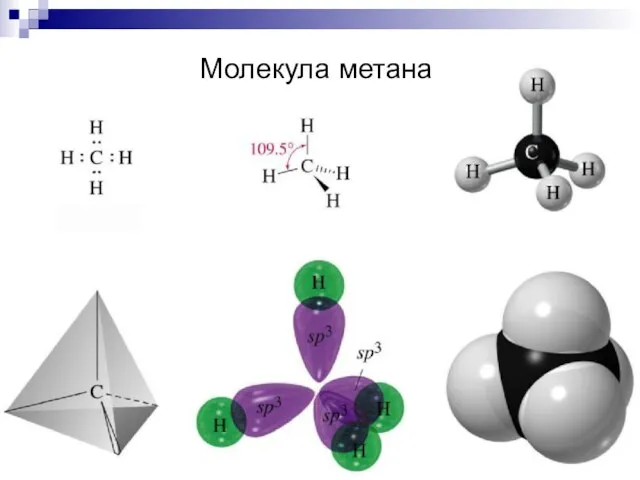
- 19. Молекула метана
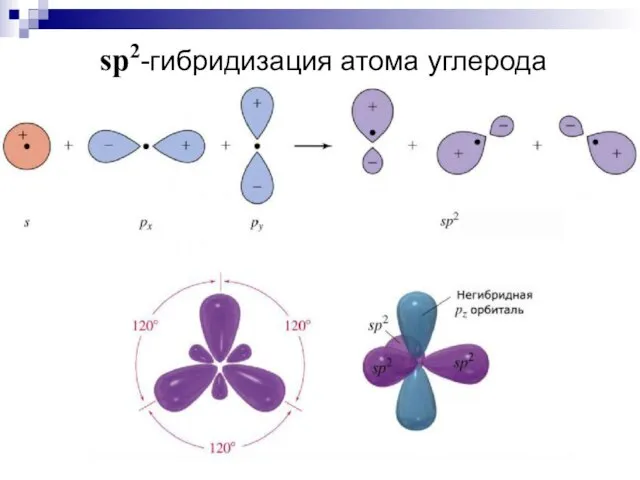
- 20. sp2-гибридизация атома углерода
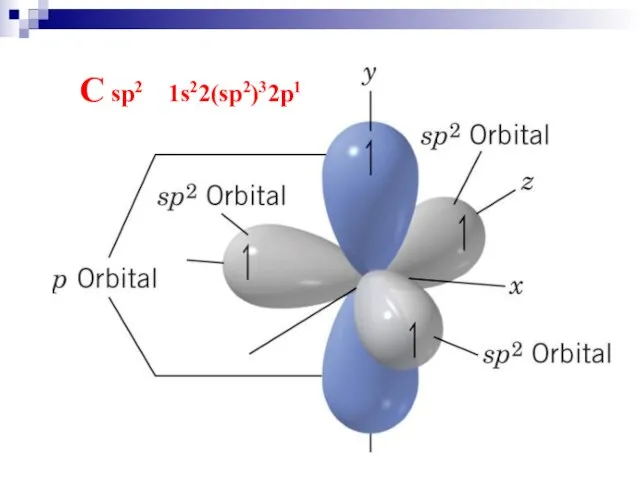
- 21. C sp2 1s22(sp2)32p1
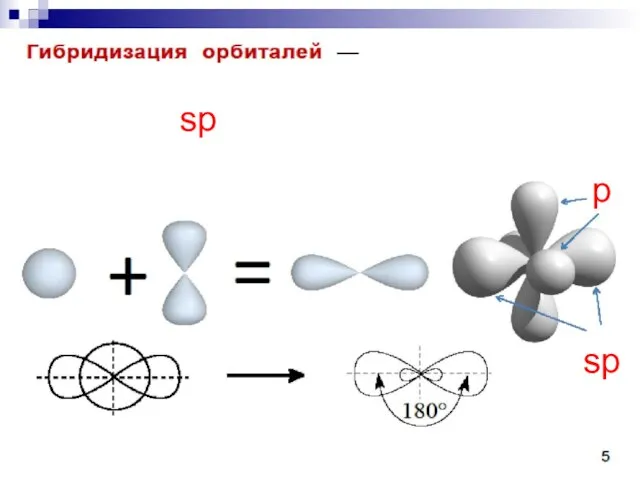
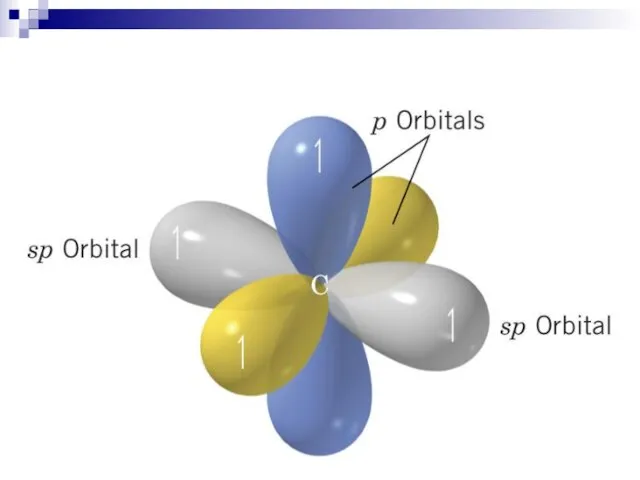
- 22. sp sp p
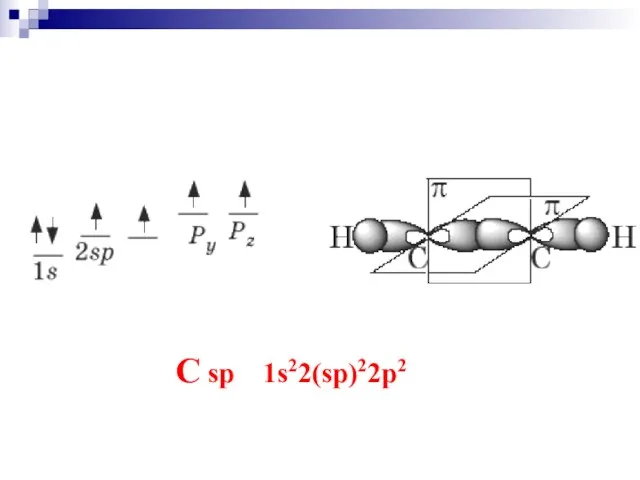
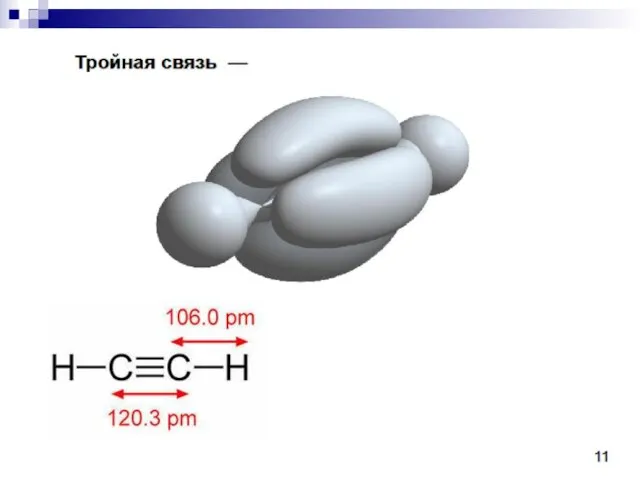
- 23. C sp 1s22(sp)22p2
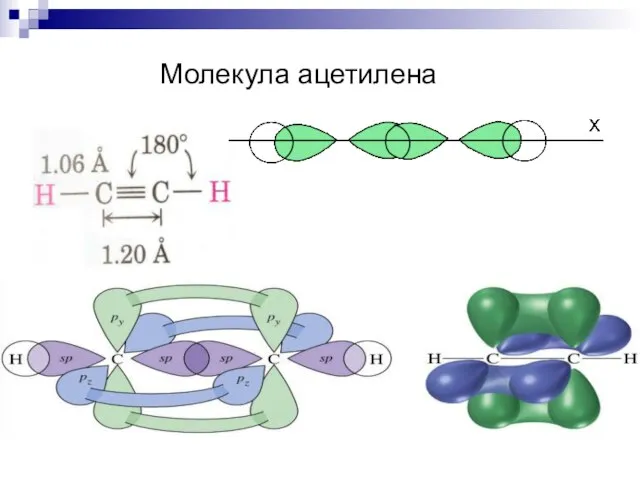
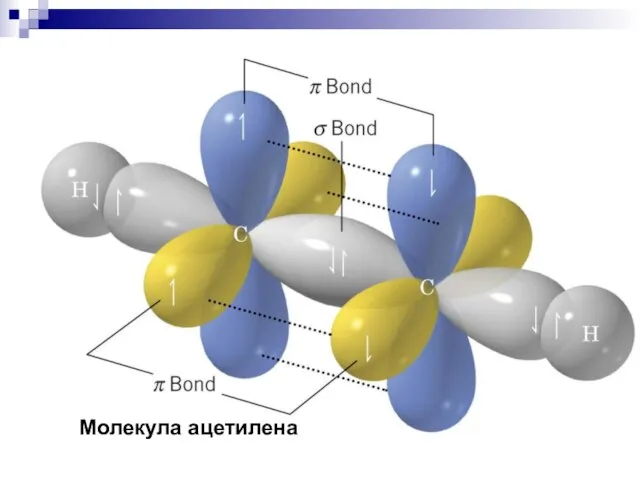
- 25. Молекула ацетилена
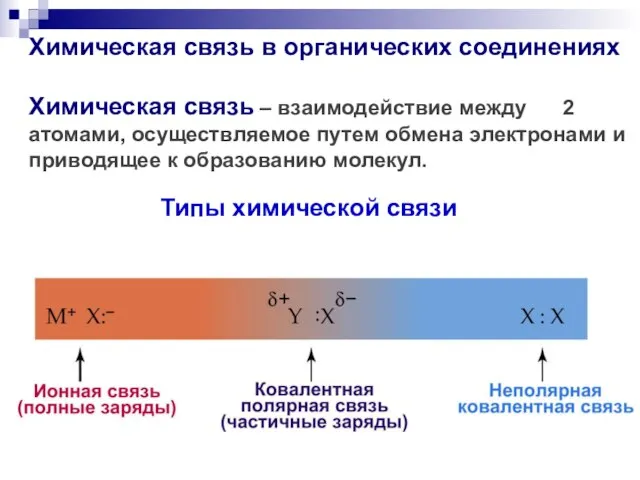
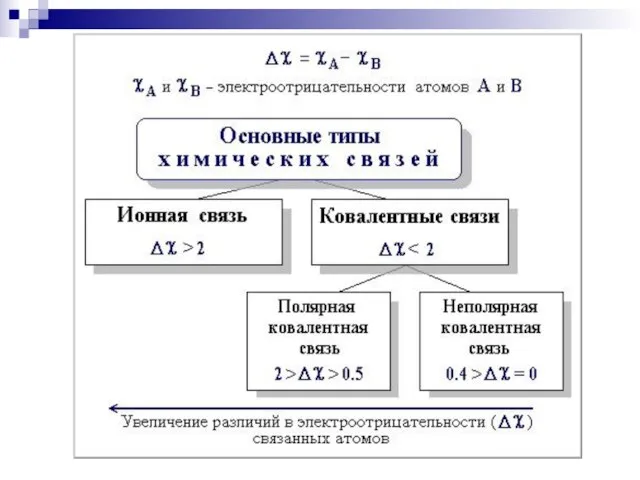
- 27. Химическая связь в органических соединениях Химическая связь – взаимодействие между 2 атомами, осуществляемое путем обмена электронами
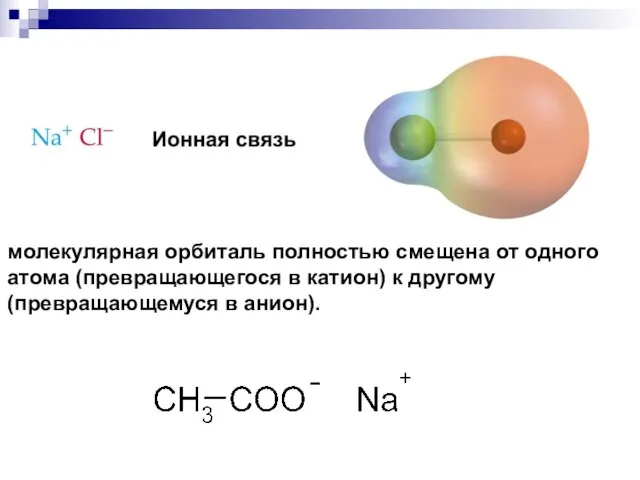
- 29. молекулярная орбиталь полностью смещена от одного атома (превращающегося в катион) к другому (превращающемуся в анион).
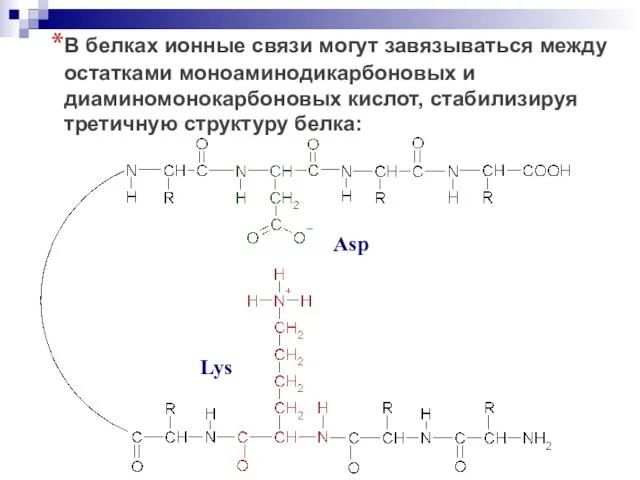
- 30. В белках ионные связи могут завязываться между остатками моноаминодикарбоновых и диаминомонокарбоновых кислот, стабилизируя третичную структуру белка:
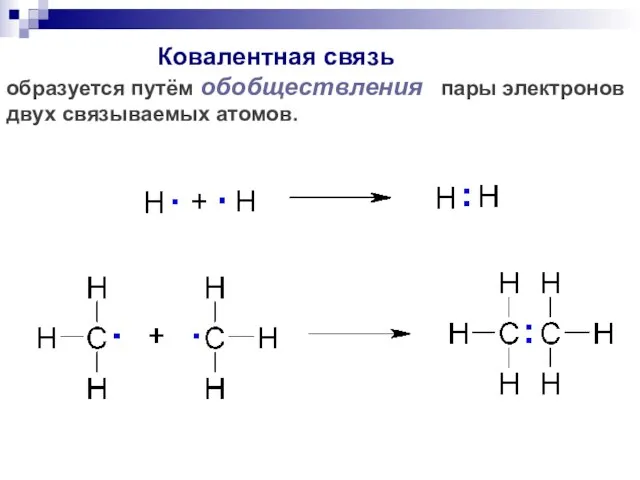
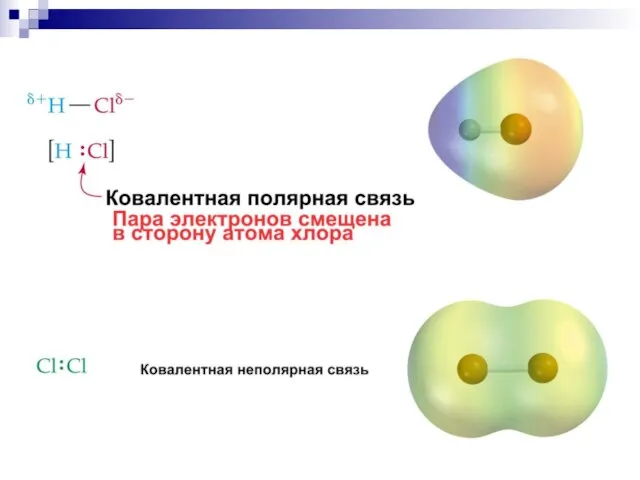
- 31. Ковалентная связь образуется путём обобществления пары электронов двух связываемых атомов.
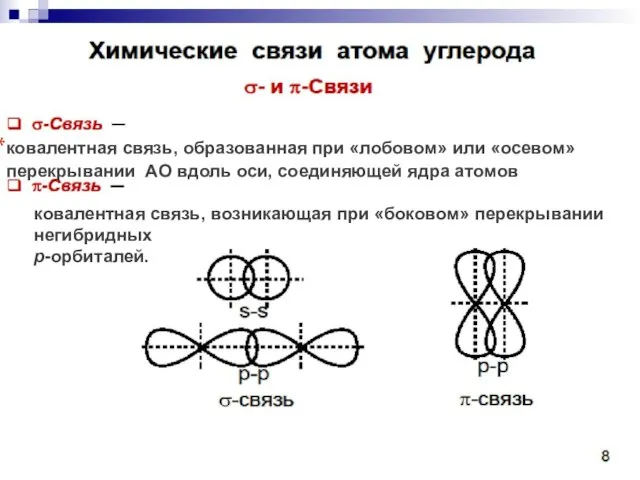
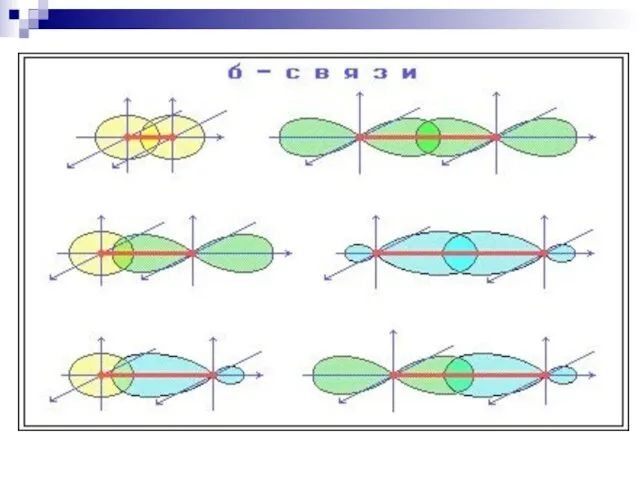
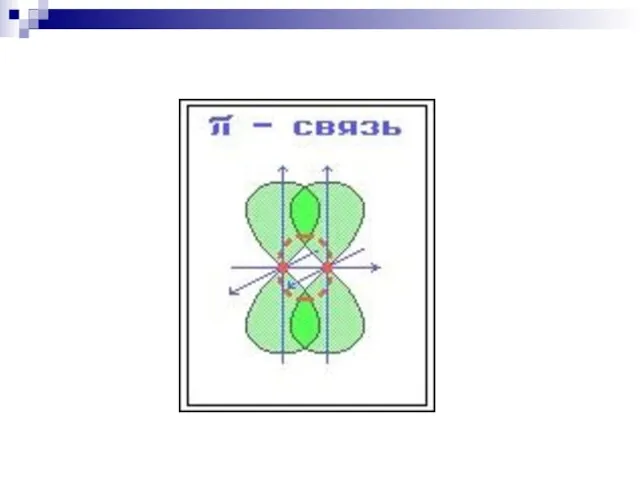
- 34. ковалентная связь, образованная при «лобовом» или «осевом» перекрывании АО вдоль оси, соединяющей ядра атомов ковалентная связь,
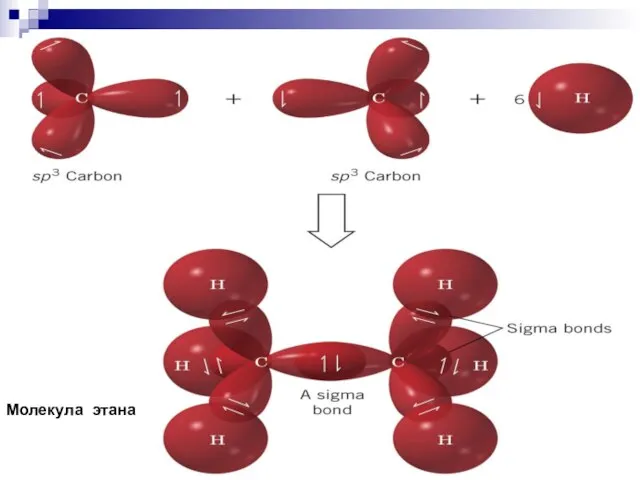
- 36. Молекула этана
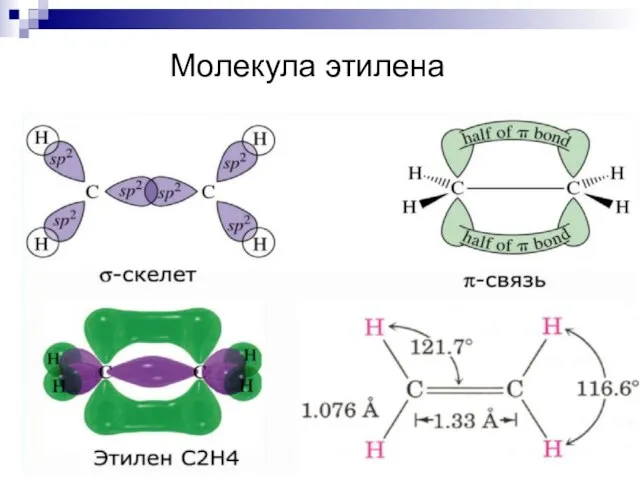
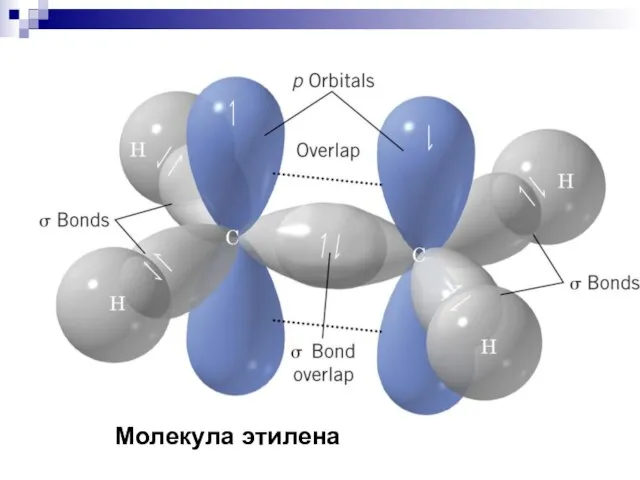
- 38. Молекула этилена
- 39. Молекула этилена
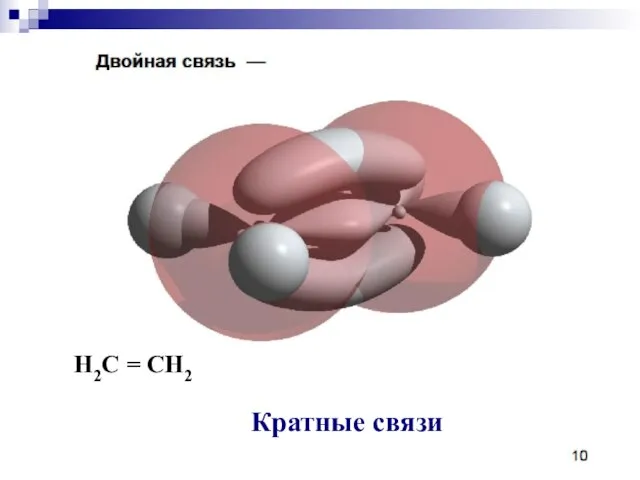
- 40. Кратные связи H2C = CH2
- 41. Молекула ацетилена
- 43. Характеристики ковалентных связей Ι. Энергия связи ΙΙ. Длина связи ΙΙΙ. Полярность IV. Поляризуемость Ι. ΙΙ.
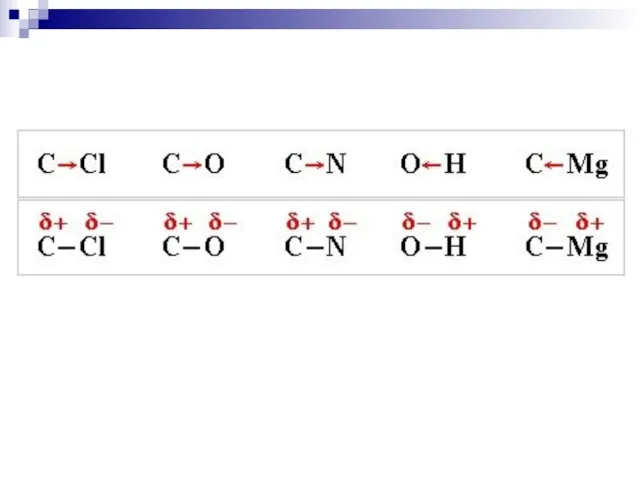
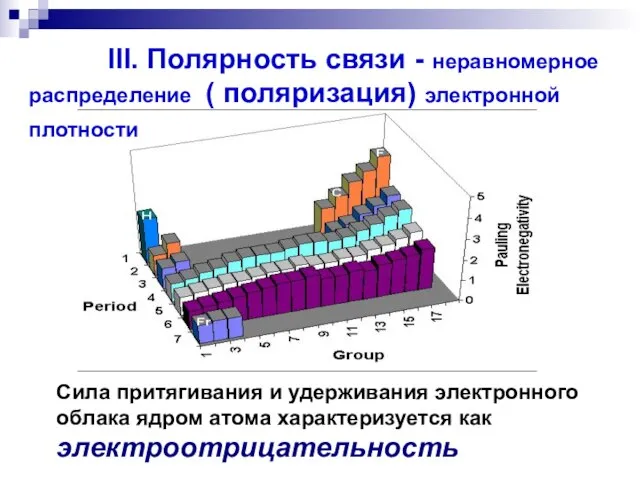
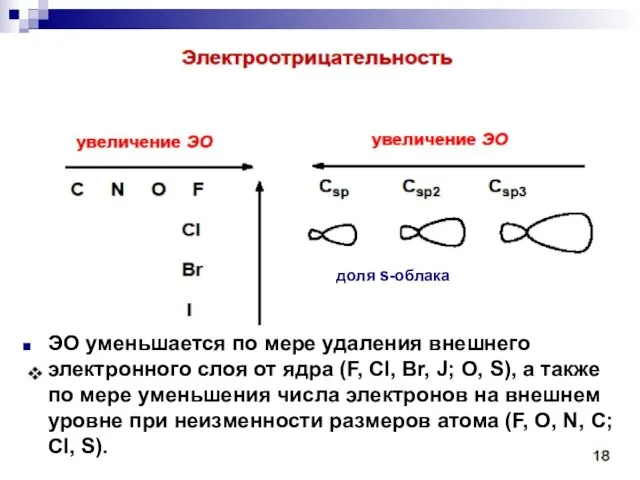
- 44. Сила притягивания и удерживания электронного облака ядром атома характеризуется как электроотрицательность III. Полярность связи - неравномерное
- 45. доля s-облака ЭО уменьшается по мере удаления внешнего электронного слоя от ядра (F, Cl, Br, J;
- 46. Шкала электроотрицательности по Полингу: F O Cl, N Br J C,
- 48. IV. Поляризуемость Ковалентная связь обладает поляризуемостью — способностью смещать электроны связи под влиянием внешнего электрического поля.
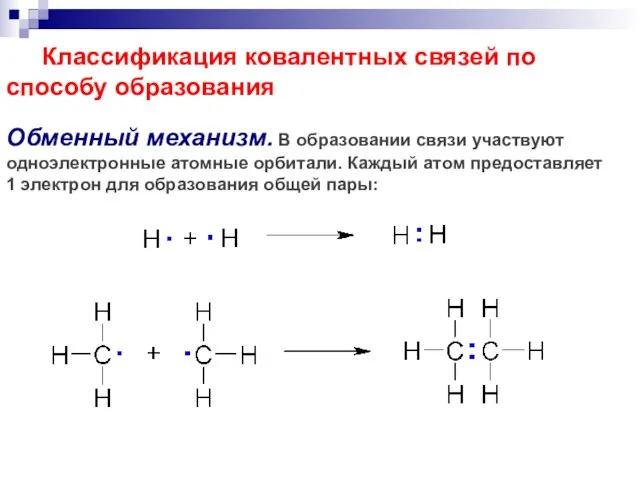
- 49. Классификация ковалентных связей по способу образования Обменный механизм. В образовании связи участвуют одноэлектронные атомные орбитали. Каждый
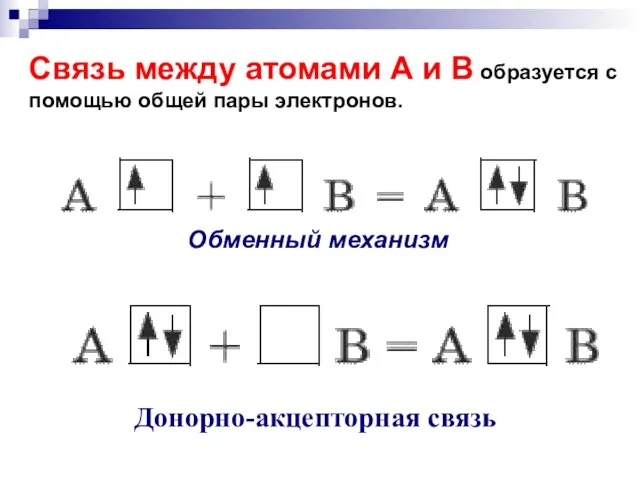
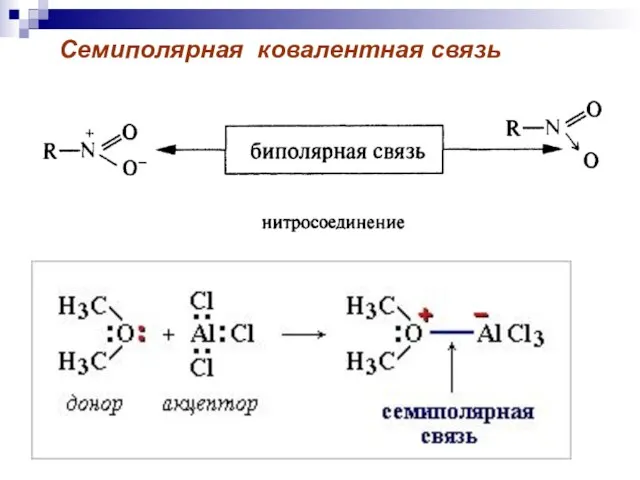
- 50. Связь между атомами А и В образуется с помощью общей пары электронов. Донорно-акцепторная связь Обменный механизм
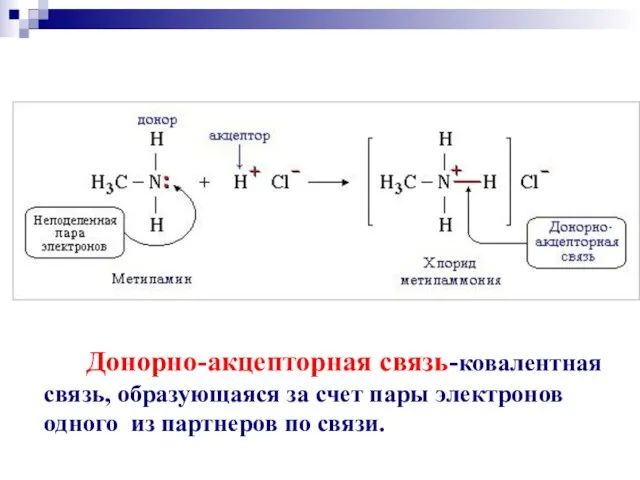
- 51. Донорно-акцепторная связь-ковалентная связь, образующаяся за счет пары электронов одного из партнеров по связи.
- 52. Семиполярная ковалентная связь
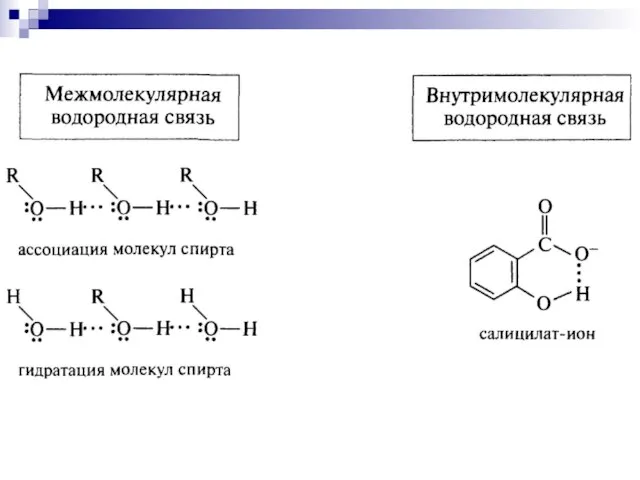
- 53. Водородная связь – притяжение протонизированного атома водорода, присоединённого к атому электроотрицательного элемента, к любому другому атому,
- 54. Водородная связь
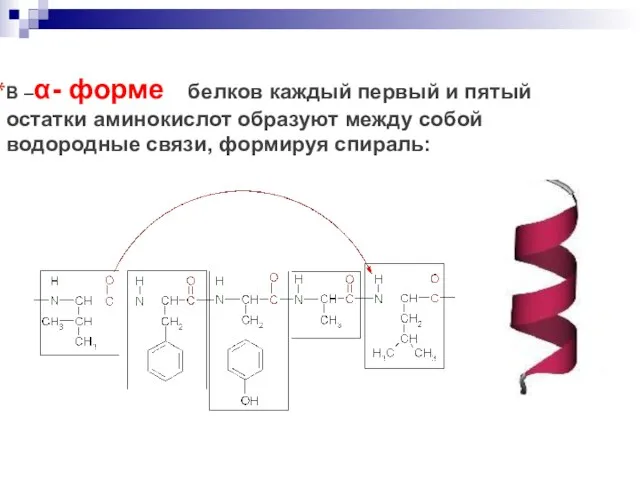
- 56. В –α- форме белков каждый первый и пятый остатки аминокислот образуют между собой водородные связи, формируя
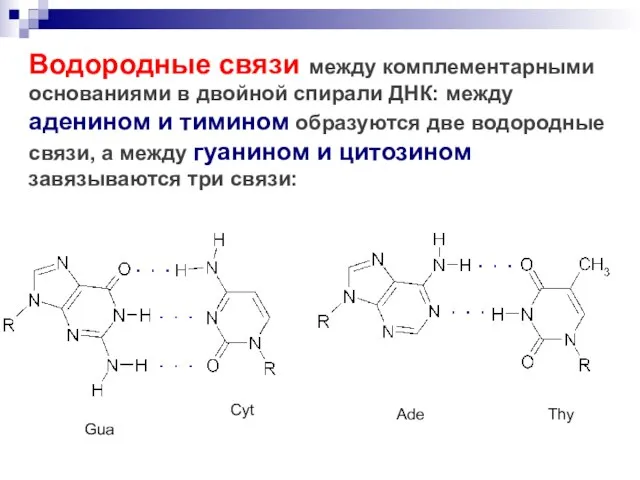
- 57. Водородные связи между комплементарными основаниями в двойной спирали ДНК: между аденином и тимином образуются две водородные
- 58. Локализованной, двухцентровой, называется двойная связь, в которой электронная плотность -связи охватывает только два ядра связываемых атомов.
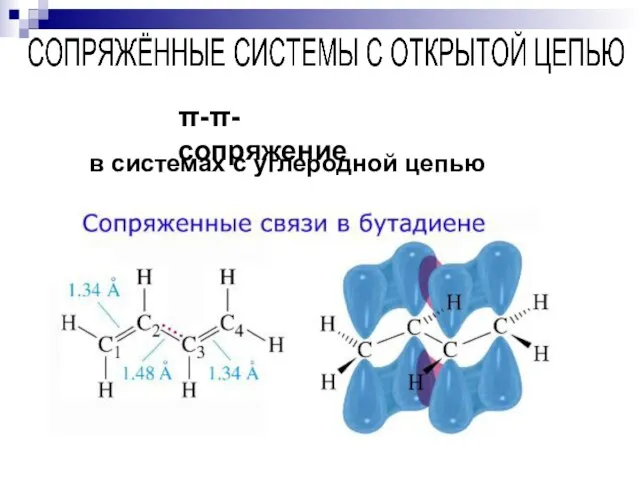
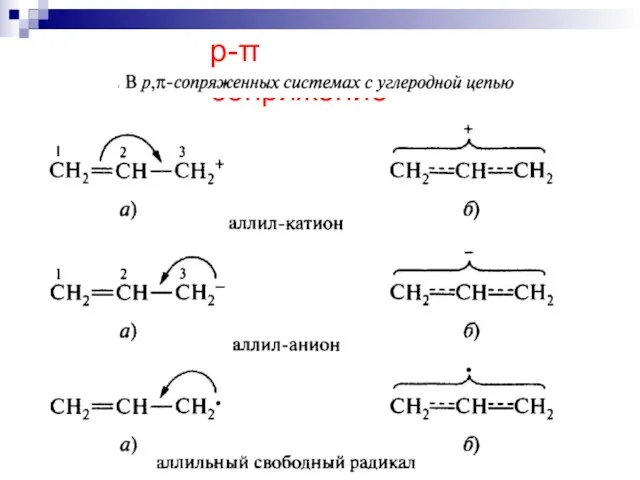
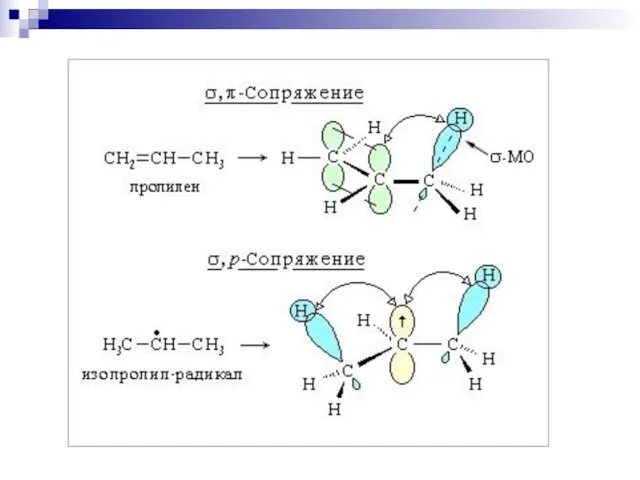
- 61. --сопряжение в системах с углеродной цепью
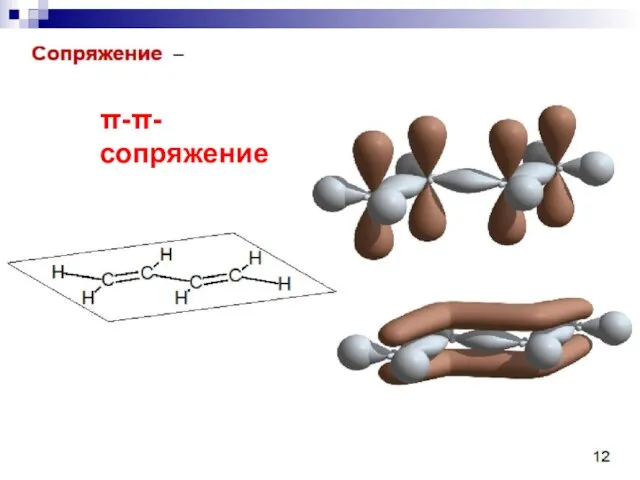
- 62. --сопряжение
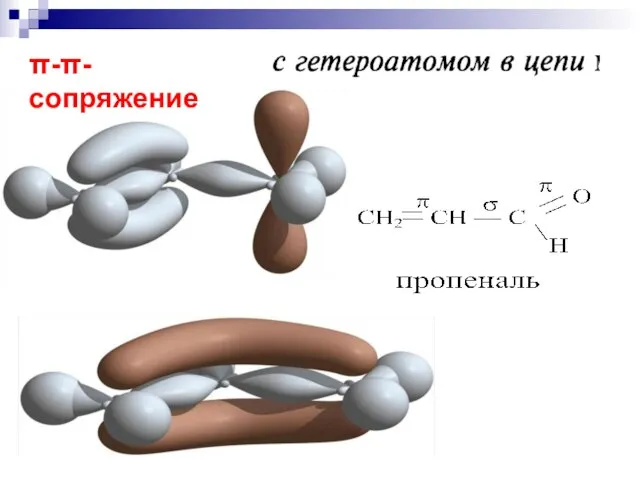
- 63. --сопряжение
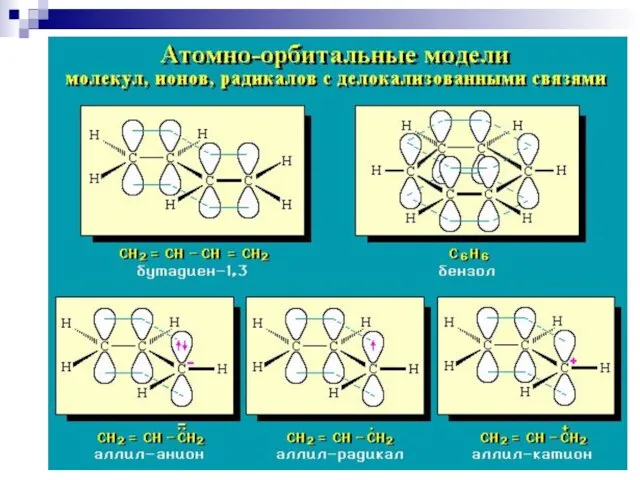
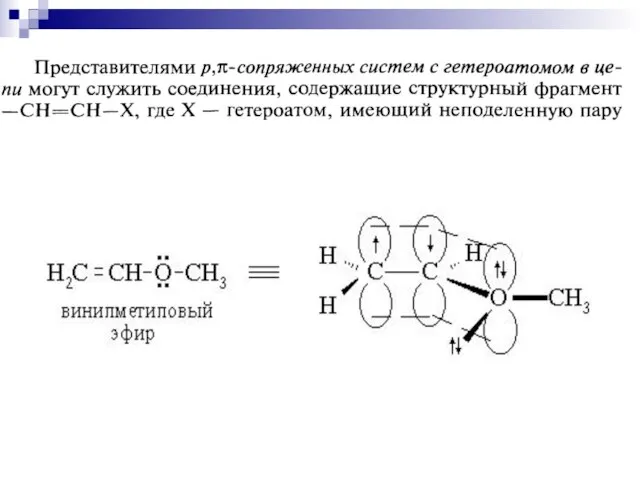
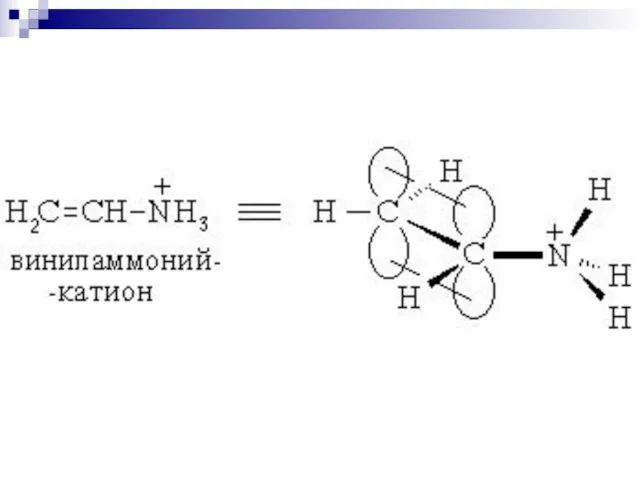
- 64. р- сопряжение
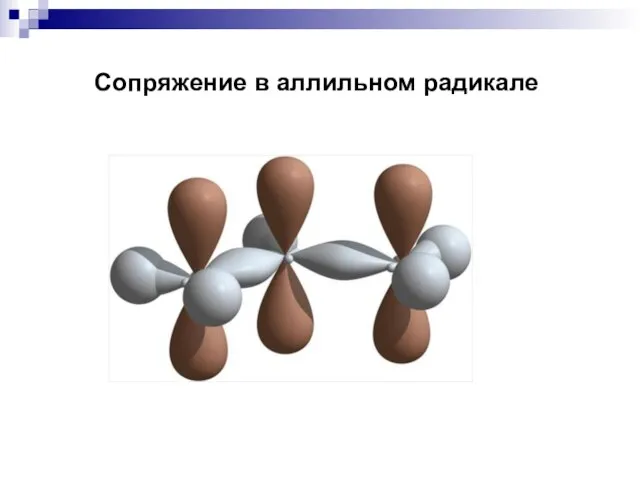
- 66. Сопряжение в аллильном радикале
- 68. Теория резонанса. Распределение электронов в молекулах (в том числе сложных ионах или радикалах), является комбинацией (резонансом)
- 72. Мезомерный эффект (эффект сопряжения)
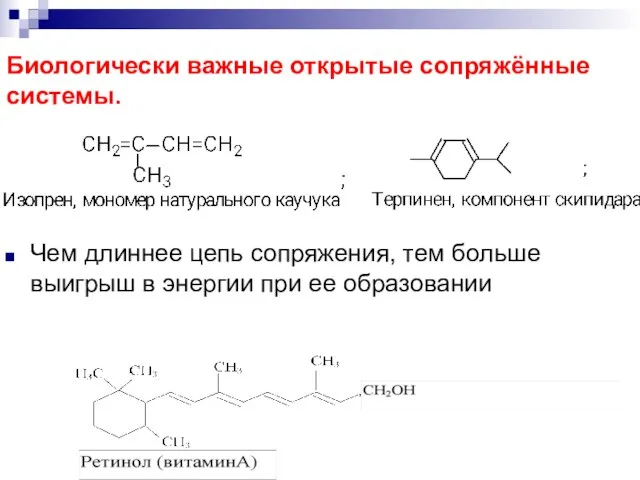
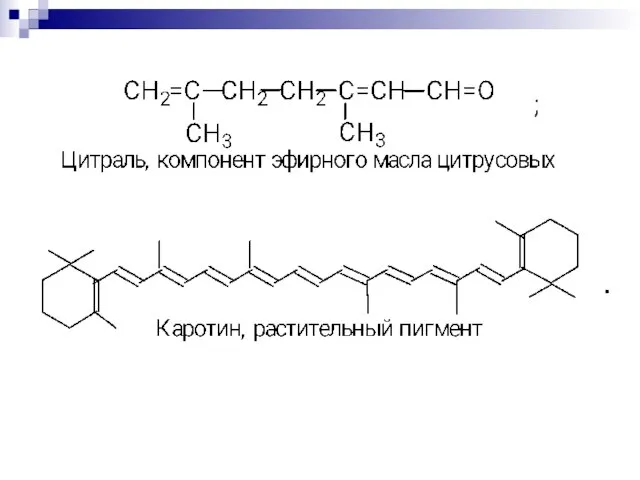
- 73. Биологически важные открытые сопряжённые системы. Чем длиннее цепь сопряжения, тем больше выигрыш в энергии при ее
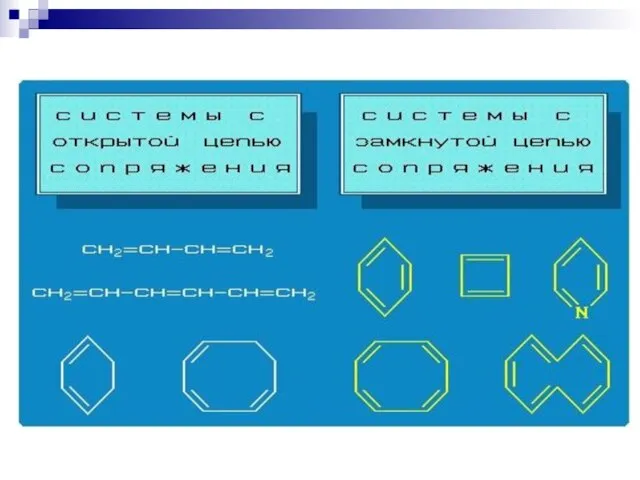
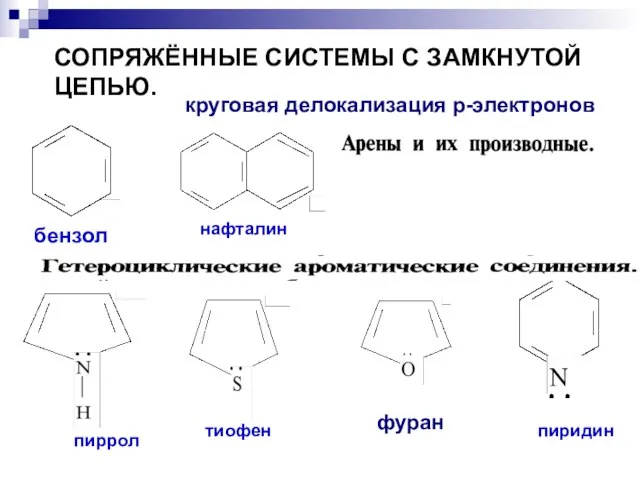
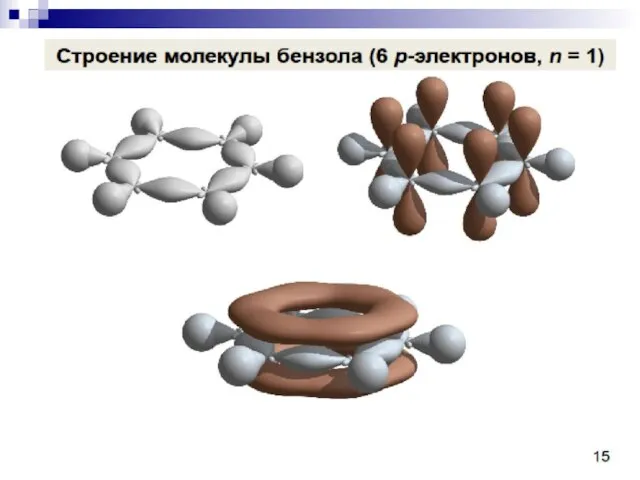
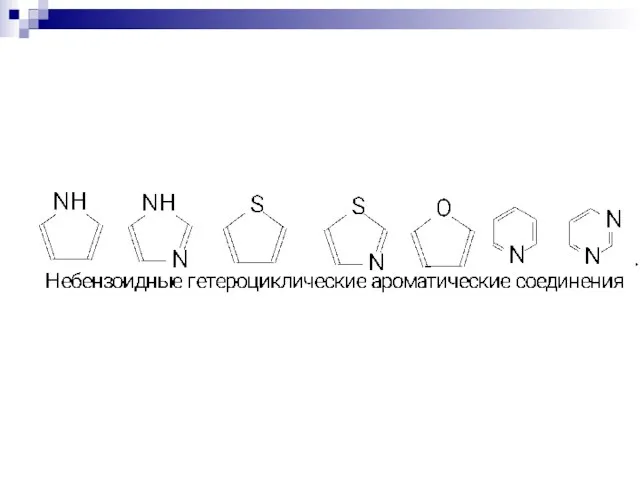
- 75. СОПРЯЖЁННЫЕ СИСТЕМЫ С ЗАМКНУТОЙ ЦЕПЬЮ. бензол нафталин пиррол тиофен пиридин круговая делокализация р-электронов фуран
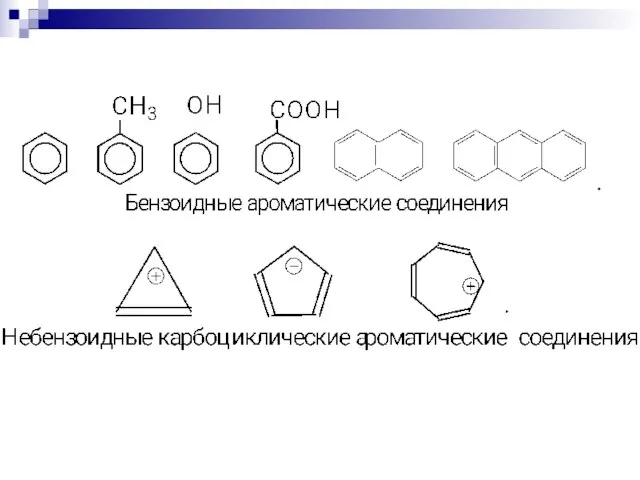
- 76. Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую
- 78. Ароматичность Эрих Арманд Артур Йозеф Хюккель ( Erich Armand Arthur Joseph Hückel ) (9 августа 1896,
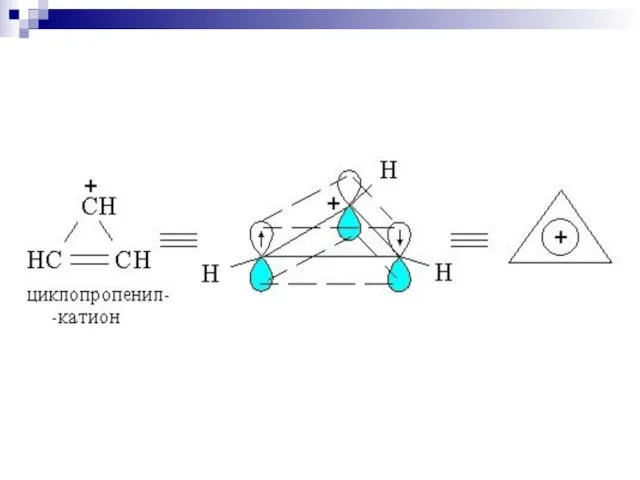
- 79. Правило Хюккеля. Система ароматична, если она обладает совокупностью следующих признаков: а) все атомы в цикле находятся
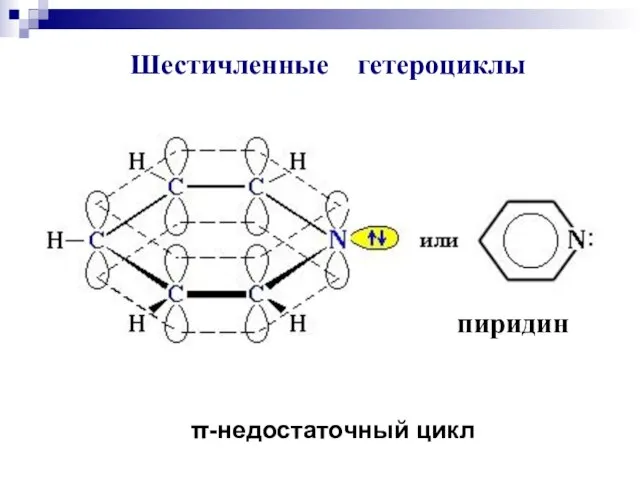
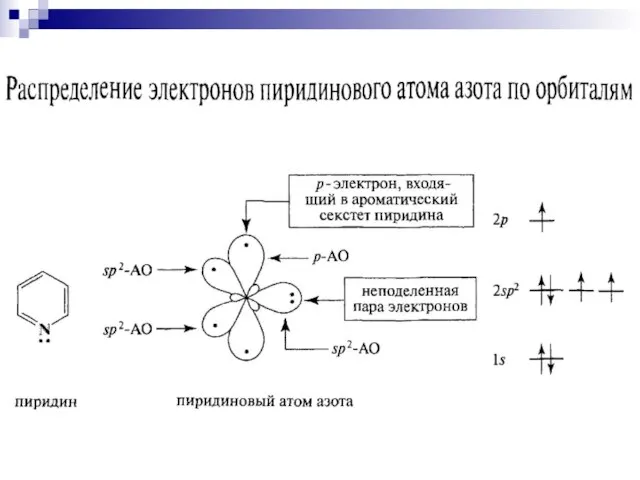
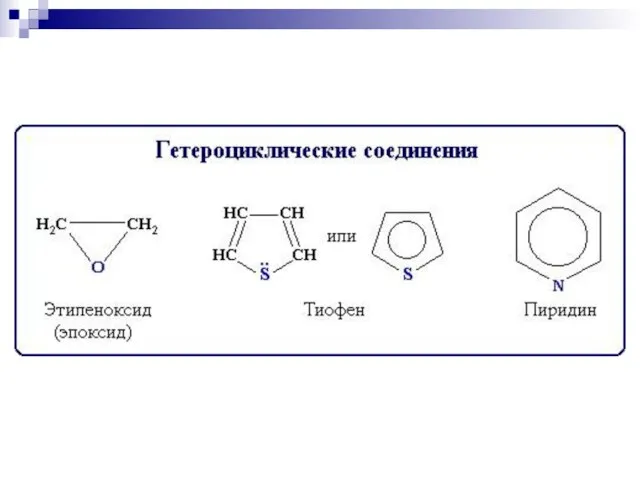
- 84. пиридин Шестичленные гетероциклы π-недостаточный цикл
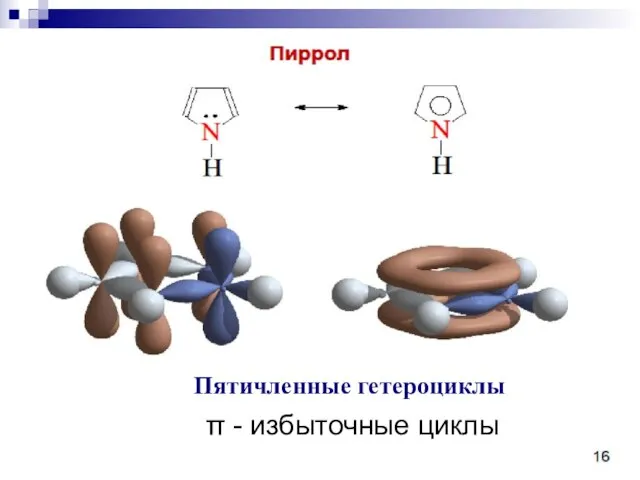
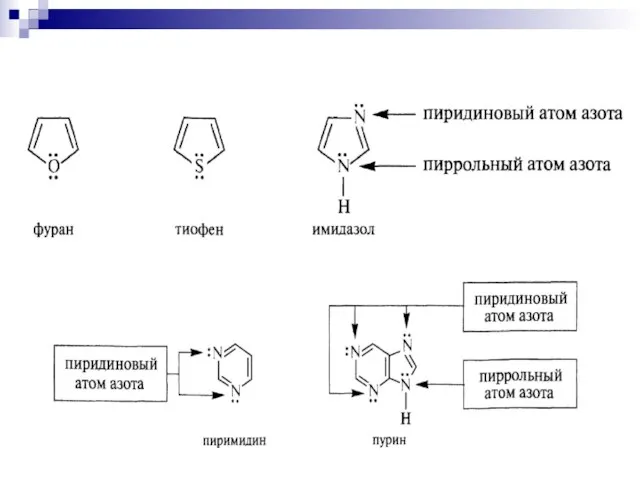
- 86. π - избыточные циклы Пятичленные гетероциклы
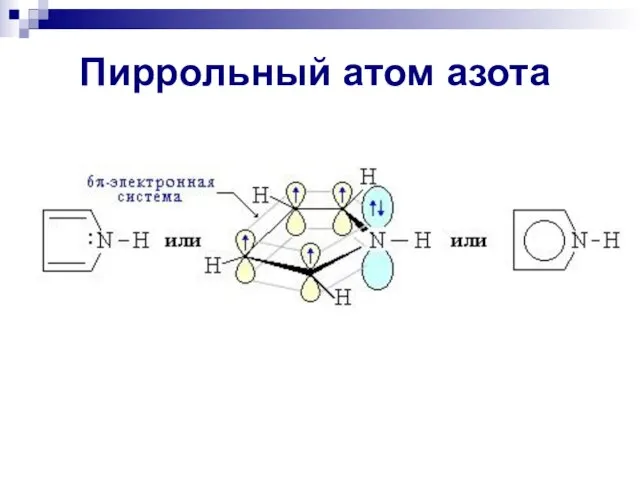
- 87. Пиррольный атом азота
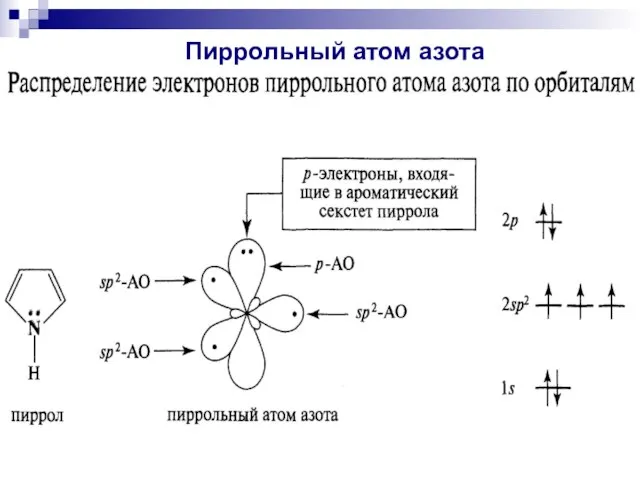
- 88. Пиррольный атом азота
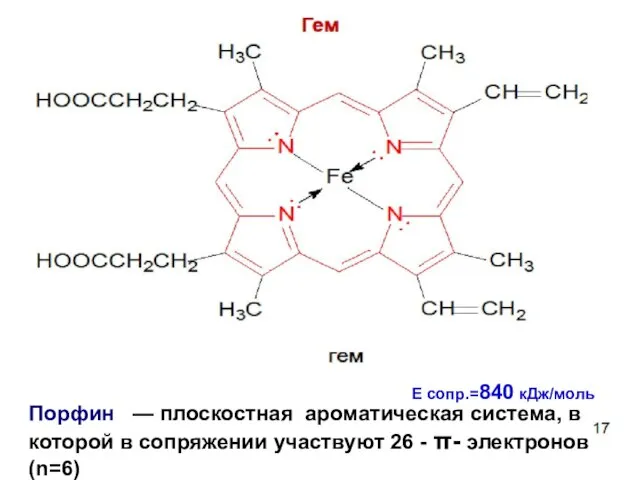
- 89. Порфин — плоскостная ароматическая система, в которой в сопряжении участвуют 26 - - электронов (n=6) Е
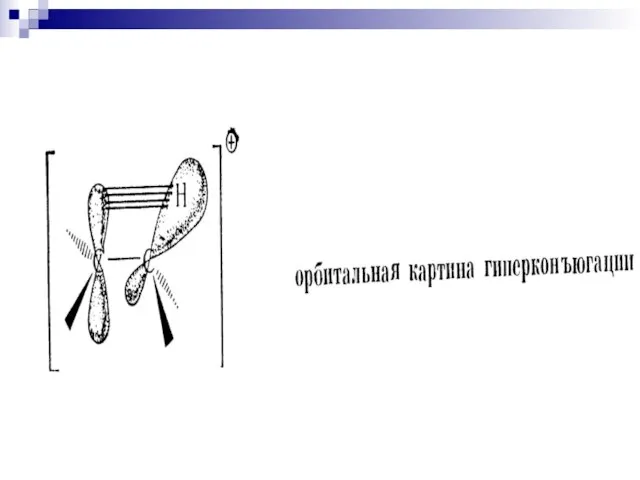
- 91. Взаимное влияние атомов в молекуле Сверхсопряжение (гиперконъюгация) 2-метилбутен-2 2-метилбутен-1 – стабилизация частично заполненной или свободной орбитали
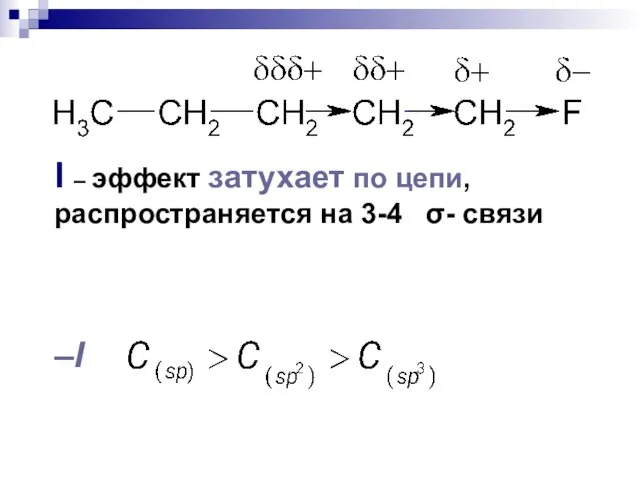
- 94. Взаимное влияние атомов в молекуле Индуктивный эффект Смещение электронной плотности по цепи -связей называется индуктивным эффектом
- 95. Электроноакцепторные заместители X, т.е. атом или группа атомов, смещающие электронную плотность -связи от атома углерода, проявляют
- 96. –I эффект проявляют 1. заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl,
- 97. +I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: 1. - насыщенные углеводородные радикалы (-CH3, -C2H5)
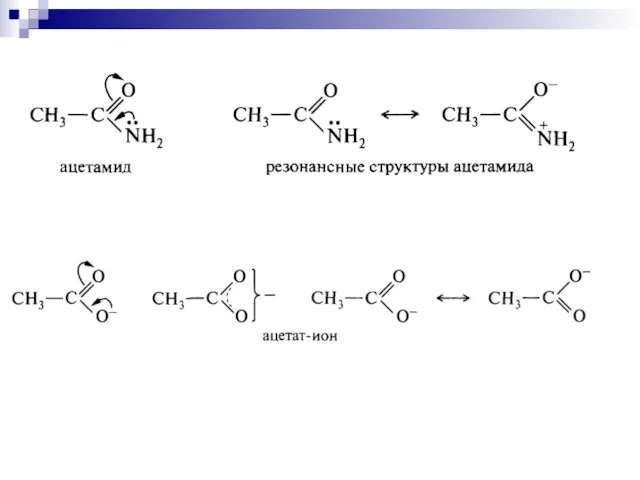
- 98. I – эффект затухает по цепи, распространяется на 3-4 σ- связи –I
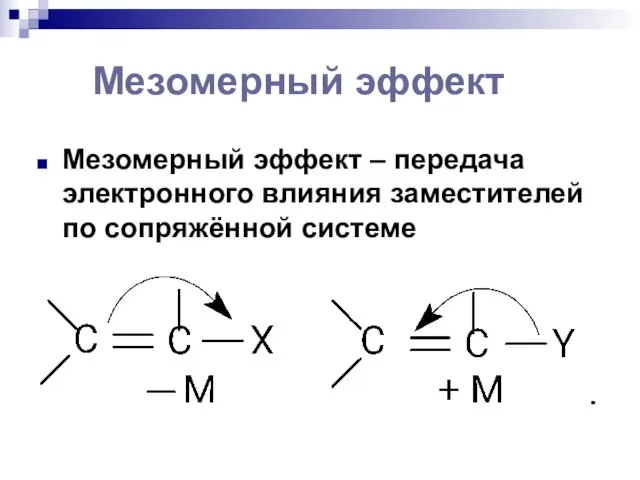
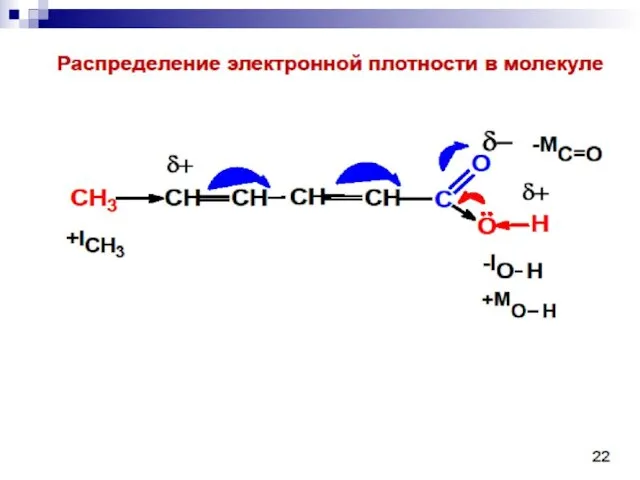
- 99. Мезомерный эффект Мезомерный эффект – передача электронного влияния заместителей по сопряжённой системе
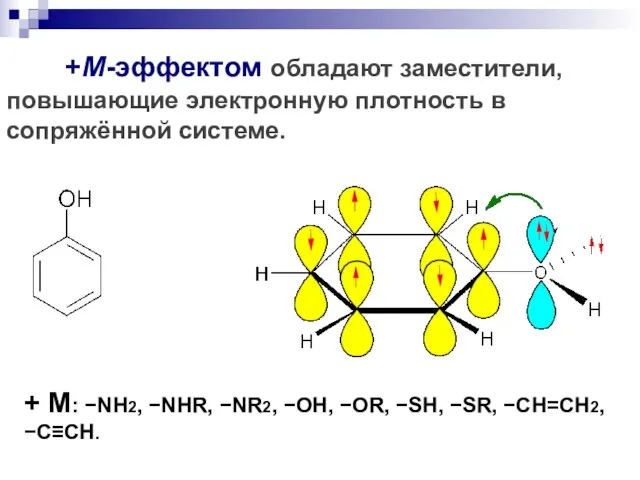
- 100. +М-эффектом обладают заместители, повышающие электронную плотность в сопряжённой системе. + М: NH2, NHR, NR2, OH, OR,
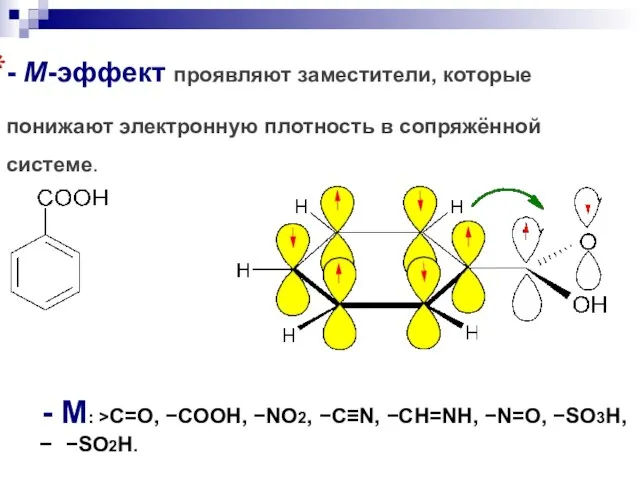
- 101. - М-эффект проявляют заместители, которые понижают электронную плотность в сопряжённой системе. - M: C=O, COOH, NO2,
- 104. Спасибо за внимание!
- 111. 2. Систематическая номенклатура ИЮПАК
- 114. Скачать презентацию































 Радиоактивные превращения атомных ядер. Правила смещения
Радиоактивные превращения атомных ядер. Правила смещения Психологические особенности подростков
Психологические особенности подростков Священные сооружения
Священные сооружения Корень слова
Корень слова Формализация характеристик и показателей информированности лица, принимающего решения
Формализация характеристик и показателей информированности лица, принимающего решения Урок №2
Урок №2 Правильно разделить слова
Правильно разделить слова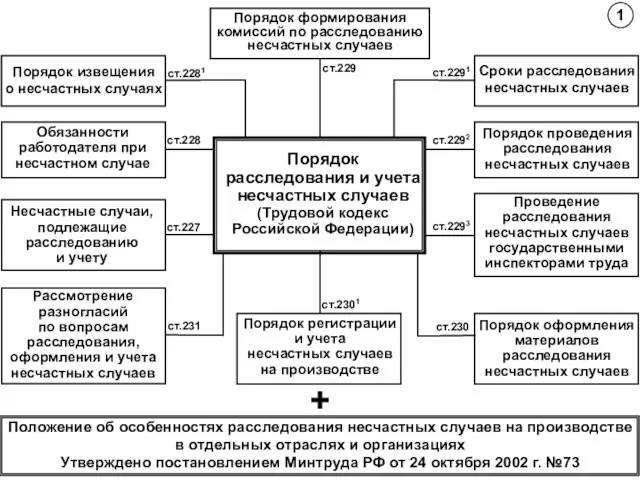 +
+ Cristmas words
Cristmas words Ассортимент плитки и керамогранита
Ассортимент плитки и керамогранита УНИВЕРСИТЕТСКАЯ БИБЛИОТЕКА В ИНФОРМАЦИОННО-ОБРАЗОВАТЕЛЬНОЙ СРЕДЕ Опарина О. Д., г. Екатеринбург, Уральский государственный униве
УНИВЕРСИТЕТСКАЯ БИБЛИОТЕКА В ИНФОРМАЦИОННО-ОБРАЗОВАТЕЛЬНОЙ СРЕДЕ Опарина О. Д., г. Екатеринбург, Уральский государственный униве Источники права
Источники права Ефаклар Гель-мус для очищення жирної проблемної шкіри обличчя
Ефаклар Гель-мус для очищення жирної проблемної шкіри обличчя Преемственность в коррекционной работе дошкольных и школьных логопедов
Преемственность в коррекционной работе дошкольных и школьных логопедов План работы отдела инновационной политики и развития образовательного процесса ФПК и ППРО 2011 год
План работы отдела инновационной политики и развития образовательного процесса ФПК и ППРО 2011 год Михаил Александрович Шолохов: судьба и творчество
Михаил Александрович Шолохов: судьба и творчество КЛАССНАЯ КОМПАНИЯ
КЛАССНАЯ КОМПАНИЯ Польза кредита
Польза кредита Менеджмент. Власть и партнерство
Менеджмент. Власть и партнерство Презентация на тему Русская философия XIX века
Презентация на тему Русская философия XIX века Cisco Aironet 1530 Series
Cisco Aironet 1530 Series Мир художника
Мир художника «О работе управления труда и социальной защиты населения администрации Александровского муниципального района Ставропольского
«О работе управления труда и социальной защиты населения администрации Александровского муниципального района Ставропольского  Горизонтальная и вертикальная дифференциация продукта
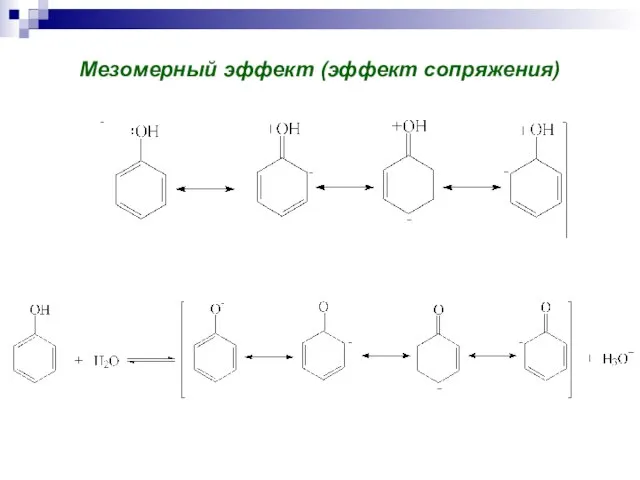
Горизонтальная и вертикальная дифференциация продукта Зарубежная литература эпохи Просвещения
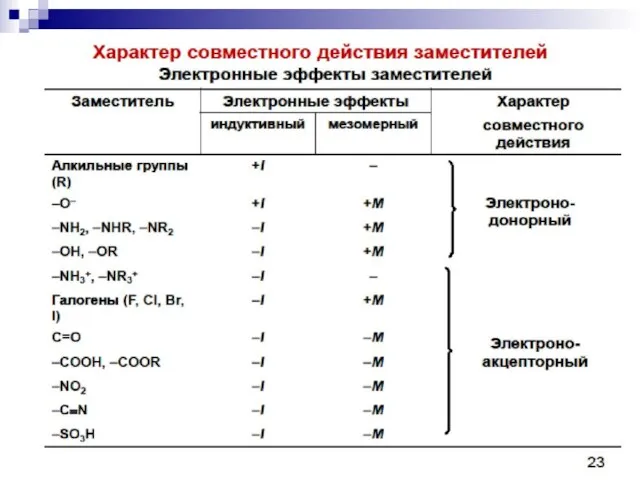
Зарубежная литература эпохи Просвещения Окружной конкурс проектных и исследовательских работ«Будущее Северо-Запада»(требования к оформлению работ)
Окружной конкурс проектных и исследовательских работ«Будущее Северо-Запада»(требования к оформлению работ) Презентация на тему: Плавание животных и человека
Презентация на тему: Плавание животных и человека Характеристика фашистских режимов в европе
Характеристика фашистских режимов в европе