Содержание
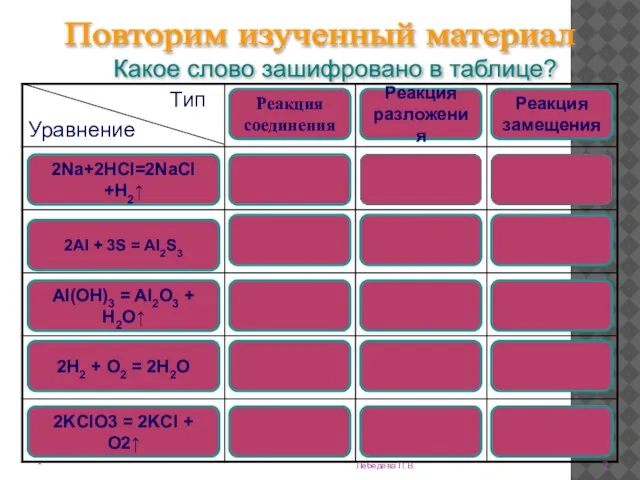
- 2. * Лебедева Л.В. Повторим изученный материал Какое слово зашифровано в таблице? 2Na+2HCl=2NaCl +H2↑ 2Al + 3S
- 3. Реакции соединения - это реакции, при которых из нескольких веществ образуется одно сложное. Реакции замещения -
- 4. Как расставить коэффициенты в реакциях с нечётным числом атомов? 5 10 Обратите внимание! Р + О
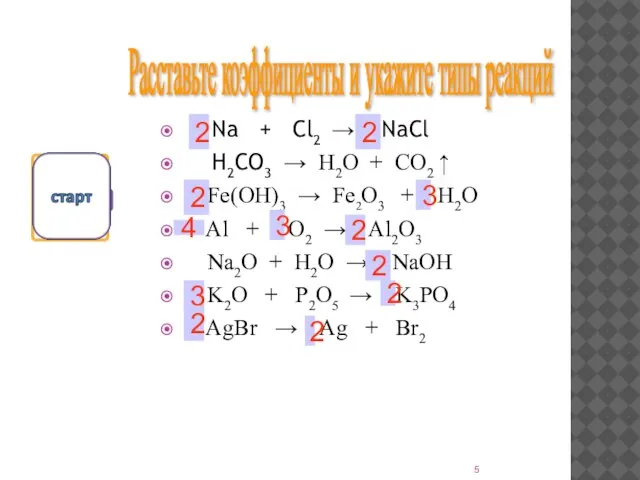
- 5. Na + Cl2 → NaCl H2CO3 → H2O + CO2 ↑ Fe(OH)3 → Fe2O3 + H2O
- 6. Цель урока: -познакомиться с реакциями обмена, дать определение данным реакциям -установить условия протекания реакций обмена до
- 7. Химические уравнения. Реакции обмена. Правила техники безопасности Реакция нейтрализации Лабораторные опыты Условия течения реакций идущих до
- 8. NaOH + HCl = NaCl + H2O Запишите уравнение подобной реакции между серной кислотой и гидроксидом
- 9. Не брать вещества руками Осторожно! ..При попадании на руки кислоты и щелочи вызывают ожог Сыпучие химические
- 10. Получите нерастворимый Fe(OH)3↓. В пробирку налейте 1 мл гидроксида натрия и прилейте несколько капель хлорида железа
- 11. На дне стакана равномерно разместите ложечку соды (карбоната натрия) и прилейте 2 мл раствора серной кислоты,
- 12. А если бы в пробирках проходила реакция нейтрализации между NaCl и H2SO4 ? 2NaCl + H2SO4
- 14. Скачать презентацию









 DREAM LAND
DREAM LAND Особенности использования TimesTen In-Memory Database в высоконагруженной среде
Особенности использования TimesTen In-Memory Database в высоконагруженной среде Игра в черное и белое
Игра в черное и белое Вычитание и сказка "Царевна-лягушка" 2 класс
Вычитание и сказка "Царевна-лягушка" 2 класс Органическая химия
Органическая химия Вербальные средства и процесс слушания в деловой коммуникации
Вербальные средства и процесс слушания в деловой коммуникации Літературна_та_загальнонародна_національна_мова
Літературна_та_загальнонародна_національна_мова Лев Толстой и Ясная Поляна
Лев Толстой и Ясная Поляна Центр психологической помощи
Центр психологической помощи БЕЗОПАСНОСТИ ДОРОЖНОГО ДВИЖЕНИЯ – ОСОБОЕ ВНИМАНИЕ
БЕЗОПАСНОСТИ ДОРОЖНОГО ДВИЖЕНИЯ – ОСОБОЕ ВНИМАНИЕ Выход из плоскости в пространство. Способы макетирования из одного листа бумаги
Выход из плоскости в пространство. Способы макетирования из одного листа бумаги На заре человечества
На заре человечества Скульптуры разных эпох и стилей
Скульптуры разных эпох и стилей Закаляйся - если хочешь быть здоров!
Закаляйся - если хочешь быть здоров! Конкурс на «Лучшую процедурную медсестру»
Конкурс на «Лучшую процедурную медсестру» Творчество Александра Блока на примере цикла стихов «Стихи о Прекрасной Даме»
Творчество Александра Блока на примере цикла стихов «Стихи о Прекрасной Даме» Наличные и электронные деньги
Наличные и электронные деньги УЗЧ-
УЗЧ- реализация программы нравственного воспитания
реализация программы нравственного воспитания Британия, Британия, туманная страна…
Британия, Британия, туманная страна… Английские слова
Английские слова Земля хороша собой… (пишем этюды, или зарисовки с натуры)
Земля хороша собой… (пишем этюды, или зарисовки с натуры) Основы работы в ВикиВики (практика) Нацкевич Юлия Попова Светлана Дерябин Александр
Основы работы в ВикиВики (практика) Нацкевич Юлия Попова Светлана Дерябин Александр Презентация на тему Речевая разминка на уроках чтения
Презентация на тему Речевая разминка на уроках чтения Функции науки об управлении персоналом
Функции науки об управлении персоналом Средняя общеобразовательная школа № 17 с углубленным изучением отдельных предметов
Средняя общеобразовательная школа № 17 с углубленным изучением отдельных предметов Lection 14 tanini skzbnaxbjurner
Lection 14 tanini skzbnaxbjurner Атомные аварии
Атомные аварии