Содержание
- 2. Закрепление и обобщение материала по теме: «Железо и его соединения» 9 класс
- 3. Путешествие по стране химических вопросов
- 4. ЗНАНИЯ - ЭТО ИСТИННЫЕ СОКРОВИЩА, КОТОРЫЕ ПОЛУЧАЕТ И НАКАПЛИВАЕТ ЧЕЛОВЕК...
- 5. Для того, чтоб умным стать, Надо много понимать, материал запоминать. Что такое водород? Как реакция пойдет?
- 6. Станция 1 "Быстрая"
- 7. Станция 2 "Разминочная"
- 8. 1. В магнитном железняке содержится много железа. 2. Железо реагирует и с простыми веществами, и со
- 9. Станция 3 "Отгадай-ка!"
- 10. FeCl3 Fe(NO3)2 Fe2O3 FeS FeSO4 FeCO3
- 11. Станция 4 "Исчезнувшие слова"
- 12. 1. Металлические руды содержат …… железа. 2. …… сульфата железа(2) вступают в реакцию с медью. 3.
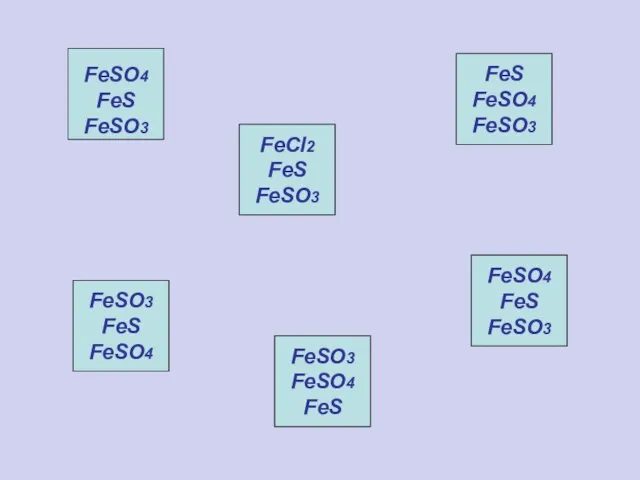
- 13. Станция 5 "Двойняшки"
- 14. FeCl2 FeS FeSO3 FeS FeSO4 FeSO3 FeSO3 FeS FeSO4 FeSO3 FeSO4 FeS FeSO4 FeS FeSO3 FeSO4
- 15. Станция 6 "Внимательная"
- 16. Станция 7 "Уравнения реакций"
- 17. Закончить схемы реакций: Железо + соляная кислота (У железа взять валентность (ll) Железо + сульфат меди(ll)
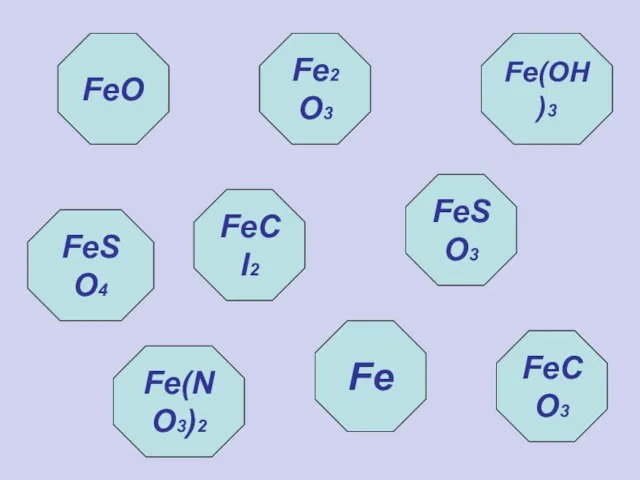
- 18. Станция 8 "Эрудит"
- 19. FeO Fe(OH)3 Fe2O3 FeSO4 FeCl2 Fe(NO3)2 Fe FeSO3 FeCO3
- 20. Станция 9 "Домашняя"
- 21. Определите массу выпавшего осадка, если нитрат железа(lll) реагирует с 600 г 40%-ного раствора гидроксида натрия Задача
- 22. всем спасибо за работу
- 24. Скачать презентацию



















 совместно с Театром праздника «Солнечный зайчик»
совместно с Театром праздника «Солнечный зайчик» ЧАС ЗАНИМАТЕЛЬНОЙ БИОЛОГИИ 7 класс
ЧАС ЗАНИМАТЕЛЬНОЙ БИОЛОГИИ 7 класс Презентация на тему Врожденные и приобретенные программы поведения
Презентация на тему Врожденные и приобретенные программы поведения Презентация
Презентация ПРОЕКТНАЯ РАБОТА
ПРОЕКТНАЯ РАБОТА к.э.н. директор Бизнес- инкубатора, заместитель проректора по инновационной деятельности УрФУ Пиличев Валерий Валерьевич
к.э.н. директор Бизнес- инкубатора, заместитель проректора по инновационной деятельности УрФУ Пиличев Валерий Валерьевич Культура Руси в 10 – 13 веках
Культура Руси в 10 – 13 веках Болгария в 20-30-е годы
Болгария в 20-30-е годы Доказательная медицина и доказательная педагогика. Взгляд врача и исследователя
Доказательная медицина и доказательная педагогика. Взгляд врача и исследователя Приготовление завтрака
Приготовление завтрака «Инвестиционная политика муниципального образования на современном этапе»02.02.2012
«Инвестиционная политика муниципального образования на современном этапе»02.02.2012 Работа академии по направлению научно-технического творчества молодежи
Работа академии по направлению научно-технического творчества молодежи «Трудные» дети и их проблемы.
«Трудные» дети и их проблемы. Приемы расположения к себе. Самопрезентация
Приемы расположения к себе. Самопрезентация Автохимия. Завод автохимии
Автохимия. Завод автохимии Об итогах выполнения задач в ЗПО 2017 учебного года и постановка задач на ЛПО 2017 учебного года
Об итогах выполнения задач в ЗПО 2017 учебного года и постановка задач на ЛПО 2017 учебного года Евангелие от Матфея
Евангелие от Матфея Нарушения требований Федерального закона от 20.07.2012 № 125-ФЗ О донорстве крови и ее компонентов
Нарушения требований Федерального закона от 20.07.2012 № 125-ФЗ О донорстве крови и ее компонентов Аварийная аптечка для первой медицинской помощи
Аварийная аптечка для первой медицинской помощи Власть. Сила. Лекция 2
Власть. Сила. Лекция 2 Вітражі та шпроси
Вітражі та шпроси Моя будущая профессия - бухгалтер
Моя будущая профессия - бухгалтер Олимпиада үрләренә - баскычлап
Олимпиада үрләренә - баскычлап Общероссийские антидопинговые правила
Общероссийские антидопинговые правила Проектирование транспортно-грузовых комплексов
Проектирование транспортно-грузовых комплексов Определение размеров молекул октана
Определение размеров молекул октана Такси Лось
Такси Лось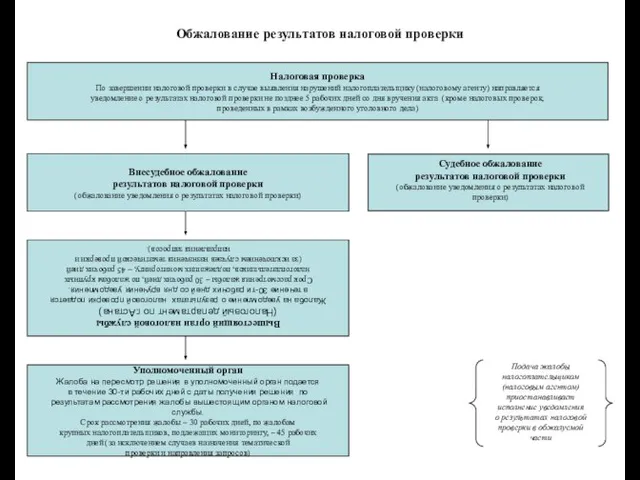 Обжалование результатов налоговой проверки
Обжалование результатов налоговой проверки