Содержание
- 2. Химия занимает важное место в системе школьного образования. При изучении химии преимущественно используется описательная часть курса.
- 3. Порядок решения задач 1. Краткая запись условия задачи 2. Запись уравнения химической реакции 3. Запись известных
- 4. Химическая часть задачи: 1. Чтение текста 2. Запись условия задачи 3. Определение типа задачи 4. Анализ
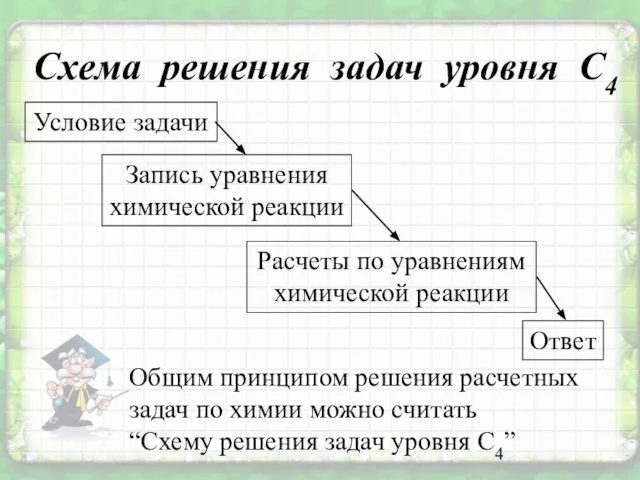
- 5. Схема решения задач уровня С4 Общим принципом решения расчетных задач по химии можно считать “Схему решения
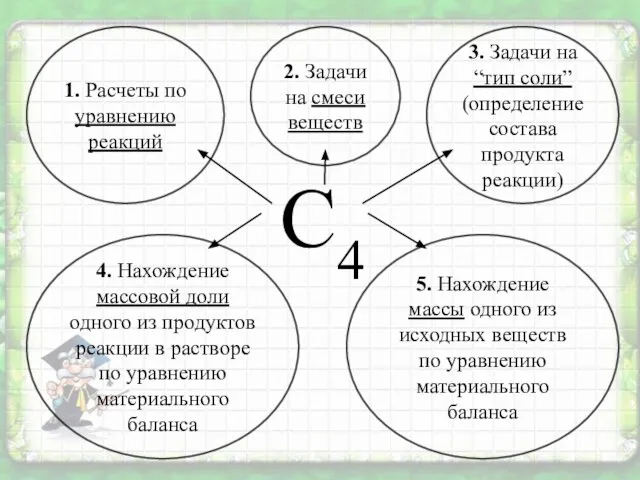
- 6. С4 1. Расчеты по уравнению реакций 5. Нахождение массы одного из исходных веществ по уравнению материального
- 7. Задача С4 (2008 года) Сероводород объемом 5,6л (н.у.) прореагировал без остатка с 59,02мл раствора гидроксида калия
- 8. Задача С4 (2009 года) Магний массой 4,8г растворили в 200мл 12%-ного раствора серной кислоты (ρ=1,5г/мл). Вычислите
- 9. Задача С4 (2010 года) Карбид алюминия растворили в 380г раствора хлороводородной кислоты с массовой долей 15%.
- 10. Задача С4 (2011 года) Нитрит калия массой 8,5г внесли при нагревании в 270 г раствора бромида
- 11. Задача С4 (2012 года) К раствору гидроксида натрия массой 1200 г прибавили 490г 40%-ного раствора серной
- 12. Задача С4 (2013 года) Определите массовые доли (в %) сульфата железа и сульфида алюминия в смеси,
- 13. Задания С4 (2002 года) 1. Объясните, почему при нитровании толуола происходит замещение атомов водорода только у
- 14. Примеры задач уровня С4 Тип 1. Расчеты по уравнению реакций.doc Тип 2. Задачи на смеси веществ.doc
- 15. Список литературы Несомненно большую помощь Вам окажут книги: Доронькин, В.Н. Химия. 9 класс. Тематические тесты по
- 16. Медведев, Ю.Н. Типовые тестовые задания / Ю.Н. Медведев. - М.: Экзамен, 2013. - 112 с. Доронькин,
- 18. Скачать презентацию













 Владимир Владимир Маяковский
Владимир Владимир Маяковский  Кукольный спектакль Зайкина тётя
Кукольный спектакль Зайкина тётя Презентация на тему Язык HTML
Презентация на тему Язык HTML Культура во второй половине XX-начале XXI века.
Культура во второй половине XX-начале XXI века. Сделай свое лето со 2 июня по 3 августа 2019 года включительно (период действия каталогов №№8–10 2019 года)
Сделай свое лето со 2 июня по 3 августа 2019 года включительно (период действия каталогов №№8–10 2019 года) Презентация на тему: Информация, как основная сущность теории информации
Презентация на тему: Информация, как основная сущность теории информации Тип губки
Тип губки использование религиозных символов в коммерческой рекламе
использование религиозных символов в коммерческой рекламе Prezentatsia1
Prezentatsia1 A real professional. What does it mean?
A real professional. What does it mean? Santa Claus
Santa Claus Внутренняя политика России в начале XXI века – восстановление государства
Внутренняя политика России в начале XXI века – восстановление государства Общественная жизнь России при Николае I
Общественная жизнь России при Николае I Le frasi ridicole
Le frasi ridicole Предложения по подготовке специалистовдля реализации проектов по коммерциализации товаров и услуг ГНСС «ГЛОНАСС»
Предложения по подготовке специалистовдля реализации проектов по коммерциализации товаров и услуг ГНСС «ГЛОНАСС» Создание культурной среды при обучении младших школьников иностранному языку
Создание культурной среды при обучении младших школьников иностранному языку Технические кодексы установившейся практики в области охраны окружающей среды и природопользования
Технические кодексы установившейся практики в области охраны окружающей среды и природопользования Одуванчик
Одуванчик Введение в теорию производства
Введение в теорию производства "ПО ДОРОГАМ ГРАЖДАНСКОЙ ВОЙНЫ"
"ПО ДОРОГАМ ГРАЖДАНСКОЙ ВОЙНЫ" Как фотографировать высокое сооружение
Как фотографировать высокое сооружение Презентация на тему Роль права в жизни государства
Презентация на тему Роль права в жизни государства Презентация на тему Деревья леса
Презентация на тему Деревья леса l_sapr_1-7
l_sapr_1-7 Эффективные способы использования заемных средств, способствующие развитию бизнеса.
Эффективные способы использования заемных средств, способствующие развитию бизнеса. Алиса в стране чудес
Алиса в стране чудес Добровольцы мы (3 раза) В армии Христа. Смело мы идем за своим Вождем, С Ним мы победим врага.
Добровольцы мы (3 раза) В армии Христа. Смело мы идем за своим Вождем, С Ним мы победим врага. Особенности проведенияЕГЭв штатном режиме
Особенности проведенияЕГЭв штатном режиме