Содержание
- 2. Электрический ток в электролитах Задачи урока: познакомиться с явлением электролиза и его практическим применением - знать
- 3. Групповой эксперимент «электролиты» Электролитическая диссоциация Механизм проводимости Электролиз Обобщенный закон электролиза Применение электролиза (защита плаката) План
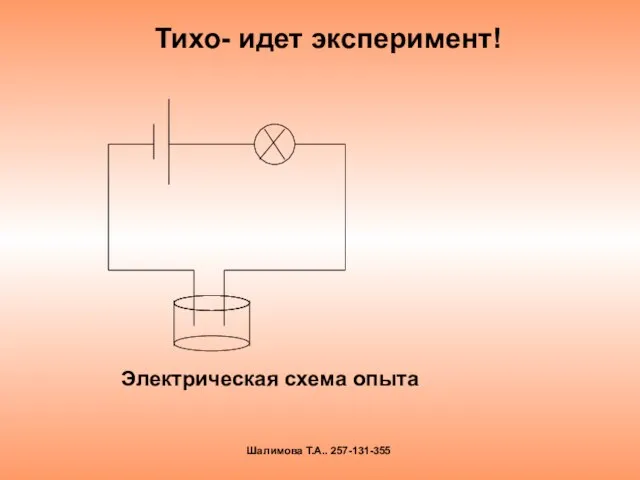
- 4. Тихо- идет эксперимент! Шалимова Т.А.. 257-131-355 Электрическая схема опыта
- 5. Запиши результаты эксперимента: 1) Сухой Сu SO4 – не проводит 2) Раствор Cu SO4 – проводит
- 6. Электролиты – вещества, растворы и расплавы которых проводят электрический ток Примеры: р-ры солей р-ры кислот р-ры
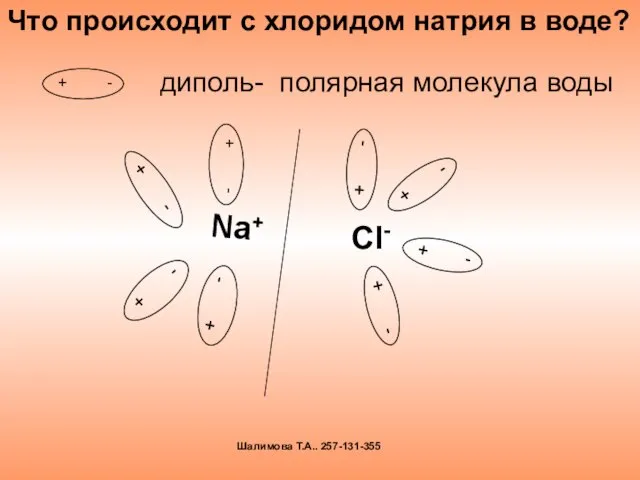
- 7. диполь- полярная молекула воды Что происходит с хлоридом натрия в воде? Шалимова Т.А.. 257-131-355
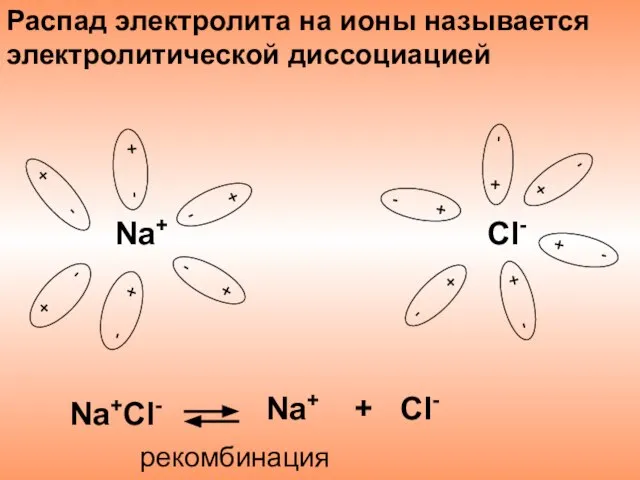
- 8. Распад электролита на ионы называется электролитической диссоциацией Na+Cl- Na+ + Cl- рекомбинация
- 9. СuSO4 Cu2+ + SO42- Проверь себя: Диссоциация медного купороса (сульфата меди) Шалимова Т.А.. 257-131-355
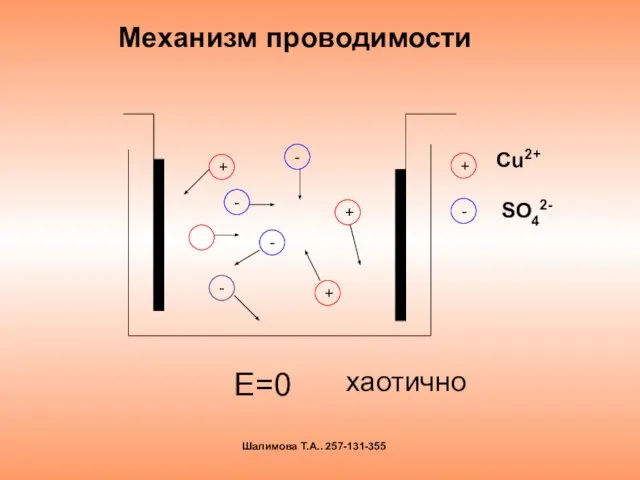
- 10. Механизм проводимости Е=0 + + + - - - - хаотично Шалимова Т.А.. 257-131-355
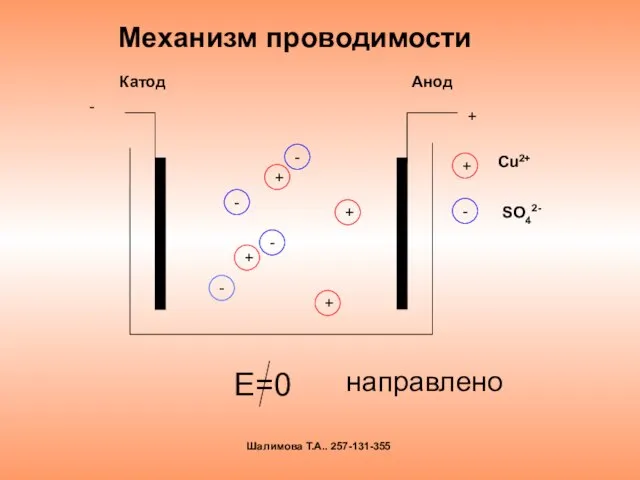
- 11. Механизм проводимости Е=0 направлено + + + + - - - - - + Катод Анод
- 12. Электрический ток в электролите- это направленное движение положительных и отрицательных ионов Шалимова Т.А.. 257-131-355
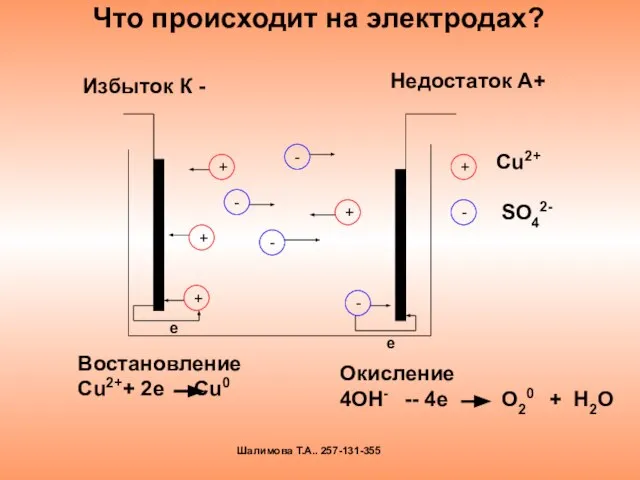
- 13. Что происходит на электродах? Избыток К - Недостаток А+ е Востановление Сu2++ 2e Cu0 Окисление 4OH-
- 14. Окислительно – восстановительные процессы под действием электрического тока называются электролизом Шалимова Т.А.. 257-131-355
- 15. * Вспомни уроки химии и допиши схему электролиза Р-р CuSO4 Cu2+ + SO42- H2O H+ +
- 16. Правила электролиза K Ca Na Mg Al Zn Cr Fe H Cu Hg Ag An Pt
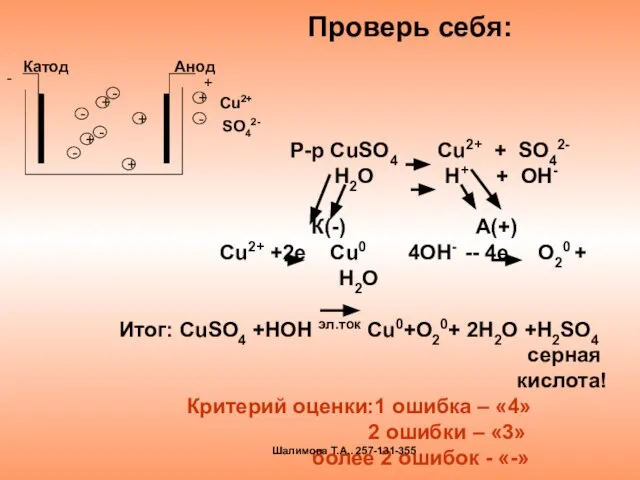
- 17. Проверь себя: Р-р CuSO4 Cu2+ + SO42- H2O H+ + OH- К(-) А(+) Сu2+ +2e Cu0
- 18. Закон электролиза был экспериментально установлен М.Фарадеем в 1832году. Английский физик Майкл Фарадей родился в предместье Лондона
- 19. m= kQ m= μ I t Fn Масса вещества, выделившегося на электроде, пропорциональна общему заряду, прошедшему
- 20. Эхо m Q k I t F Na e n μ mi N Шалимова Т.А.. 257-131-355
- 21. № 895* Модель ситуации: m = kQ = μ I t n F :μ ν =
- 22. I в Дано Си Решение m = 1,8 г = 1,8 10–3 кг m = k
- 23. II в Дано Си Решение t = 20 мин = 1,2 103 с m = k
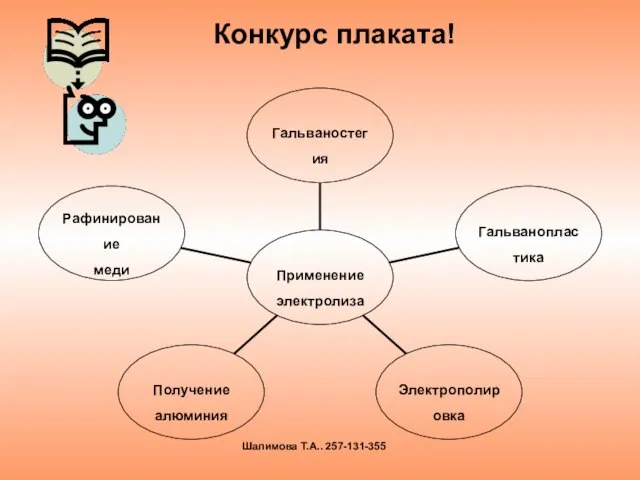
- 24. Конкурс плаката! Шалимова Т.А.. 257-131-355
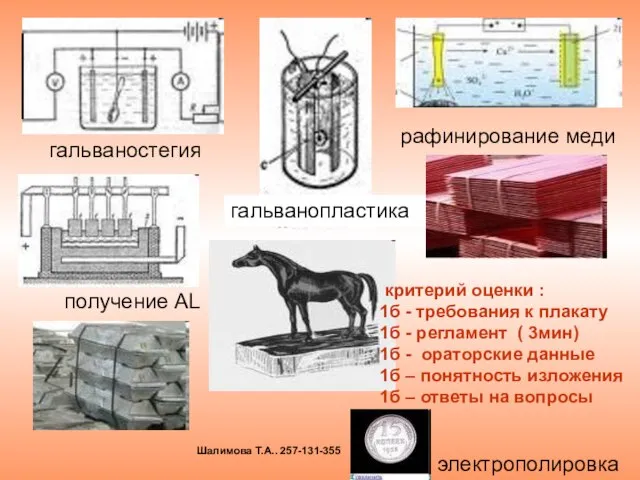
- 25. гальваностегия гальванопластика рафинирование меди электрополировка получение AL критерий оценки : 1б - требования к плакату 1б
- 26. Д/з -выучить определения: Электролиты Диполь Электролитическая диссоциация Рекомбинация Ион Электролиз Катод Анод Восстановление Окисление -анализ формул-
- 27. Использовались: - Капустин Н. П. Педагогические технологии адаптивной школы издательский центр «Академия» 2002г - О.В.Акулова и
- 29. Скачать презентацию

















 Учет расчетов по оплате труда
Учет расчетов по оплате труда OLD ENGLISH PHONETICS
OLD ENGLISH PHONETICS Результаты ЕГЭ по информатике В.В. Казантаева, зав. отделом обработки и
Результаты ЕГЭ по информатике В.В. Казантаева, зав. отделом обработки и  Основные виды устройства детей-сирот и детей, оставшихся без попечения родителей.
Основные виды устройства детей-сирот и детей, оставшихся без попечения родителей. Многогранники в архитектуре
Многогранники в архитектуре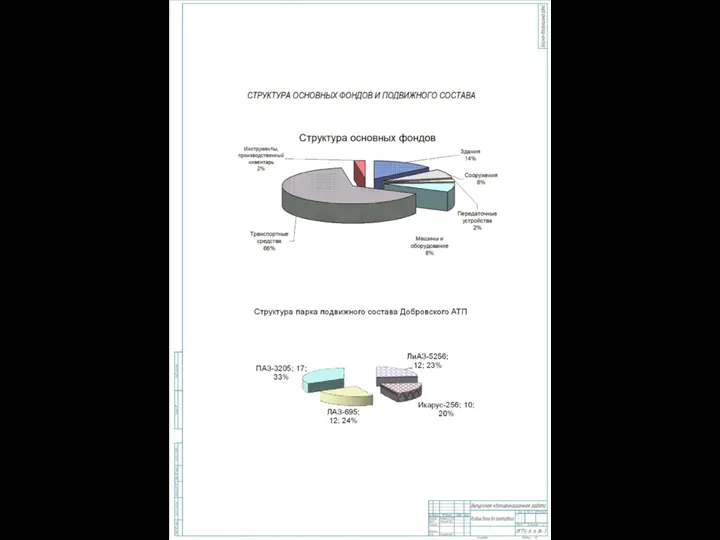 Структура основных фондов и подвижного состава
Структура основных фондов и подвижного состава Диспансеризация
Диспансеризация Святки
Святки Light серия WindAir Максимально прост и надежен в исполнении. В базовую комплектацию включены следующие функции: - авто-рестарт - 12 часово
Light серия WindAir Максимально прост и надежен в исполнении. В базовую комплектацию включены следующие функции: - авто-рестарт - 12 часово Моделирование естественного нейрона, как системы преобразования импульсных потоков С.П. Романов, д.б.н, вед. науч. сотр., Институт
Моделирование естественного нейрона, как системы преобразования импульсных потоков С.П. Романов, д.б.н, вед. науч. сотр., Институт  Влияние различных видов звуков на организм человека
Влияние различных видов звуков на организм человека Изменения слизистой оболочки полости рта при дерматозах с аутоиммунным компонентом
Изменения слизистой оболочки полости рта при дерматозах с аутоиммунным компонентом Торжественная церемония награждения победителей конкурса«Лучший по профессии»
Торжественная церемония награждения победителей конкурса«Лучший по профессии» Компьютеромания и виртуальный мир: равнозначны ли эти понятия
Компьютеромания и виртуальный мир: равнозначны ли эти понятия Введение в право. Признаки, функции, источники права
Введение в право. Признаки, функции, источники права Понятие вероятности
Понятие вероятности Классификация психодиагностических методов исследования и традиции их использования
Классификация психодиагностических методов исследования и традиции их использования Презентация на тему Буква Я (1 класс)
Презентация на тему Буква Я (1 класс) Suomen kielen tunnit 17а
Suomen kielen tunnit 17а ЧУДОТВОРНЫЕ ИКОНЫ Пресвятой Богородицы
ЧУДОТВОРНЫЕ ИКОНЫ Пресвятой Богородицы ВЕХИ РУССКОЙ ИСТОРИИ
ВЕХИ РУССКОЙ ИСТОРИИ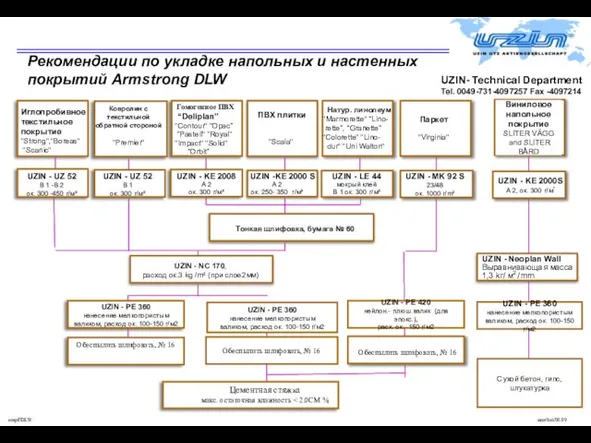 Рекомендации по укладке напольных и настенных покрытий Armstrong DLW
Рекомендации по укладке напольных и настенных покрытий Armstrong DLW Федосова Наталия Викторовна
Федосова Наталия Викторовна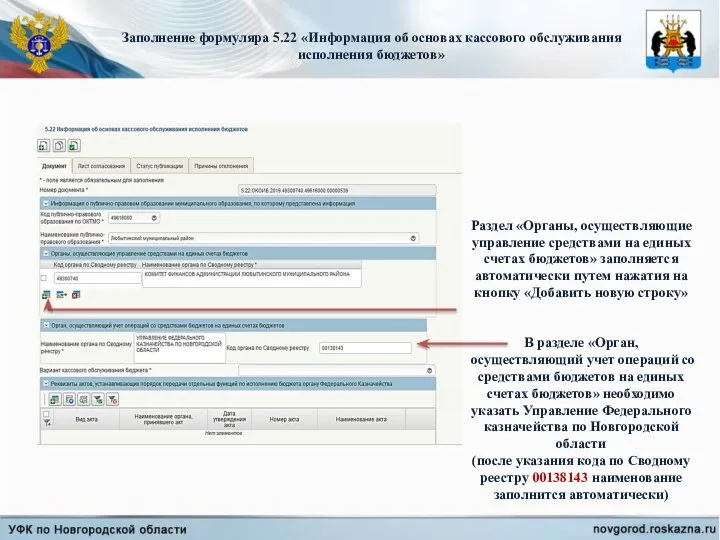 Заполнение формуляра 5.22 Информация об основах кассового обслуживания исполнения бюджетов
Заполнение формуляра 5.22 Информация об основах кассового обслуживания исполнения бюджетов Джоули из турникетов
Джоули из турникетов а
а Опорные схемы учебно – воспитательного курса «Основы религиозных культур и светской этики».
Опорные схемы учебно – воспитательного курса «Основы религиозных культур и светской этики». Современные тенденции в развитии права
Современные тенденции в развитии права