Содержание
- 2. Классификация производных хинолина 1.1. Производные цинхонана (хинина гидрохлорид, хинина дигидрохлорид, хинина сульфат). 1.2. Производные 8-гидроксихинолина (хинозол,
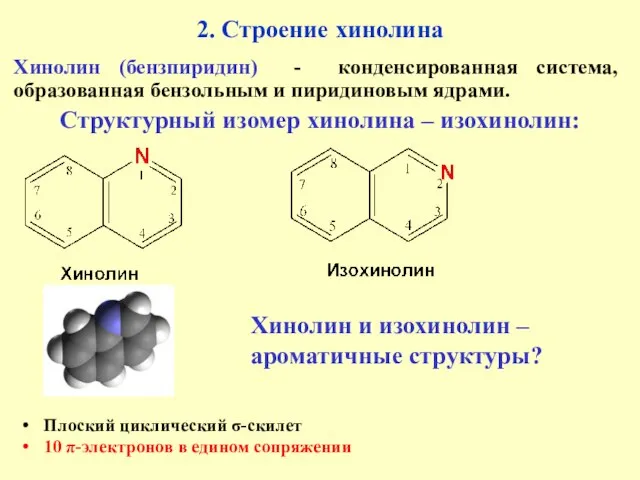
- 3. 2. Строение хинолина Хинолин (бензпиридин) - конденсированная система, образованная бензольным и пиридиновым ядрами. Структурный изомер хинолина
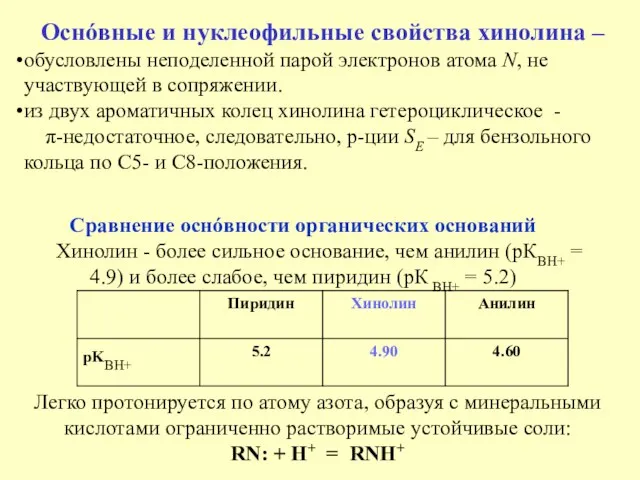
- 4. Cравнение оснóвности органических оснований Хинолин - более сильное основание, чем анилин (рКBH+ = 4.9) и более
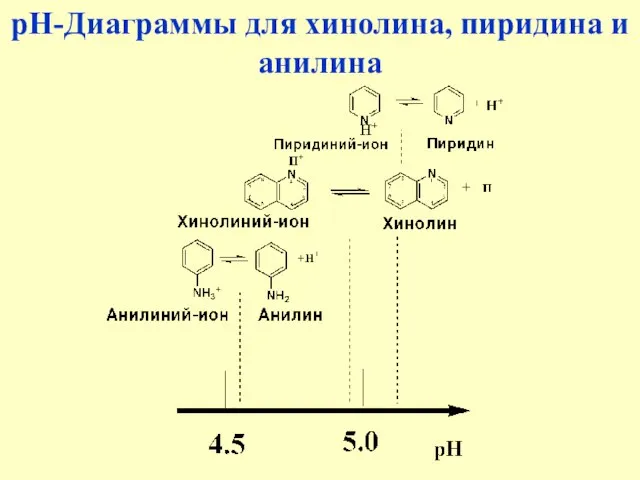
- 5. рН-Диаграммы для хинолина, пиридина и анилина
- 6. 3. Из истории алкалоидов группы хинолина Всего известно около 300 – выделены из растений 14 семейств
- 7. «Хинное дерево» → «Хинная корка» → «Хина» (сумма алкалоидов) → «Хинин» (основной алкалоид)
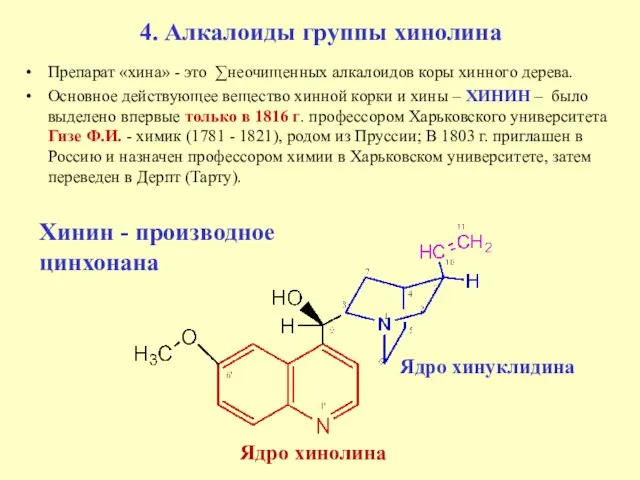
- 8. 4. Алкалоиды группы хинолина Препарат «хина» - это ∑неочищенных алкалоидов коры хинного дерева. Основное действующее вещество
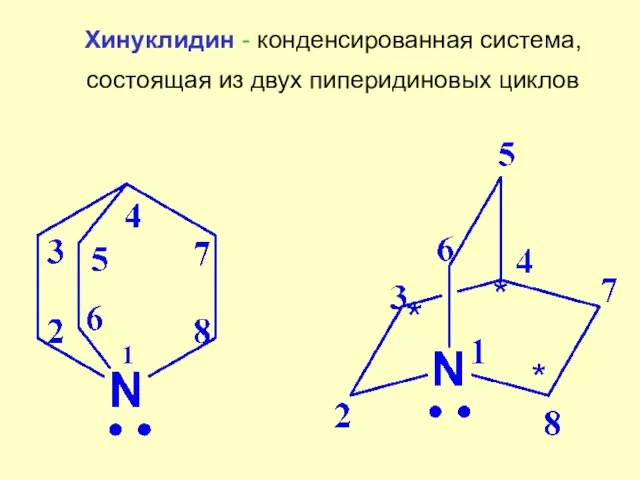
- 9. Хинуклидин - конденсированная система, состоящая из двух пиперидиновых циклов
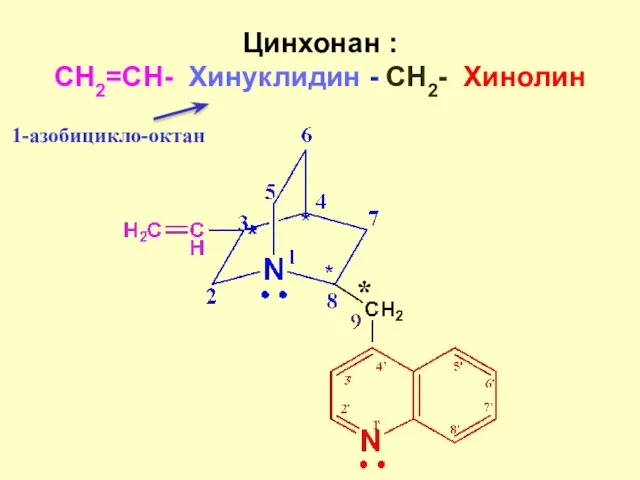
- 10. Цинхонан : CH2=CH- Хинуклидин - СH2- Хинолин * 1-азобицикло-октан
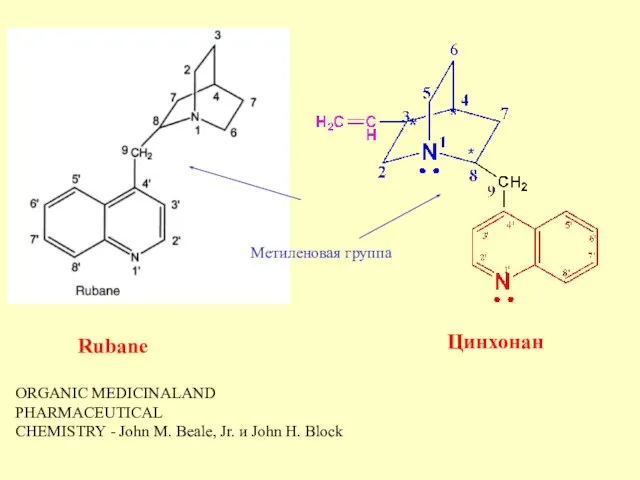
- 11. ORGANIC MEDICINALAND PHARMACEUTICAL CHEMISTRY - John M. Beale, Jr. и John H. Block Метиленовая группа Rubane
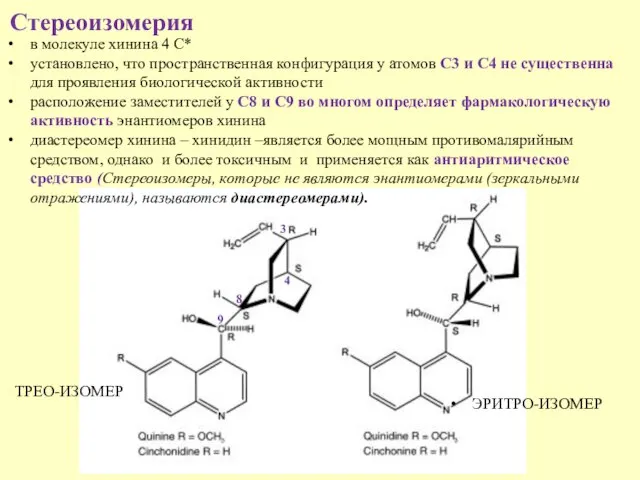
- 12. Стереоизомерия 9 8 4 в молекуле хинина 4 С* установлено, что пространственная конфигурация у атомов С3
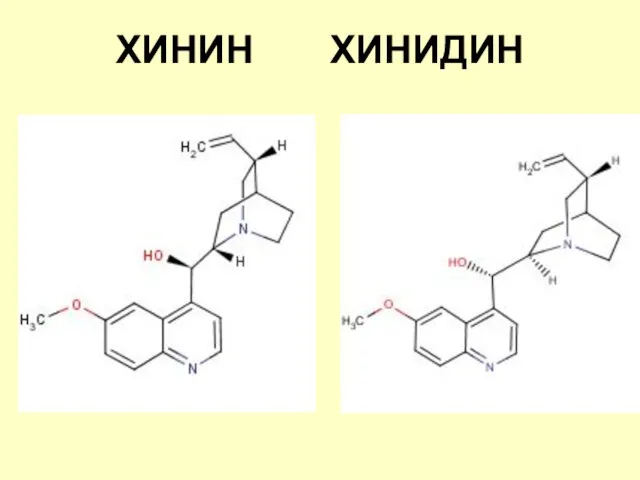
- 13. ХИНИН ХИНИДИН
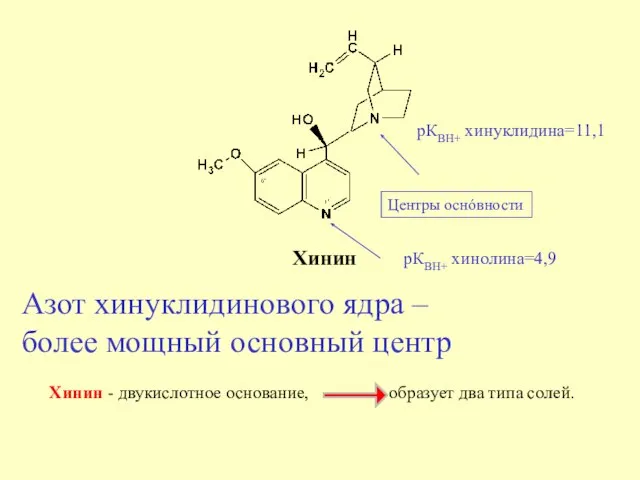
- 14. Хинин Хинин - двукислотное основание, образует два типа солей. Центры оснóвности рКВН+ хинуклидина=11,1 рКВН+ хинолина=4,9 Азот
- 15. Хинина гидрохлорид Chinini hydrochloridum (R)-[(2S,4S,5R)-5-этинил-1-азобицикло[2.2.2]окт-2-ил] (6-метоксихинолин-4-ил )метанол гидрохлорид Хинина сульфат Chinini sulfas бис[(R)-[(2S,4S,5R)-5-этинил-1-азобицикло[2.2.2]окт-2-ил](6-метоксихинолин-4-ил)метанол] сульфат Белые или
- 16. Хинина сульфат Chinini sulfas Противомалярийное средство Хинидина сульфат Chinidini sulfas бис[(S)-[(2R,4S,5R)-5-этинил-1-азобицикло[ 2.2.2]окт-2-ил](6-метоксихинолин-4-ил) метанол] сульфат Белый или
- 17. Европейская фармакопея Ph.Eur Идентификация: А: Хроматография в тонком слое (ТСХ) в качестве неподвижной фазы используют силикагель;
- 18. Идентификация: В: Таллеохинная проба С. Синяя флуоресценция сернокислого р-ра соли хинина при облучении УФ-светом при 366
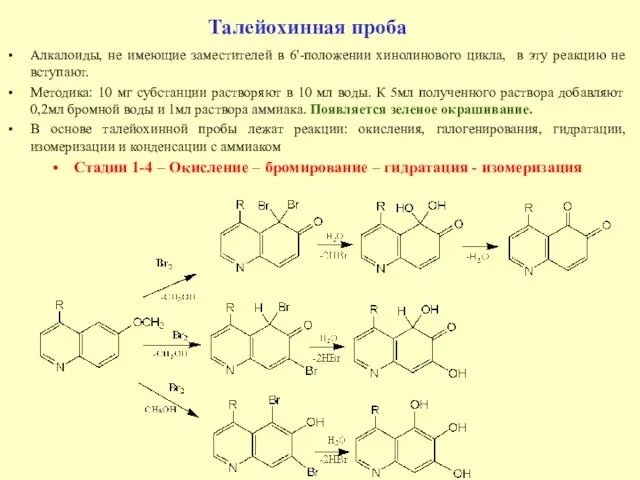
- 19. Талейохинная проба Алкалоиды, не имеющие заместителей в 6'-положении хинолинового цикла, в эту реакцию не вступают. Методика:
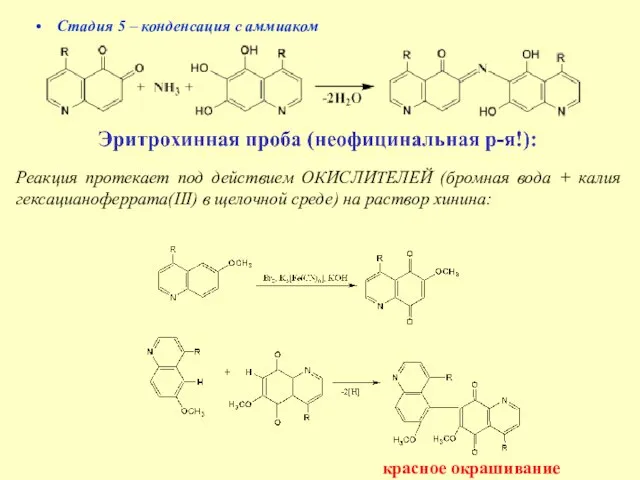
- 20. Стадия 5 – конденсация с аммиаком Реакция протекает под действием ОКИСЛИТЕЛЕЙ (бромная вода + калия гексацианоферрата(III)
- 21. Методы количественного анализа Гравиметрия. Проводят по основанию, выделяемому из раствора соли при добавлении раствора натрия гидроксида.
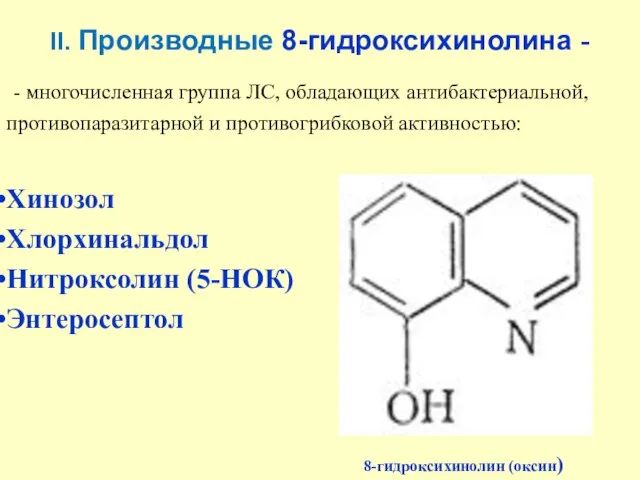
- 22. II. Производные 8-гидроксихинолина - - многочисленная группа ЛС, обладающих антибактериальной, противопаразитарной и противогрибковой активностью: Хинозол Хлорхинальдол
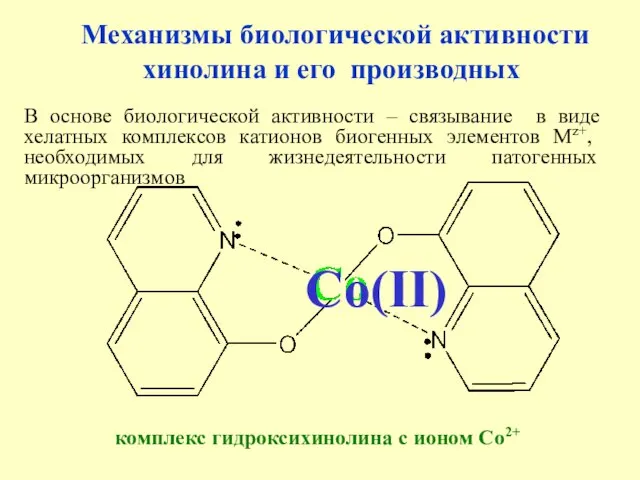
- 23. Механизмы биологической активности хинолина и его производных В основе биологической активности – связывание в виде хелатных
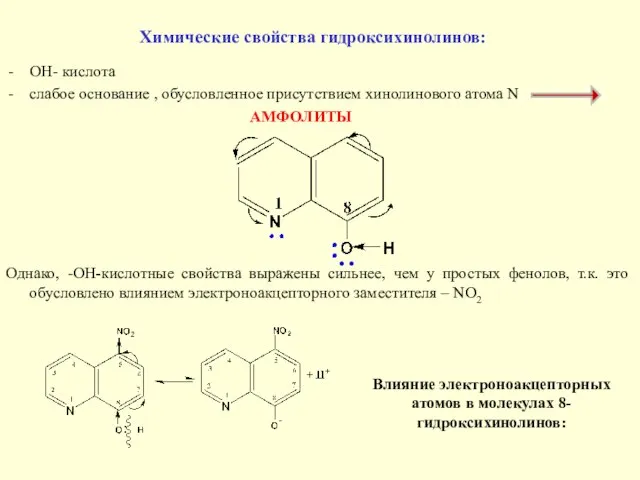
- 24. Химические свойства гидроксихинолинов: OH- кислота слабое основание , обусловленное присутствием хинолинового атома N АМФОЛИТЫ Однако, -ОН-кислотные
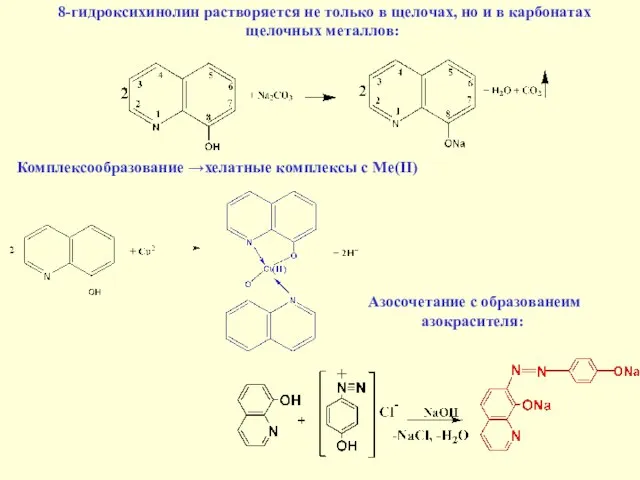
- 25. 8-гидроксихинолин растворяется не только в щелочах, но и в карбонатах щелочных металлов: Комплексообразование →хелатные комплексы с
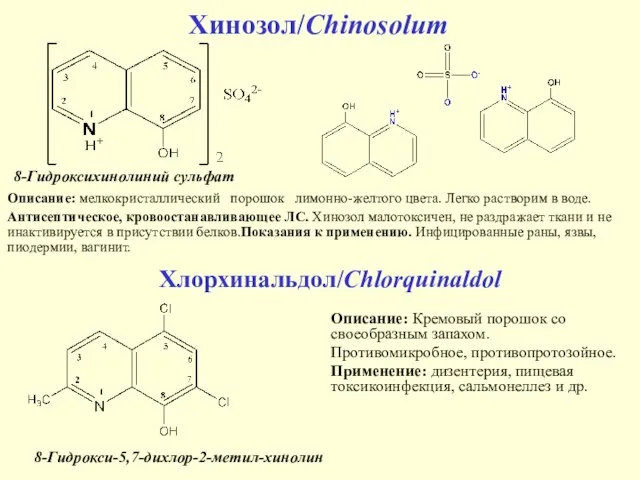
- 26. Хинозол/Chinosolum Описание: мелкокристаллический порошок лимонно-желтого цвета. Легко растворим в воде. Антисептическое, кровоостанавливающее ЛС. Хинозол малотоксичен, не
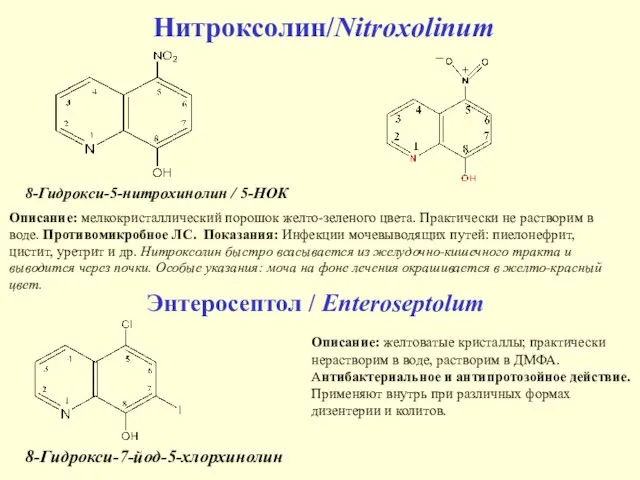
- 27. Нитроксолин/Nitroxolinum Описание: мелкокристаллический порошок желто-зеленого цвета. Практически не растворим в воде. Противомикробное ЛС. Показания: Инфекции мочевыводящих
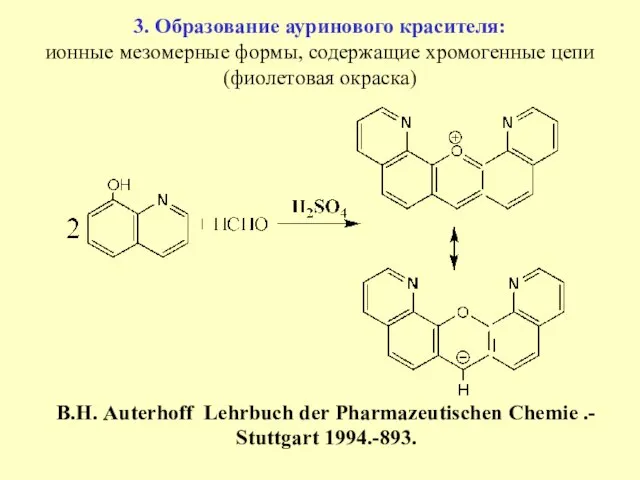
- 28. 3. Образование ауринового красителя: ионные мезомерные формы, содержащие хромогенные цепи (фиолетовая окраска) B.Н. Auterhoff Lehrbuch der
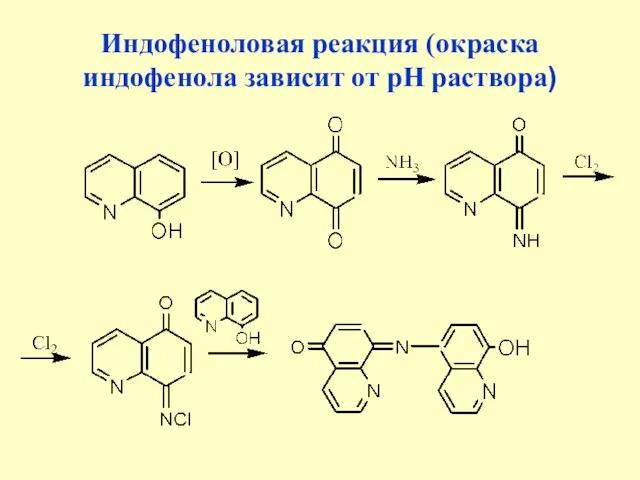
- 29. Индофеноловая реакция (окраска индофенола зависит от рН раствора)
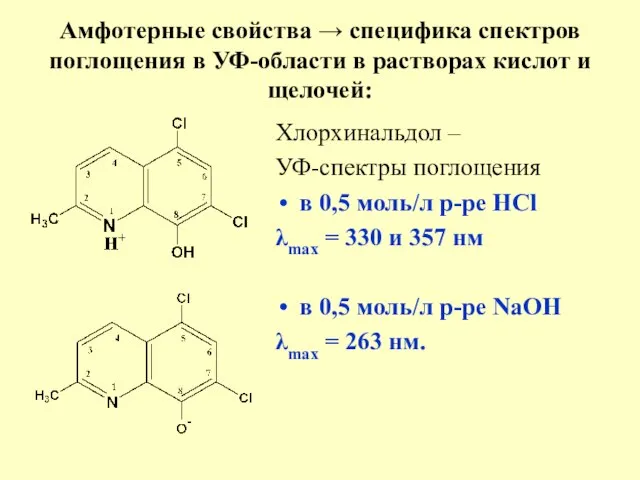
- 30. Амфотерные свойства → специфика спектров поглощения в УФ-области в растворах кислот и щелочей: Хлорхинальдол – УФ-спектры
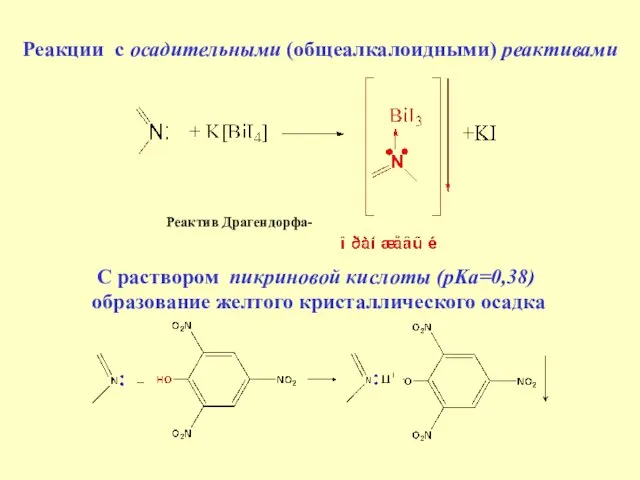
- 31. Реакции с осадительными (общеалкалоидными) реактивами Реактив Драгендорфа- С раствором пикриновой кислоты (pKa=0,38) образование желтого кристаллического осадка
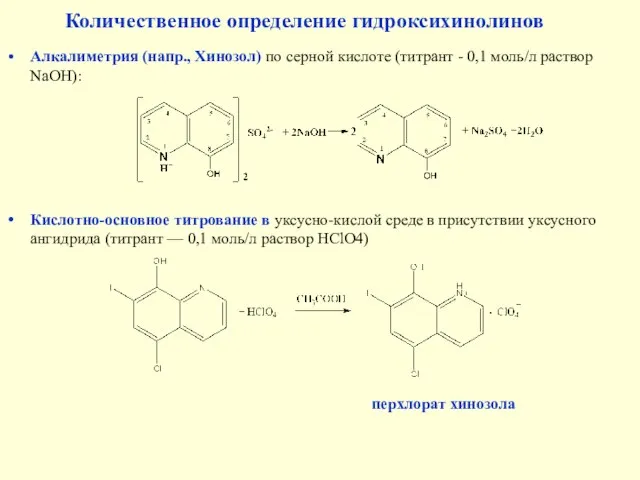
- 32. Алкалиметрия (напр., Хинозол) по серной кислоте (титрант - 0,1 моль/л раствор NaOH): Количественное определение гидроксихинолинов Кислотно-основное
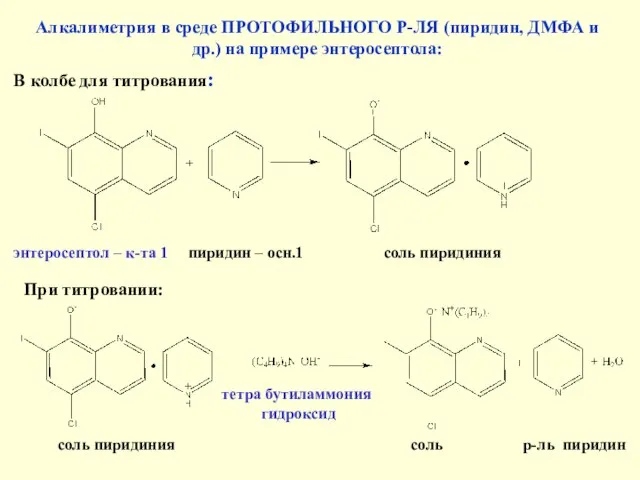
- 33. Алкалиметрия в среде ПРОТОФИЛЬНОГО Р-ЛЯ (пиридин, ДМФА и др.) на примере энтеросептола: В колбе для титрования:
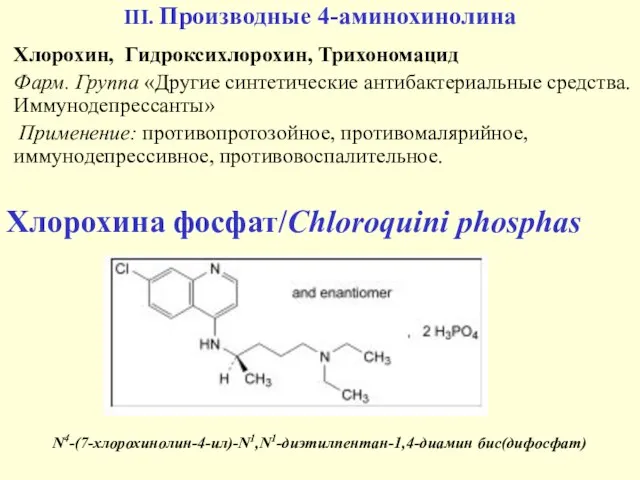
- 34. III. Производные 4-аминохинолина Хлорохин, Гидроксихлорохин, Трихономацид Фарм. Группа «Другие синтетические антибактериальные средства. Иммунодепрессанты» Применение: противопротозойное, противомалярийное,
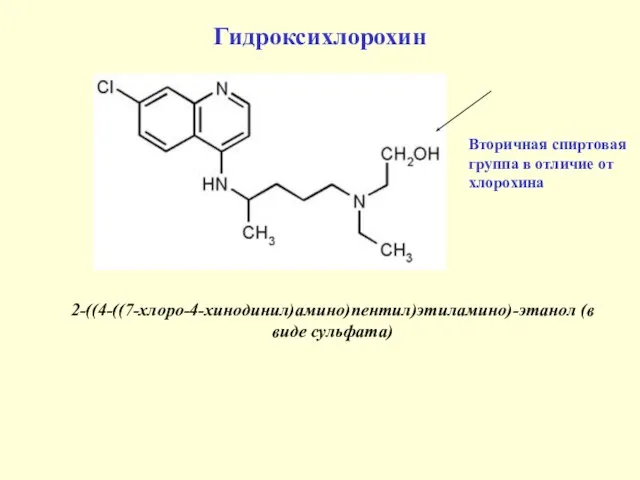
- 35. Гидроксихлорохин 2-((4-((7-хлоро-4-хинодинил)амино)пентил)этиламино)-этанол (в виде сульфата) Вторичная спиртовая группа в отличие от хлорохина
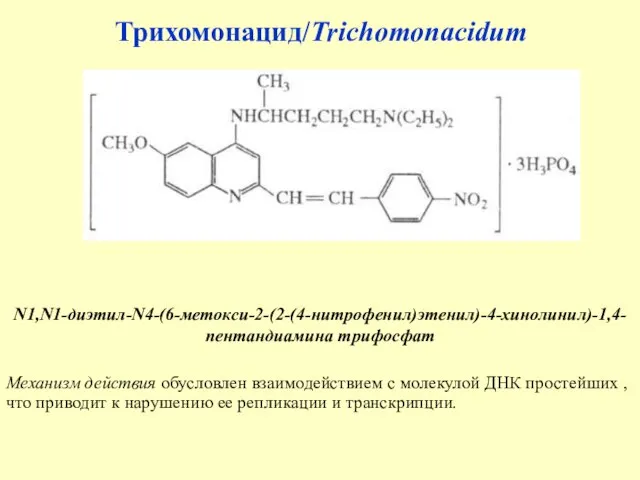
- 36. Трихомонацид/Trichomonacidum N1,N1-диэтил-N4-(6-метокси-2-(2-(4-нитрофенил)этенил)-4-хинолинил)-1,4-пентандиамина трифосфат Механизм действия обусловлен взаимодействием с молекулой ДНК простейших , что приводит к нарушению
- 37. Особенности анализа качества: Существует в 2-х кристаллических формах: Тпл = 198 0С и Тпл = 215
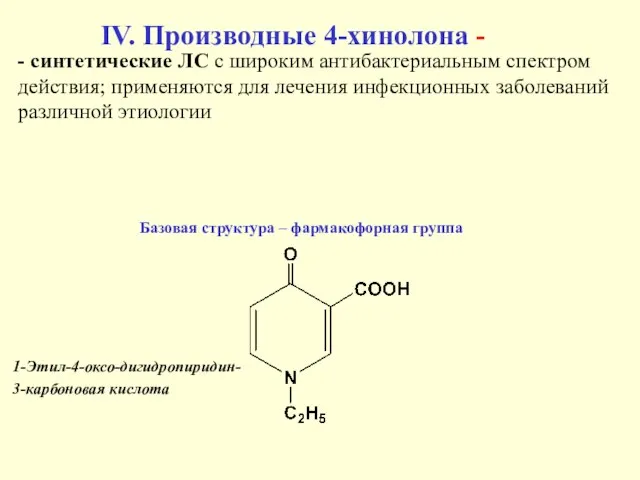
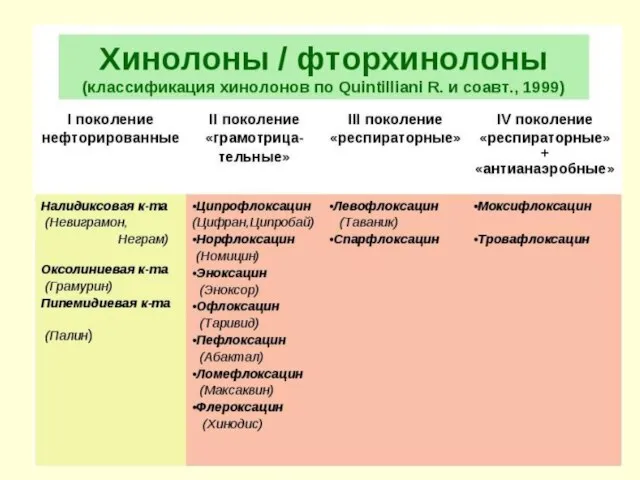
- 38. IV. Производные 4-хинолона - Базовая структура – фармакофорная группа 1-Этил-4-оксо-дигидропиридин- 3-карбоновая кислота - синтетические ЛС с
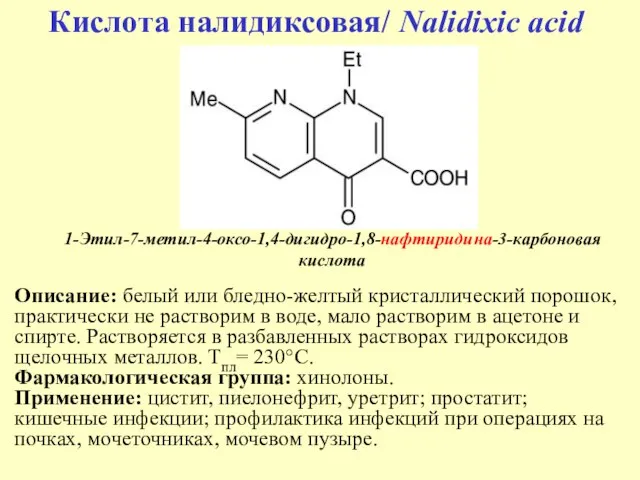
- 40. 1-Этил-7-метил-4-оксо-1,4-дигидро-1,8-нафтиридина-3-карбоновая кислота Кислота налидиксовая/ Nalidixic acid Описание: белый или бледно-желтый кристаллический порошок, практически не растворим в
- 41. Определение подлинности ИК-спектрометрия (Сравнить спектр с ИК-спектром СRS (Chemicаl Reference Substance) Налидиксовой кислоты). Хроматография в тонком
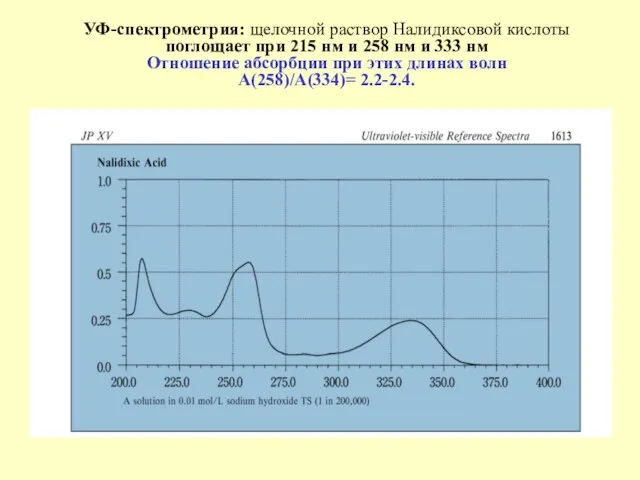
- 42. УФ-спектрометрия: щелочной раствор Налидиксовой кислоты поглощает при 215 нм и 258 нм и 333 нм Отношение
- 43. Кислота оксолиниевая/Acidum oxolinicum 5-этил-8-оксо-5,8-дигидро-1,3-диоксоло[4,5-g]-хинолин- 7-карбоновая кислота Описание: белый или желтоватый кристаллический порошок, практически нерастворим в воде
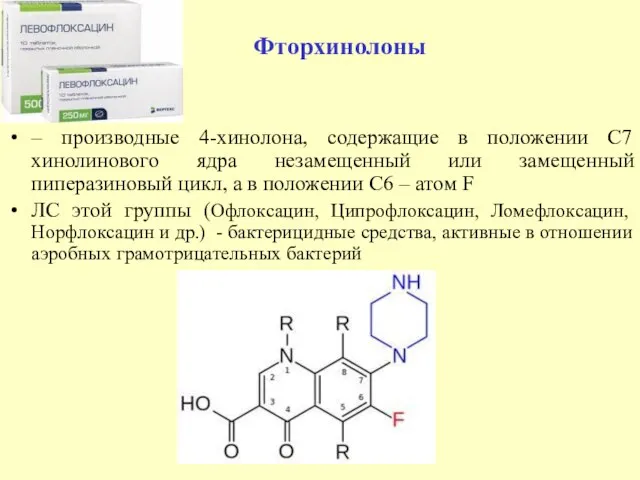
- 44. – производные 4-хинолона, содержащие в положении С7 хинолинового ядра незамещенный или замещенный пиперазиновый цикл, а в
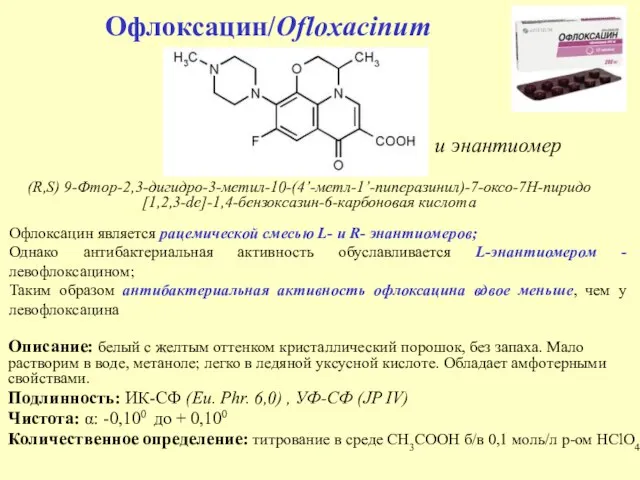
- 46. Офлоксацин/Ofloxacinum Описание: белый с желтым оттенком кристаллический порошок, без запаха. Мало растворим в воде, метаноле; легко
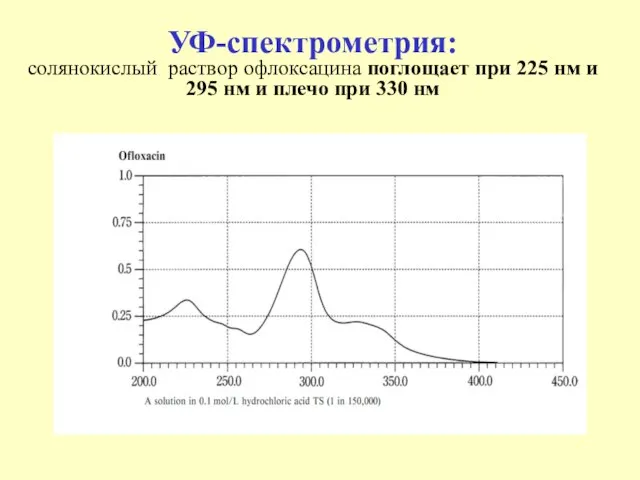
- 47. УФ-спектрометрия: солянокислый раствор офлоксацина поглощает при 225 нм и 295 нм и плечо при 330 нм
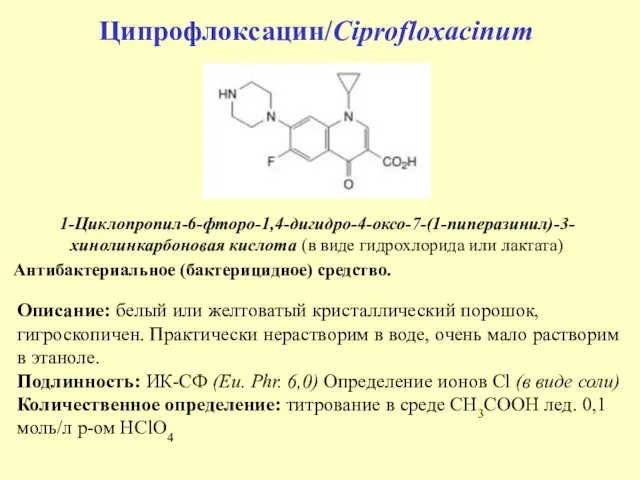
- 48. Ципрофлоксацин/Ciprofloxacinum 1-Циклопропил-6-фторо-1,4-дигидро-4-оксо-7-(1-пиперазинил)-3-хинолинкарбоновая кислота (в виде гидрохлорида или лактата) Антибактериальное (бактерицидное) средство. Описание: белый или желтоватый кристаллический
- 49. Испытания на чистоту Растворить 0,25 г субстанции в 0,1 моль/л хлороводородной кислоты, довести объем до 20
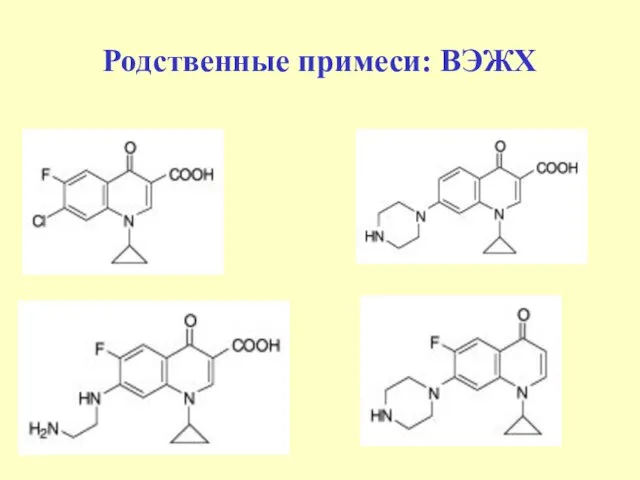
- 50. Родственные примеси: ВЭЖХ
- 52. Скачать презентацию



![Хинина гидрохлорид Chinini hydrochloridum (R)-[(2S,4S,5R)-5-этинил-1-азобицикло[2.2.2]окт-2-ил] (6-метоксихинолин-4-ил )метанол гидрохлорид Хинина сульфат Chinini sulfas](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382127/slide-14.jpg)
![Хинина сульфат Chinini sulfas Противомалярийное средство Хинидина сульфат Chinidini sulfas бис[(S)-[(2R,4S,5R)-5-этинил-1-азобицикло[ 2.2.2]окт-2-ил](6-метоксихинолин-4-ил)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382127/slide-15.jpg)





![Кислота оксолиниевая/Acidum oxolinicum 5-этил-8-оксо-5,8-дигидро-1,3-диоксоло[4,5-g]-хинолин- 7-карбоновая кислота Описание: белый или желтоватый кристаллический порошок,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382127/slide-42.jpg)


 Золотарь. Повышение уровня работоспособности
Золотарь. Повышение уровня работоспособности Формирование гендерной принадлежности детей дошкольного возраста
Формирование гендерной принадлежности детей дошкольного возраста Склонение имен существительных в упражнениях
Склонение имен существительных в упражнениях Обработка фрезерованием
Обработка фрезерованием Презентация на тему Финансы и кредит Денежная система
Презентация на тему Финансы и кредит Денежная система  Система применения минеральных удобрений под посев озимой пшеницы урожая 2013 года
Система применения минеральных удобрений под посев озимой пшеницы урожая 2013 года Презентация на тему Слово о полку Игореве
Презентация на тему Слово о полку Игореве  ПРОВОДЯЩИЕ ПОЛИМЕРЫ
ПРОВОДЯЩИЕ ПОЛИМЕРЫ Die vier Kerzen
Die vier Kerzen Презентация на тему Саранча
Презентация на тему Саранча  Толықтауыш
Толықтауыш Особенности радиоактивного заражения при авариях на АЭС
Особенности радиоактивного заражения при авариях на АЭС Транспортно-экспедиционная деятельность на автомобильном транспорте. Контейнерные перевозки
Транспортно-экспедиционная деятельность на автомобильном транспорте. Контейнерные перевозки Проведение ГИА-9 в 2012 году
Проведение ГИА-9 в 2012 году Презентация на тему Преподавание истории и обществознания в условиях открытой информационно-образовательной среды
Презентация на тему Преподавание истории и обществознания в условиях открытой информационно-образовательной среды Русский язык будет жить. Язык в эпоху Интернета
Русский язык будет жить. Язык в эпоху Интернета Веселые моменты школьной жизни
Веселые моменты школьной жизни С днём рождения!
С днём рождения! Урок-соревнование в 3 классе Тема: «Wir kennen Deutsch super – ich kenne Deutsch am besten!»
Урок-соревнование в 3 классе Тема: «Wir kennen Deutsch super – ich kenne Deutsch am besten!» Презентация на тему Города воинской славы
Презентация на тему Города воинской славы  Бизнес-планирование. Бассейн
Бизнес-планирование. Бассейн Восточный веер
Восточный веер Lection2
Lection2 Сохранение психологического здоровья учащихся
Сохранение психологического здоровья учащихся Social network
Social network Роль ШМО естественно – математического цикла в работе со слабоуспевающими учащимися
Роль ШМО естественно – математического цикла в работе со слабоуспевающими учащимися Урок литературы в 11 классе Учитель русского языка и литературы Бокова Лидия Александровна
Урок литературы в 11 классе Учитель русского языка и литературы Бокова Лидия Александровна Прыжки в высоту с разбега способом перешагивание. 5 класс
Прыжки в высоту с разбега способом перешагивание. 5 класс