Содержание
- 2. Классификация калийных удобрений - сырые калийные соли – размолотые природные водо-растворимые калийные минералы; - концентрированные калийные
- 3. В зависимости от природы аниона калийные удобрения подразделяются на хлоридные и бесхлорные. Хлоридные удобрения природные минералы
- 4. Сырьё для калийных удобрений 1. Сильвинит (NaCl×KCl) 2. Карналлит (КСl×МgСl2×6Н2О) 3. Лангбейнит (К2SО4×2МgSО4) 4. Каинит (КСl×МgSО4×3Н2О)
- 5. Производство хлорида калия галургическим способом
- 6. Принципиальная схема переработки сильвинитовых руд включает следующие основные операции: выщелачивание измельчённого сильвинита горячим маточным раст-вором, полученным
- 7. Выщелачивание хлорида калия из сильвинита
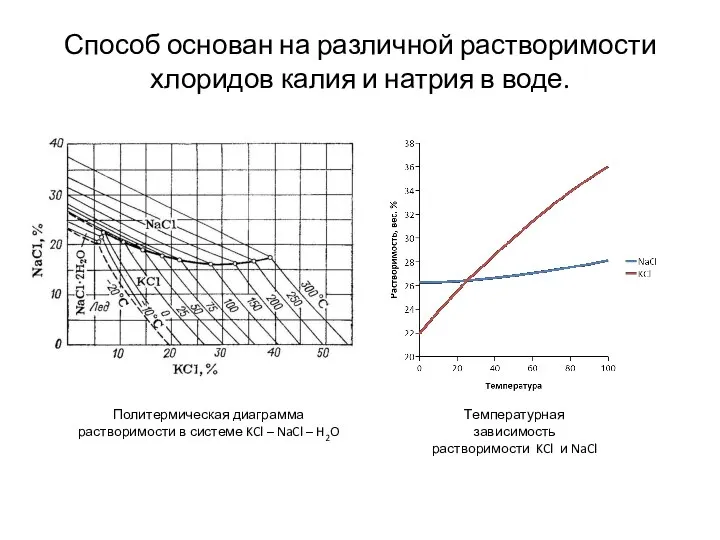
- 8. Способ основан на различной растворимости хлоридов калия и натрия в воде. Политермическая диаграмма растворимости в системе
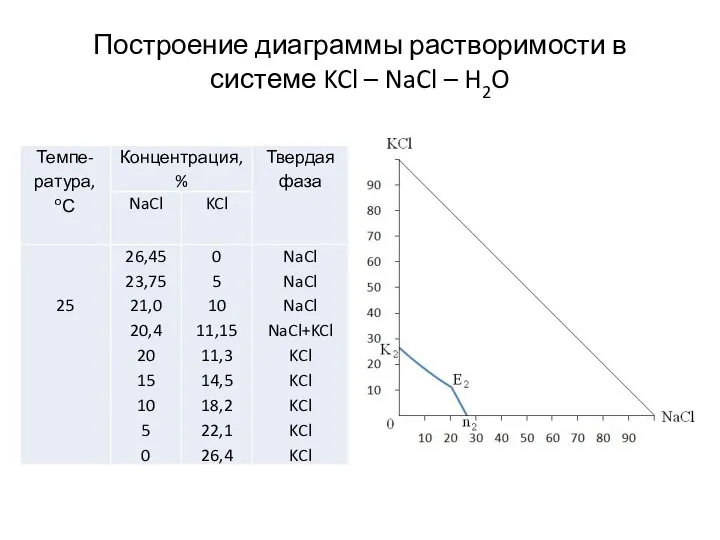
- 9. Построение диаграммы растворимости в системе KCl – NaCl – H2O
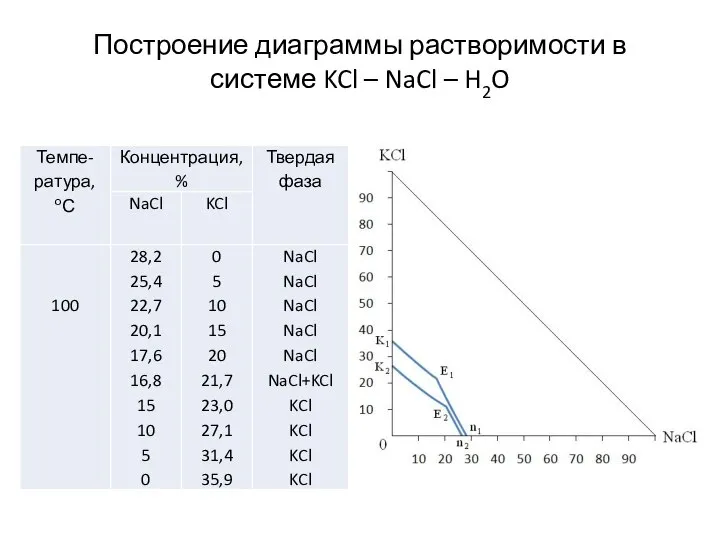
- 10. Построение диаграммы растворимости в системе KCl – NaCl – H2O
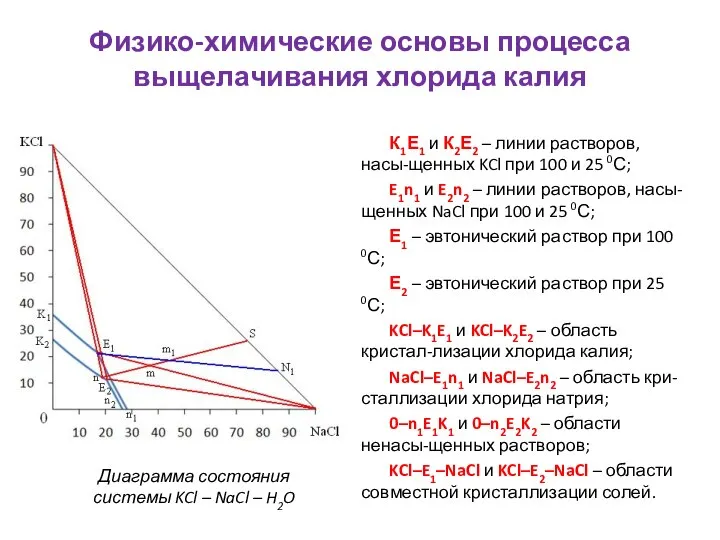
- 11. Физико-химические основы процесса выщелачивания хлорида калия К1Е1 и К2Е2 – линии растворов, насы-щенных KCl при 100
- 12. Правила пользования диаграммой выбрать фигуративную точку первоначально взятой системы; провести поля кристаллизации при той температуре, до
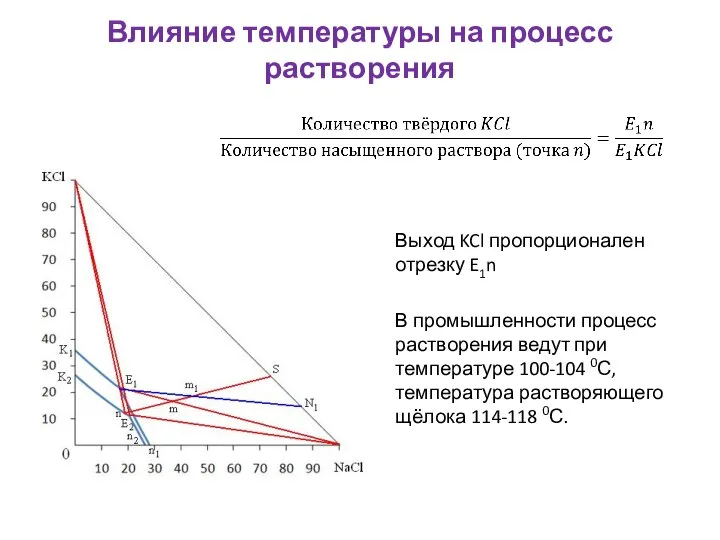
- 13. Влияние температуры на процесс растворения Выход KCl пропорционален отрезку E1n В промышленности процесс растворения ведут при
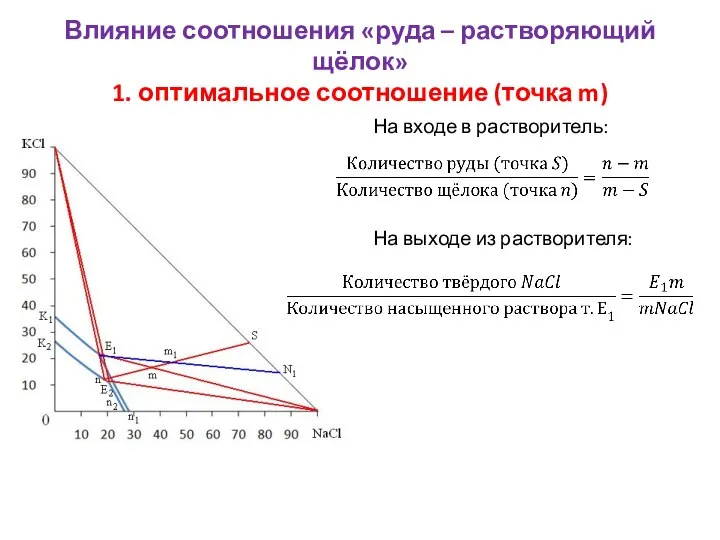
- 14. Влияние соотношения «руда – растворяющий щёлок» 1. оптимальное соотношение (точка m) На входе в растворитель: На
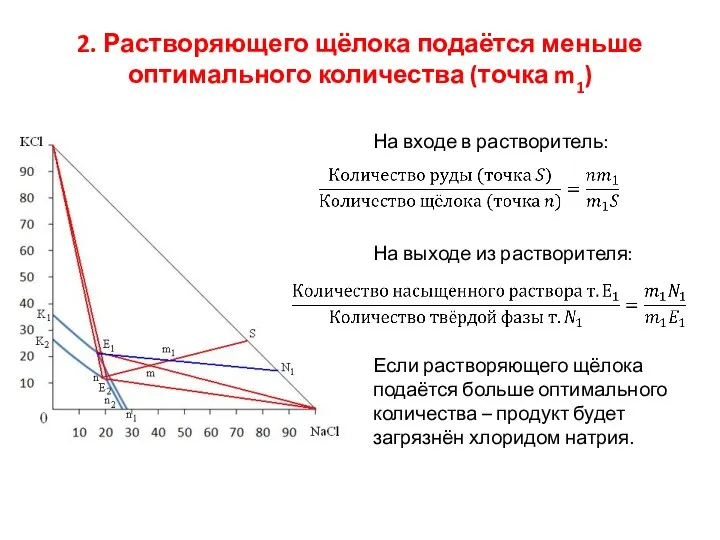
- 15. 2. Растворяющего щёлока подаётся меньше оптимального количества (точка m1) На входе в растворитель: На выходе из
- 16. Влияние состава растворяющего щёлока Растворяющий щёлок должен быть насыщен по ионам натрия и не насы-щен по
- 17. 1. Дисперсность руды, подаваемой на выщелачивание При прочих равных условиях интенсивность растворения будет во-зрастать при увеличении
- 18. 2. Температурный режим растворения Играет очень важную роль, поскольку при повышении температуры увеличивается концентрация насыщения хлорида
- 19. 3. Режим перемешивания Так как хлорид калия растворяется по закону диффузионной кинетики, для увеличения скорости диффузии
- 20. 5. Режим растворения Степень насыщения щёлока и количество нерастворённого KCl в отвале зависят от принятого режима
- 21. 5. Режим растворения В режиме прямотока свежий маточный раствор встречает руду, богатую хлоридом калия, поэтому создаются
- 22. 5. Режим растворения В большинстве случаев в качестве оптимальной выбирают комбини-рованную схему растворения, по которой в
- 23. Кристаллизация хлорида калия
- 24. Кристаллизация хлорида калия Процесс кристаллизации хлорида калия состоит из двух этапов: период образования зародышей и период
- 25. Кристаллизация хлорида калия Для кристаллизации необходимо создать в системе пересыщение. При быстром пересыщении (быстрое охлаждение или
- 26. Кристаллизация хлорида калия На калийных предприятиях кристаллизацию проводят в многоступенча-тых вакуум-кристаллизационных установках с рекуперацией тепла раствор-ного
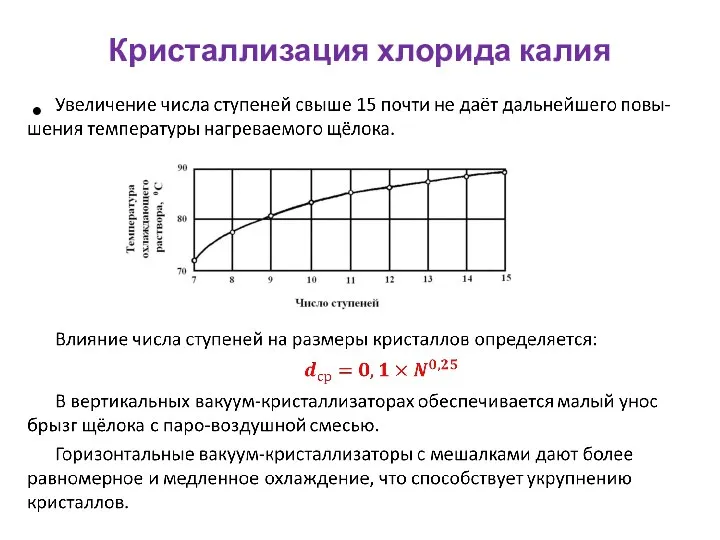
- 27. Кристаллизация хлорида калия Скорость охлаждения и перепад температур при ступенчатой кристалли-зации значительно снижаются, что способствует увеличению
- 28. Кристаллизация хлорида калия
- 29. Кристаллизация хлорида калия Присутствие в растворе взвешенных частиц шлама повышает вероятность образования центров кристаллизации и влечёт
- 30. Кристаллизация хлорида калия Присутствие этой фракции повышает пыление продукта, поэтому размер частиц 0,150 мм является предельным
- 31. Технологическая схема галургического способа производства хлорида калия
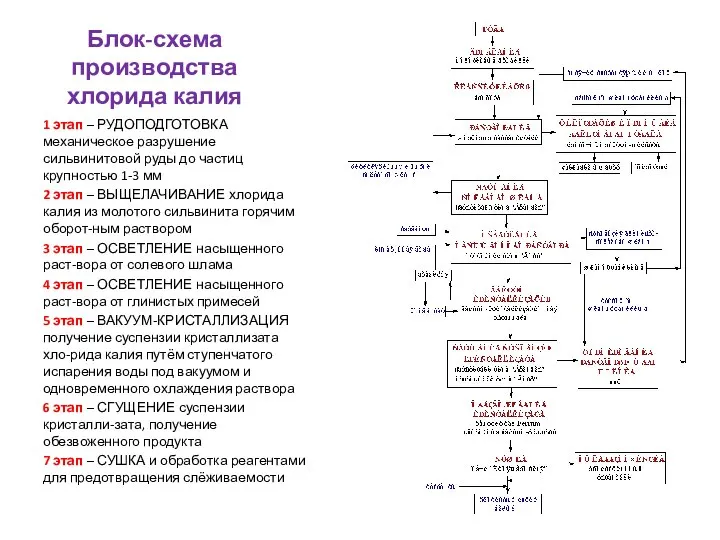
- 32. Блок-схема производства хлорида калия 1 этап – РУДОПОДГОТОВКА механическое разрушение сильвинитовой руды до частиц крупностью 1-3
- 33. Производство хлорида калия из карналлита
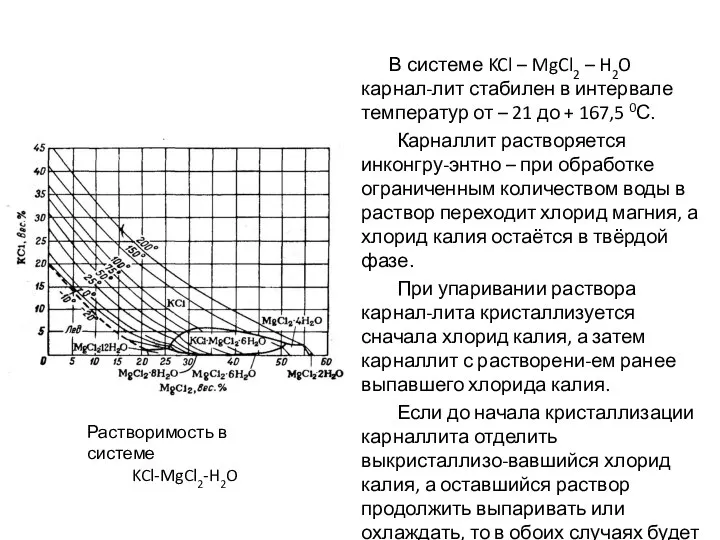
- 34. В системе KCl – MgCl2 – H2O карнал-лит стабилен в интервале температур от – 21 до
- 35. Методы переработки карналлита 1. Метод полного растворения заключаются в полном растворении карналлитовой руды горячим обо-ротным щёлоком,
- 36. Методы переработки карналлита 2. Метод неполного растворения Способы неполного растворения, при которых хлорид калия полностью не
- 37. Холодное разложение карналлита ведут обработкой его водой или оборотным щёлоком без нагревания, причём большая часть хлорида
- 38. Растворение «на конечный щёлок» или горячее шламовое разло-жение заключается в обработке карналлитовой руды маточным щёлоком при
- 39. Производство хлорида калия флотационным способом
- 40. Флотация – метод обогащения, заключающийся в разделении минералов измельчённой руды на основе различной способности их удерживаться
- 41. Виды флотации: масляная флотация заключается в избирательном смачивании частиц минерала диспергированным в воде жидким маслом. Образующиеся
- 42. Виды флотации: пенная флотация – пульпа насыщается пузырьками газа (воздуха). Флоти-рующиеся частицы закрепляются на пузырьках и
- 43. Агрегаты, состоящие из пузырьков воздуха и частиц минерала, относи-тельно устойчивы. При флотации свободная энергия системы уменьшается.
- 44. Особенности флотационного процесса 1. В отличие от других методов обогащения, отсутствуют принципи-альные ограничения использования флотации для
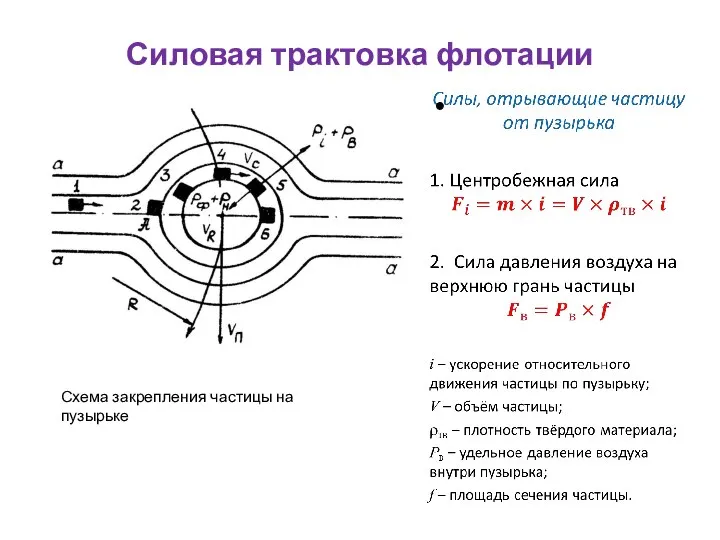
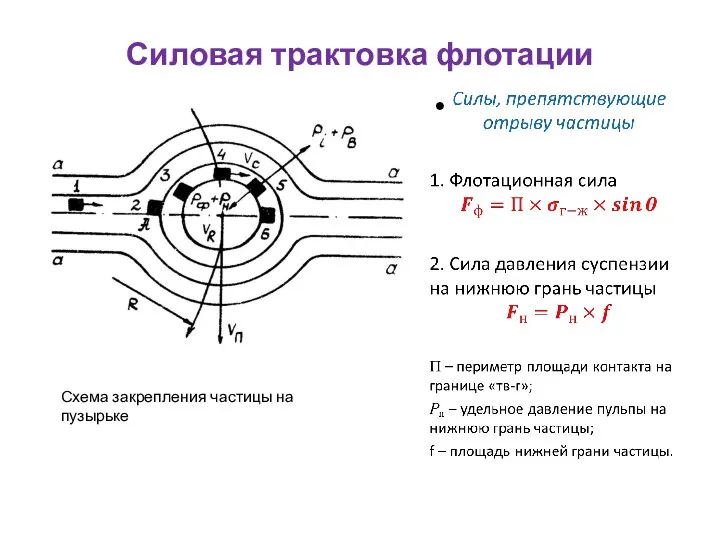
- 45. Силовая трактовка флотации Схема закрепления частицы на пузырьке
- 46. Силовая трактовка флотации Схема закрепления частицы на пузырьке
- 47. Двойной электрический слой Взаимодействие воды и присутствующих в ней ионов с минералами может изменить не только
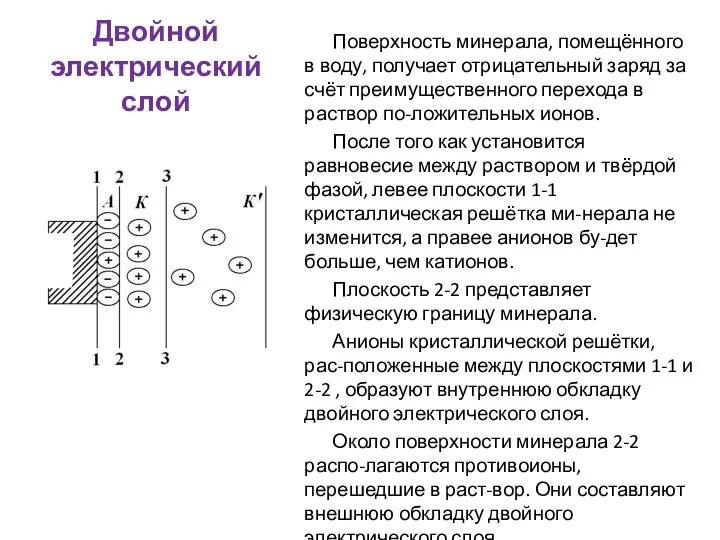
- 48. Двойной электрический слой Поверхность минерала, помещённого в воду, получает отрицательный заряд за счёт преимущественного перехода в
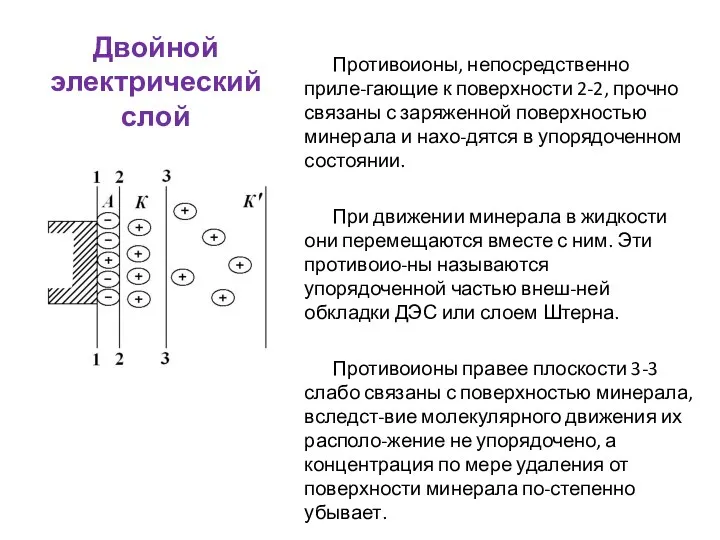
- 49. Двойной электрический слой Противоионы, непосредственно приле-гающие к поверхности 2-2, прочно связаны с заряженной поверхностью минерала и
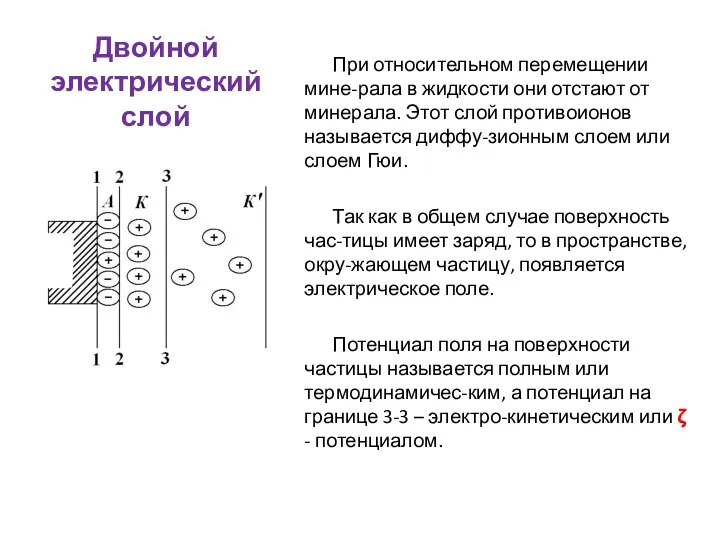
- 50. Двойной электрический слой При относительном перемещении мине-рала в жидкости они отстают от минерала. Этот слой противоионов
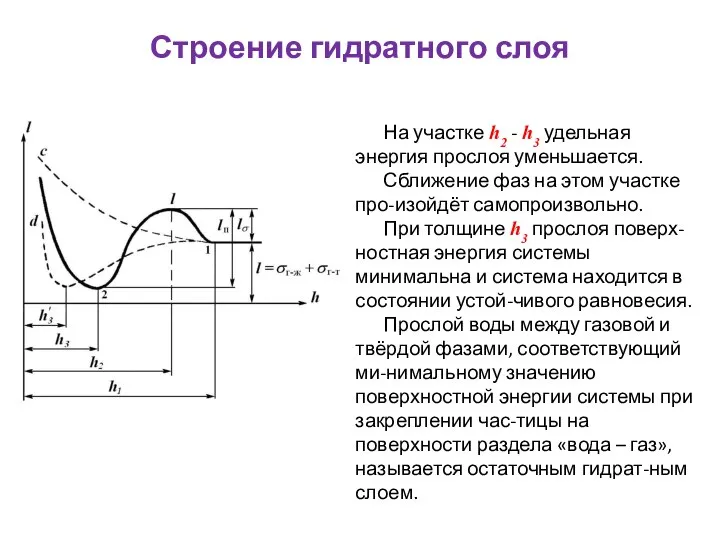
- 51. Строение гидратного слоя
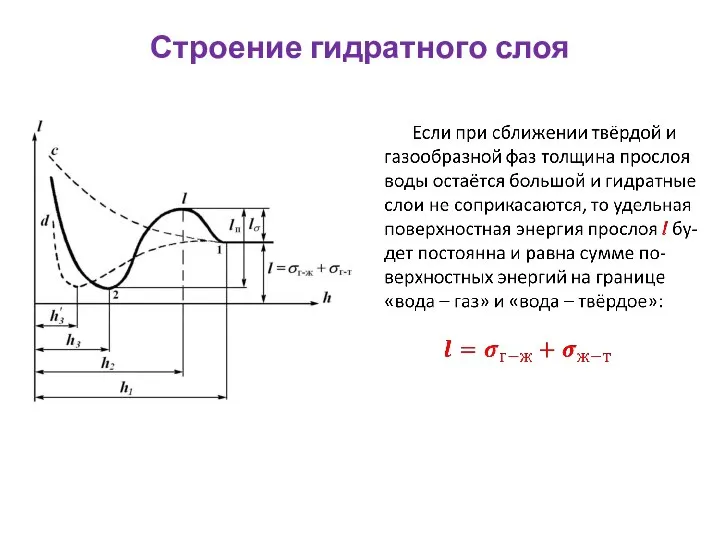
- 52. Строение гидратного слоя Как только произойдёт соприкосно-вение гидратных слоёв, при дальней-шем их сближении свойства промежу-точного слоя
- 53. Строение гидратного слоя На участке h2 - h3 удельная энергия прослоя уменьшается. Сближение фаз на этом
- 54. Строение гидратного слоя Пунктирные кривые c и d относятся к частным случаям зависимости l = f(h):
- 55. Стадии процесса флотации Пенофлотационный процесс состоит из следующих стадий: диффузия в растворе и селективная адсорбция коллектора
- 56. Минерализация воздушных пузырьков
- 57. Минерализация воздушных пузырьков
- 58. Размер пузырьков и прочность пены
- 59. Размер пузырьков и прочность пены Практика показывает, что оптимальная скорость подъёма минерали-зованных пузырьков находится в пределах
- 60. Размер пузырьков и прочность пены При очень хрупкой пене сфлотированные частицы «осыпаются» и вновь погружаются в
- 61. Флотореагенты Скорость флотации минералов в основном определяется показателем флотируемости, числом и размерами пузырьков воздуха, проходящих в
- 62. Флотореагенты Реагенты первого класса в зависимости от выполняемых функций под-разделяются на четыре группы: коллекторы (собиратели) –
- 63. Флотореагенты Реагенты второго класса, называемые пенообразователями (вспенива-телями), облегчают диспергирование воздуха на мелкие пузырьки, пре-пятствуют их слипанию
- 64. Стадии процесса обогащения 1 – Измельчение исходной руды для раскрытия зёрен сильвина и галита; 2 –
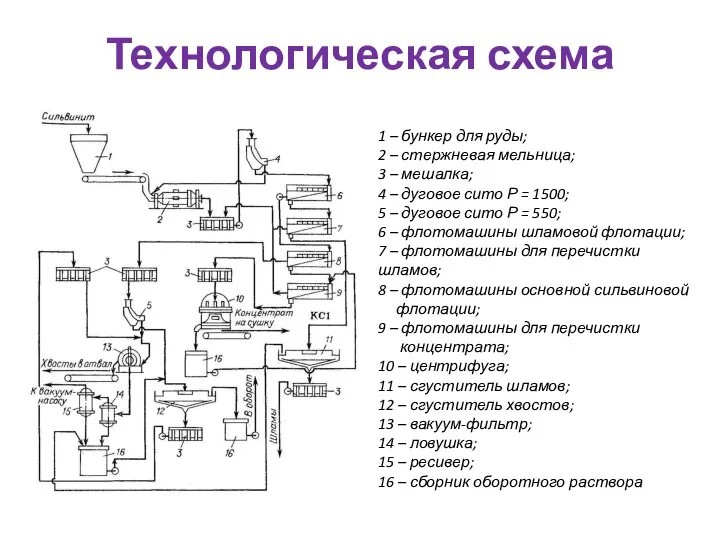
- 65. Технологическая схема 1 – бункер для руды; 2 – стержневая мельница; 3 – мешалка; 4 –
- 66. Сильвинит подвергается флотации в аппаратах, называемых флота-ционными машинами. Во флотомашинах происходит минерализация пузырьков воздуха и образование
- 67. Технологические критерии
- 68. Технологические критерии позволяют сравнивать технологию процесса без учёта производительности позволяет дать физическую и геометрическую интерпретацию процесса,
- 69. Критерий Т.Г. Фоменко
- 70. Бесхлорные калийные удобрения Производство сульфата калия
- 71. В качестве бесхлорных калийных удобрений применяют в основном сульфат калия и калимагнезию. В малых количествах используется
- 72. Способы получения сульфата калия 1) переработка галургическими методами – растворением и кристаллиза-цией полиминеральных сульфатнокалийных руд; 2)
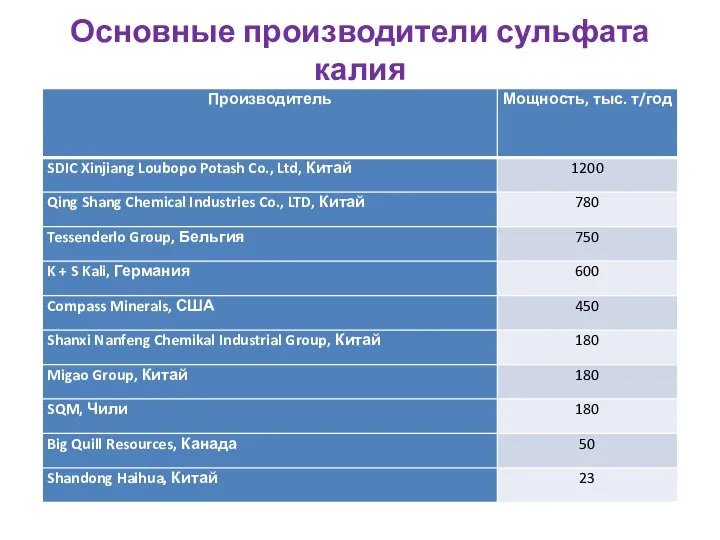
- 73. Основные производители сульфата калия
- 74. Конверсионный способ получения сульфата калия
- 75. Конверсионные способы получения сульфата калия основаны на реак-ции хлорида калия с соединениями, содержащими сульфат-ион, в основе
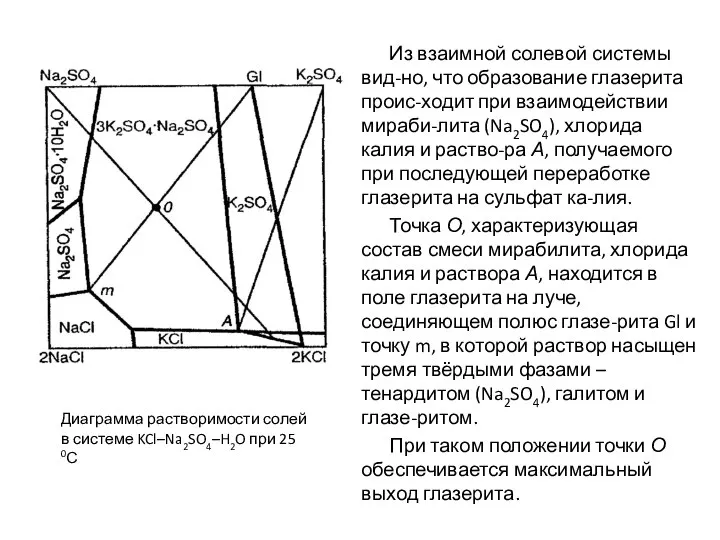
- 76. Из взаимной солевой системы вид-но, что образование глазерита проис-ходит при взаимодействии мираби-лита (Na2SO4), хлорида калия и
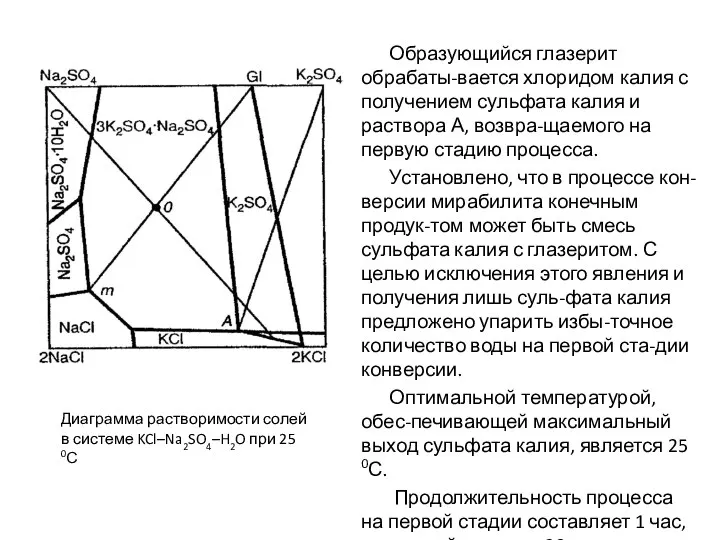
- 77. Образующийся глазерит обрабаты-вается хлоридом калия с получением сульфата калия и раствора А, возвра-щаемого на первую стадию
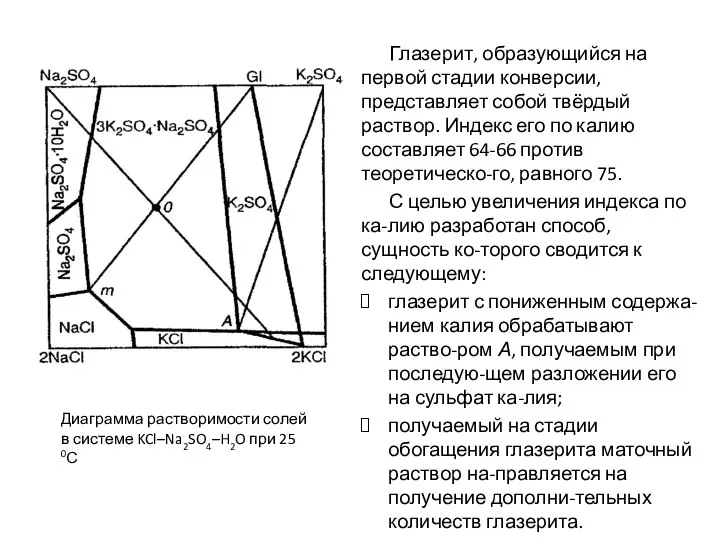
- 78. Глазерит, образующийся на первой стадии конверсии, представляет собой твёрдый раствор. Индекс его по калию составляет 64-66
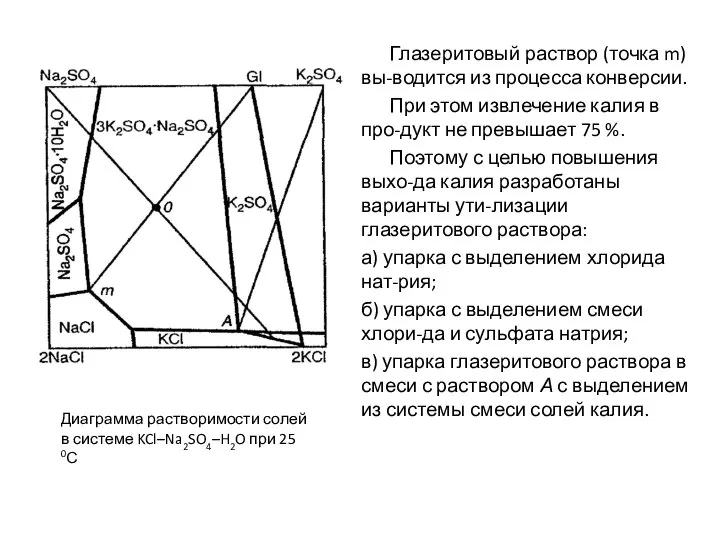
- 79. Глазеритовый раствор (точка m) вы-водится из процесса конверсии. При этом извлечение калия в про-дукт не превышает
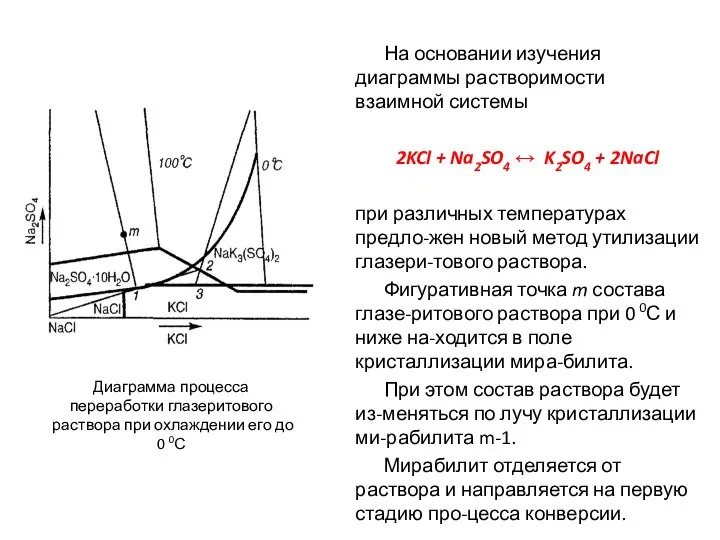
- 80. На основании изучения диаграммы растворимости взаимной системы 2KCl + Na2SO4 ↔ K2SO4 + 2NaCl при различных
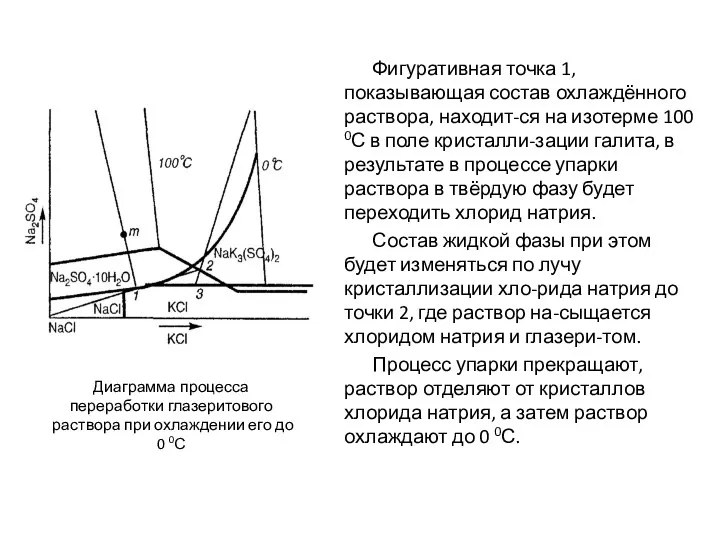
- 81. Фигуративная точка 1, показывающая состав охлаждённого раствора, находит-ся на изотерме 100 0С в поле кристалли-зации галита,
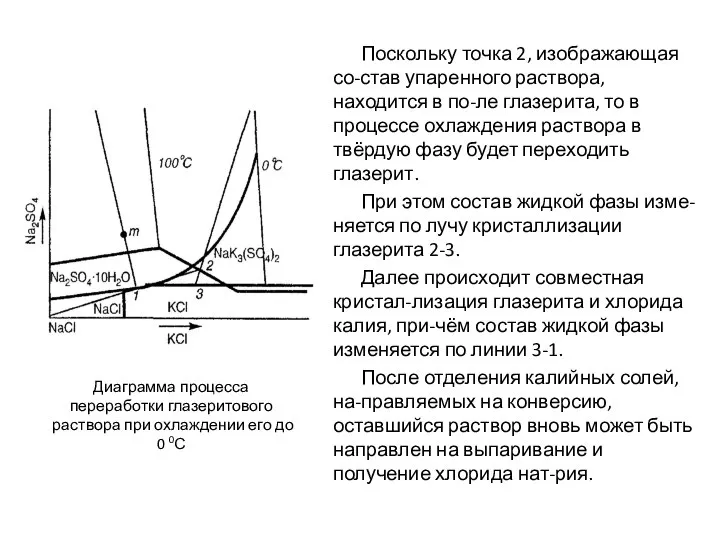
- 82. Поскольку точка 2, изображающая со-став упаренного раствора, находится в по-ле глазерита, то в процессе охлаждения раствора
- 84. Скачать презентацию























































 Лекторская группа СШ№11 г. Костаная
Лекторская группа СШ№11 г. Костаная ШКОЛЬНИКАМ ОБ ОЛИМПИАДЕ
ШКОЛЬНИКАМ ОБ ОЛИМПИАДЕ Генерирование и преобразование энергии Трансформаторы
Генерирование и преобразование энергии Трансформаторы 7 тоновых нот
7 тоновых нот Пистолеты-пулеметы
Пистолеты-пулеметы Болонский процесс: история и значение для России
Болонский процесс: история и значение для России Презентация на тему Шолохов «Донские рассказы»
Презентация на тему Шолохов «Донские рассказы» Особенности французской кухни.
Особенности французской кухни. Презентация на тему Светодиоды и полупроводниковые лазеры
Презентация на тему Светодиоды и полупроводниковые лазеры  рус.яз., 6кл., 22.09
рус.яз., 6кл., 22.09 Области применения комбинаторики
Области применения комбинаторики Социальная философия
Социальная философия Похождение Воланда и его свиты
Похождение Воланда и его свиты Ditch Witch Серия TK Система локации для ГНБ
Ditch Witch Серия TK Система локации для ГНБ Сервировка стола к обеду (9 класс)
Сервировка стола к обеду (9 класс) Презентация на тему Своя игра по астрономии
Презентация на тему Своя игра по астрономии  Kluchevskiy
Kluchevskiy Банковское право
Банковское право Безопасный вебсерфинг
Безопасный вебсерфинг Linux как необходимый элемент современного IT-образования
Linux как необходимый элемент современного IT-образования Атлас 7кл. Нов.в
Атлас 7кл. Нов.в Автоматизация Р в чистоговорках, скороговорках, стихах
Автоматизация Р в чистоговорках, скороговорках, стихах Презентация на тему Откуда хлеб пришел
Презентация на тему Откуда хлеб пришел  Мастер-класс Мышка из пластилина
Мастер-класс Мышка из пластилина Привлекательность региона для человеческого капитала
Привлекательность региона для человеческого капитала Презентация на тему ЧТОБЫ ПУТЬ БЫЛ СЧАСТЛИВЫМ
Презентация на тему ЧТОБЫ ПУТЬ БЫЛ СЧАСТЛИВЫМ  Функции аналитических служб государственных и муниципальных органов по обеспечению разработки управленческих решений
Функции аналитических служб государственных и муниципальных органов по обеспечению разработки управленческих решений Canada
Canada