Содержание
- 2. Цель урока: I. Дать понятие о реакциях замещения. II. Познакомить с: 1) электрохимическим рядом напряжений металлов;
- 3. Составить уравнения и расставить коэффициенты: 1. Оксид азота(V) + вода = азотная кислота 1. Оксид углерода(IV)
- 4. Вопросы. 1. Какие типы реакций по признаку «число и состав исходных веществ и продуктов реакции» вы
- 5. H H Cl Cl Вытеснение водорода из кислот. Zn Zn + 2HCl = ZnCl2 + H2
- 6. Электрохимический ряд напряжений Правило 1: Каждый из металлов, расположенных в ряду напряжений до водорода вытесняет водород
- 7. Вытеснение металлов из солей. Правило 2: В реакциях между металлами и солями: Каждый металл вытесняет из
- 8. Исключение из правил 1 и 2: 1. Металлы, расположенные до Al в водных растворах кислот и
- 9. Вопросы. 1. С каким типом реакций по признаку «число и состав исходных веществ и продуктов реакции»
- 10. Домашнее задание: § 31 Упр. 2, 3.
- 12. Скачать презентацию









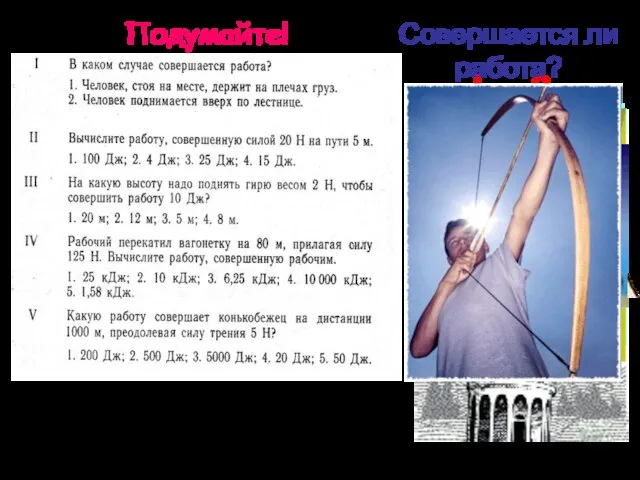 Мощность
Мощность Ершова Екатерина Алексеевна. Фотоальбом
Ершова Екатерина Алексеевна. Фотоальбом Презентация на тему Семь исторических камней Алмазного фонда России
Презентация на тему Семь исторических камней Алмазного фонда России Действие нормативных правовых актов во времени, в пространстве и по кругу лиц
Действие нормативных правовых актов во времени, в пространстве и по кругу лиц Сочинения учащихся о любимом ЯКУТСКЕ(к юбилею города)
Сочинения учащихся о любимом ЯКУТСКЕ(к юбилею города) Всероссийский Урок мужества_221013_153519
Всероссийский Урок мужества_221013_153519 Проект Со слэнгом на ты
Проект Со слэнгом на ты Алые паруса
Алые паруса Россия - мать, жена, сестра, невеста!
Россия - мать, жена, сестра, невеста! Review of passing registration by Russian companies and eSDS generating in practice
Review of passing registration by Russian companies and eSDS generating in practice Канал распределения
Канал распределения Теоретическая характеристика проблемы одаренности. Гений - это 1% таланта и 99% пота. Гете
Теоретическая характеристика проблемы одаренности. Гений - это 1% таланта и 99% пота. Гете Палладий
Палладий Классификация производств и технологий
Классификация производств и технологий Законы сохранения
Законы сохранения O mamaclub.ua mamaclub.ua – это клуб, дарящий тепло и доброту для женщин, которые заботятся о себе и своей семье; 25 000 посетителей в неделю* 65 000.
O mamaclub.ua mamaclub.ua – это клуб, дарящий тепло и доброту для женщин, которые заботятся о себе и своей семье; 25 000 посетителей в неделю* 65 000. СИСТЕМА НАЦИОНАЛЬНЫХ СЧЕТОВ
СИСТЕМА НАЦИОНАЛЬНЫХ СЧЕТОВ Художественная культура XVIII века. Живопись Италии
Художественная культура XVIII века. Живопись Италии Общероссийское движение«Женщины за безопасный мир»
Общероссийское движение«Женщины за безопасный мир» Построение диаграмм и графиков функций
Построение диаграмм и графиков функций Электрическая энергия: проблемы экологии
Электрическая энергия: проблемы экологии Не с разными словами
Не с разными словами Девятые Московские областные Рождественские образовательные чтения «Через просвещение к нравственности»
Девятые Московские областные Рождественские образовательные чтения «Через просвещение к нравственности» Подарите себе Таллинн! Enterprise Estonia / Brilliant / Corpore / Imageland North-West
Подарите себе Таллинн! Enterprise Estonia / Brilliant / Corpore / Imageland North-West Назначение, боевые свойства, устройство и принцип работы автомата Калашникова АК-74
Назначение, боевые свойства, устройство и принцип работы автомата Калашникова АК-74 ХИМИЯ НЕФТИ И ГАЗА
ХИМИЯ НЕФТИ И ГАЗА Инструменты для управления отношениями с клиентами в конкурентной среде
Инструменты для управления отношениями с клиентами в конкурентной среде Волшебник изумрудного города
Волшебник изумрудного города