Содержание
- 2. Цель урока: Повторить и закрепить знания учащихся о свойствах кислотных оксидов и кислот. Рассмотреть свойства соединения
- 3. Получение оксидов 1. Горение веществ (Окисление кислородом) а) простых веществ Mg +O2=2MgO S+O2=SO2 б) сложных веществ
- 4. 1)Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV) 2H2S-2 +
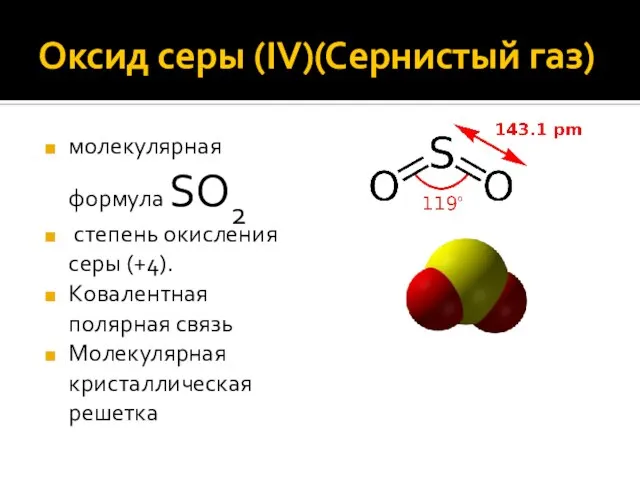
- 5. Оксид серы (IV)(Сернистый газ) молекулярная формула SО2 степень окисления серы (+4). Ковалентная полярная связь Молекулярная кристаллическая
- 6. Электронный баланс 1)S-2 -6е→ S+4 Восстановитель O2+4е → 2O -2 Окислитель 2) S0 -4е→ S+4 Восстановитель
- 7. Определение плотности по воздуху. Д воздух -? М(Воздух)= 29 г/моль М(H2S)=64г/моль Д воздух = 64:29=2,21 Д
- 8. Получение сернистого газа в промышленности. сжигание серы или обжиг сульфидов, в основном — пирита: 4FeS2+ 11O2
- 9. Получение оксида серы (IV) в лабораторных условиях воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая
- 10. Физические свойства. Оксид серы (IV), или сернистый газ, при нормальных условиях представляет собой бесцветный газ с
- 11. Нахождение в природе
- 12. Химические свойства кислотных оксидов ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 1. Кислотный оксид +Вода= Кислота (р. соединения) СO2
- 13. Химические свойства оксида серы (IV) 1. Кислотный оксид +Вода= Кислота SO2 + H2O = H2SO3 2.
- 14. Окислительные свойства оксида серы (IV). 2H2S-2 + S +4O2 → 2H2O + 3S 0 S+4 +4е→
- 15. Восстановительные свойства оксида серы (IV) 2SO2+ O2 = 2SO2 SO2 + Br2 + 2H2O = H2
- 16. Применение оксида серы (IV). Большая часть оксида серы (IV) используется для производства серной кислоты. Используется также
- 17. Физиологическое действие на организм. SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость,
- 18. Воздействие на атмосферу. Из-за образования в больших количествах в качестве отходов диоксид серы является одним из
- 20. Скачать презентацию
















 Лесоразведение как альтернатива существующим практикам хозяйствования и адаптация к меняющимся климатическим условиям на приме
Лесоразведение как альтернатива существующим практикам хозяйствования и адаптация к меняющимся климатическим условиям на приме Toys, counting 1-7
Toys, counting 1-7 Формирование критического мышления в процессе обучения истории и обществознанию
Формирование критического мышления в процессе обучения истории и обществознанию Международный день образования
Международный день образования «Дело-КС» Автоматизация делопроизводства
«Дело-КС» Автоматизация делопроизводства Развитие представлений о строении атома
Развитие представлений о строении атома Теория графов
Теория графов ФУНКЦИОНАЛЬНЫЕМОДУЛИ
ФУНКЦИОНАЛЬНЫЕМОДУЛИ Откуда в нашем доме тепло?
Откуда в нашем доме тепло? Корінь. Спільнокореневі слова
Корінь. Спільнокореневі слова Дома бывают разные
Дома бывают разные ув
ув Молоко и кисломолочные продукты
Молоко и кисломолочные продукты Презентация на тему Животные Тундры
Презентация на тему Животные Тундры  ООП ФГОС ДО
ООП ФГОС ДО IX Международный семинар по проблемам ускорителей заряженных частиц памяти В.П.Саранцева
IX Международный семинар по проблемам ускорителей заряженных частиц памяти В.П.Саранцева Управление рисками и контроль выполнения политики безопасности с помощью системы ІР-Guard
Управление рисками и контроль выполнения политики безопасности с помощью системы ІР-Guard Подготовка к сочинению-рассуждению ОГЭ 2016
Подготовка к сочинению-рассуждению ОГЭ 2016 Какие изменения ждут ребенка в 1 классе?
Какие изменения ждут ребенка в 1 классе? ТРЕБОВАНИЯК СТРУКТУРЕ ОСНОВНЫХ ОБРАЗОВАТЕЛЬНЫХ ПРОГРАММ
ТРЕБОВАНИЯК СТРУКТУРЕ ОСНОВНЫХ ОБРАЗОВАТЕЛЬНЫХ ПРОГРАММ Су құбырлы электржетегтерді ауылшаруашылығында пайдыланылуы (водопровод с элетроприводом)
Су құбырлы электржетегтерді ауылшаруашылығында пайдыланылуы (водопровод с элетроприводом) Возможности систем «Трактиръ»
Возможности систем «Трактиръ» Презентация на тему Методы исследования в биологии
Презентация на тему Методы исследования в биологии  Микробиоценоз полости рта. Препараты БактоБЛИС и ДентобЛИС
Микробиоценоз полости рта. Препараты БактоБЛИС и ДентобЛИС Я выбираю здоровый образ жизни
Я выбираю здоровый образ жизни Право. Основные понятия
Право. Основные понятия Фигурное катание
Фигурное катание B2B TRANS
B2B TRANS