Содержание
- 2. Щелочные металлы Название получили от гидроксидов щелочных металлов, названных едкими щелочами.
- 3. 19 ноября 1907 года в Лондоне на заседании Королевского химического общества сэр Хемфри Деви объявил об
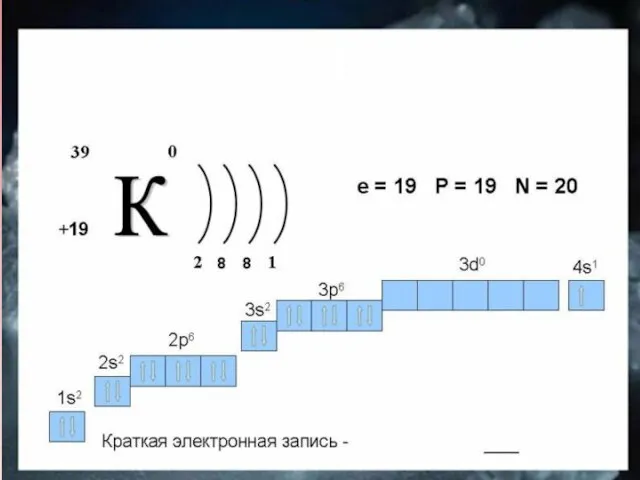
- 4. Дать характеристику элементам IA группы по их положению в периодической системе химических элементов. На основе строения
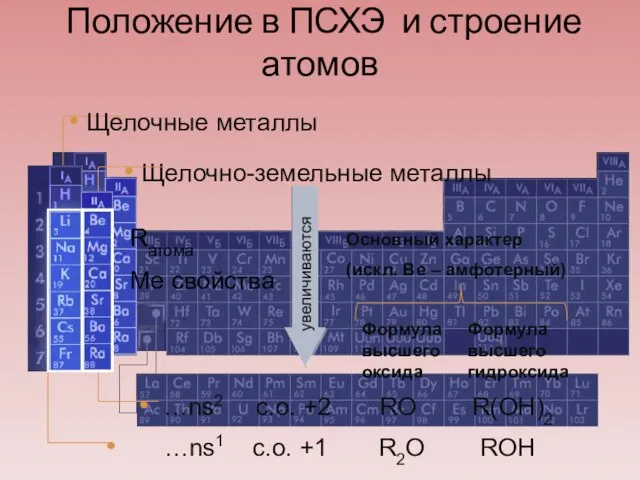
- 5. Положение в ПСХЭ и строение атомов Rатома Ме свойства Щелочно-земельные металлы Щелочные металлы Формула высшего оксида
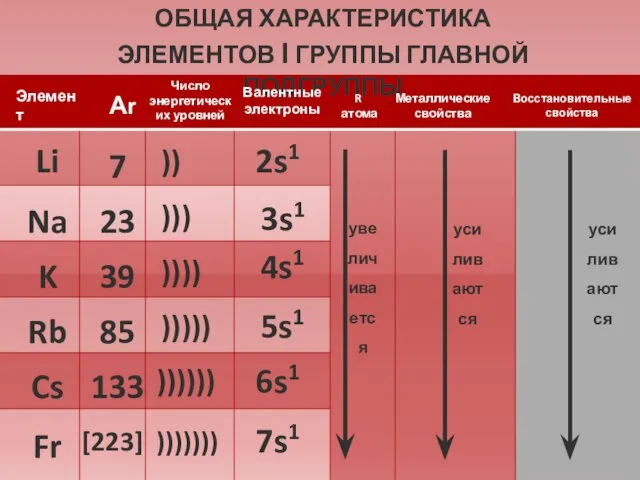
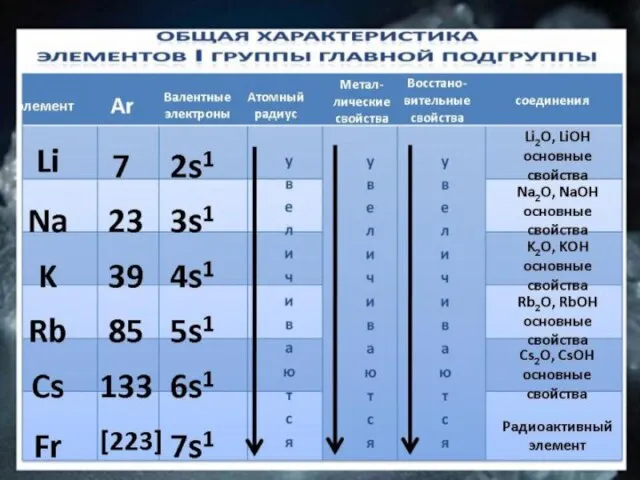
- 7. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ Li Na K Rb Cs Fr 7 23 39
- 9. ЩЕЛОЧНЫЕ МЕТАЛЛЫ В ПРИРОДЕ каменная Глауберова сильвинит карналлит NaCl –поваренная (каменная) соль Na2SO4 ∙ 10H2O –
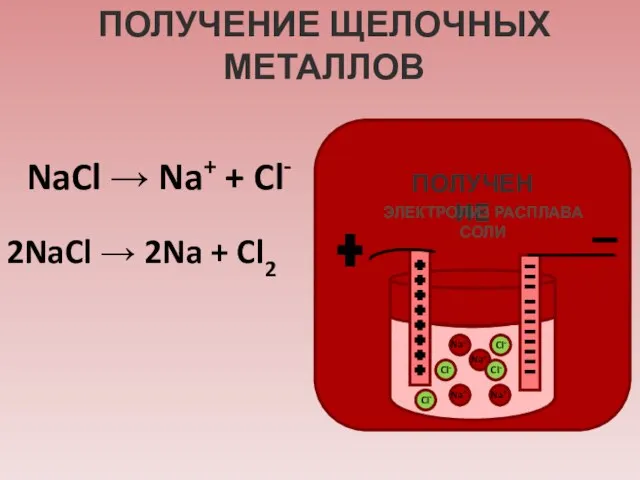
- 10. ПОЛУЧЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗ РАСПЛАВА СОЛИ NaCl → Na+ + Cl- 2NaCl → 2Na +
- 11. I A Щелочные металлы
- 16. Химический недотрога Рубидий - металл, который можно назвать химической недотрогой. От соприкосновения с воздухом он самопроизвольно
- 19. Интересные факты о франции Среди элементов, стоящих в конце периодической системы Д.И. Менделеева, есть такие, о
- 20. Еще один интересный факт о франции Помимо ртути, жидкими при комнатной температуре могут быть также галлий,
- 21. Франций в медицине франций может быть чрезвычайно полезен в медицине. С его помощью можно определить присутствие
- 22. ФИЗИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ МЕТАЛЛИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА Все металлы очень активны, поэтому их хранят в запаянных
- 23. Хранение щелочных металлов
- 24. Физические свойства Литий, натрий, калий, рубидий в свободном состоянии серебристо-белые металлы, цезий имеет золотисто-желтый цвет. Все
- 25. ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ Почему щелочные металлы не используют для реакции с растворами кислот и солей?
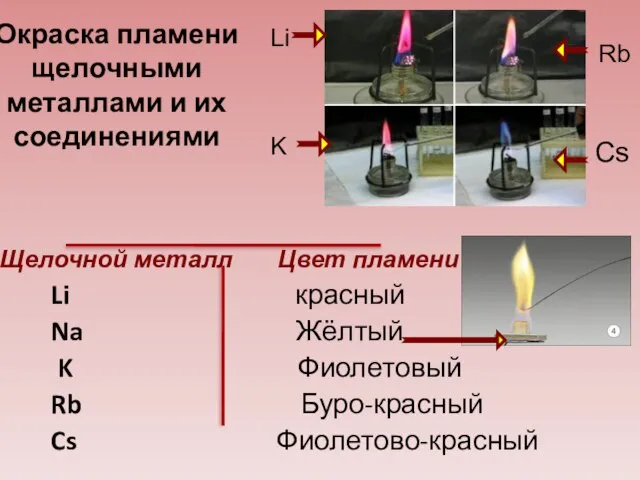
- 26. Щелочной металл Цвет пламени Li красный Na Жёлтый K Фиолетовый Rb Буро-красный Cs Фиолетово-красный Li Rb
- 27. Химические свойства 1. С кислородом (Rb, Cs – самовоспламеняются) 2Na+O2?Na2O2 (пероксиды) 2K+2O2?K2O4 (надпероксиды) 4Li+O2?2Li2O (оксид лития)
- 28. Химические свойства 4.Литий взаимодействует с азотом при о.у. ( Другие при t) 6Li+N2 = 2Li3N (
- 29. Химические свойства 7. С кислотами Щелочные металлы очень бурно взаимодействуют с растворами кислот, так как одновременно
- 30. БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ СОЕДИНЕНИЙ КАЛИЯ И НАТРИЯ ответ ответ ответ NaCl Кристалли-ческая сода Na2CO3*10H2O Питьевая
- 31. Тривиальные названия соединений NaCl - поваренная соль (каменная соль), галит Na2SO4 •10H2O - глауберова соль NaNO3
- 32. Проверь себя: ☺ Вычеркните неверное суждение о щелочных металлах: 1. Число электронов на внешнем энергетическом уровне
- 33. Литературная загадка В Ветхом Завете упоминается некое вещество «нетер». Оно употреблялось (по современной терминологии) как моющее
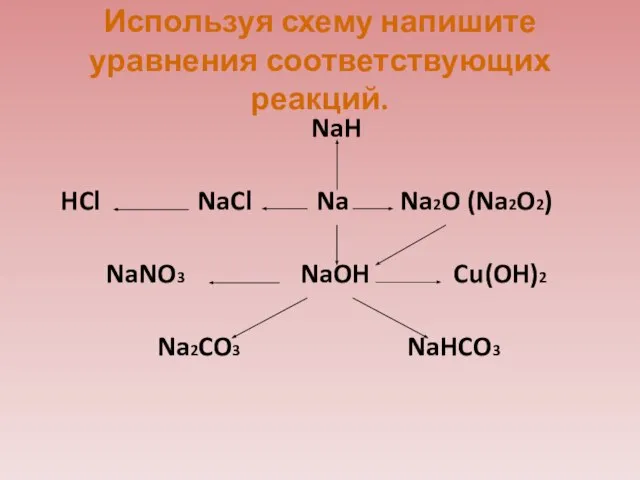
- 34. Используя схему напишите уравнения соответствующих реакций. NaH HCl NaCl Na Na2O (Na2O2) NaNO3 NaOH Cu(OH)2 Na2CO3
- 35. 1. Выполнить цепочку химических превращений: Na →Na2O2→Na2O→Na2CO3 NaOH → NaCl Для реакций составить ионные уравнения и
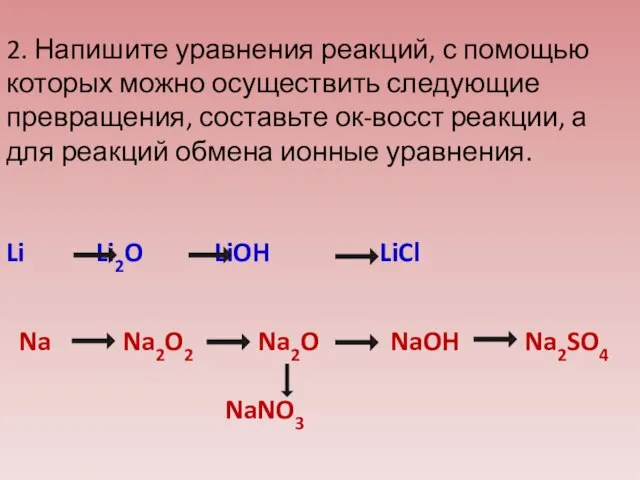
- 36. 2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, составьте ок-восст реакции, а для
- 37. Оксиды щелочных металлов Общая формула Ме2О Твердые, кристаллические вещества белого цвета
- 38. Оксиды щелочных металлов-Типичные основные оксиды: 1.С кислотным оксидом K2O + CO2 ? K2CO3 2.С амфотерным оксидом
- 39. Дописать реакции Na2О + H2O → Na2О + НCl → Na2О + SO3 → Na2О +
- 40. Гидроксиды щелочных металлов Общая формула – МеОН Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с
- 41. Химические свойства щелочей 1. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метилоранж
- 42. Химические свойства щелочей 2. Взаимодействуют со всеми кислотами. NaOH + HCl → NaCl + H2O 3.
- 43. 5.С кислой солью NaOH + NaHSO4 ? Na2SO4 + H2O NaOH + KHCO3 ? Na2CO3 +
- 44. 9. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором, галогенами) NaOH +Si + H2O → Na2SiO3 +
- 47. Скачать презентацию




































 Презентация на тему Формирование познавательной активности детей через экологическое воспитание: теория и практика
Презентация на тему Формирование познавательной активности детей через экологическое воспитание: теория и практика My England
My England Проект переработки творожной сыворотки в ООО Молоко п. Торбеево
Проект переработки творожной сыворотки в ООО Молоко п. Торбеево Ing form or infinitive
Ing form or infinitive Адаптация систем менеджмента качества к требованиям новой версии стандарта ГОСТ Р ИСО 9001-2015
Адаптация систем менеджмента качества к требованиям новой версии стандарта ГОСТ Р ИСО 9001-2015 Гласные и согласные
Гласные и согласные Репродуктивные органы размножения у растений
Репродуктивные органы размножения у растений OneTouch Marketing Activity
OneTouch Marketing Activity Ангел на шпиле Петропавловского собора
Ангел на шпиле Петропавловского собора Презентация на тему Правила поведения при пожаре
Презентация на тему Правила поведения при пожаре  Фен. Косметический девичник
Фен. Косметический девичник Валютный рынок FOREX
Валютный рынок FOREX ДЕСЕРТЫ
ДЕСЕРТЫ фонтан на книжной полке
фонтан на книжной полке Тоннель
Тоннель Электромагнитные явления
Электромагнитные явления Проект«Возможно ли в наше время сохранение единого русского литературного языка?»
Проект«Возможно ли в наше время сохранение единого русского литературного языка?» Как РА найти веб-студию и не потерять клиента?
Как РА найти веб-студию и не потерять клиента? Генетика человека 11 класс
Генетика человека 11 класс Урок № 3 Сценография – особый вид художественного творчества
Урок № 3 Сценография – особый вид художественного творчества Как делать контрольную работу
Как делать контрольную работу Чем опасна толпа
Чем опасна толпа Брошюра для родителей. Наше творчество
Брошюра для родителей. Наше творчество Понятие коммуникационного процесса. Модель коммуникации лассуэла
Понятие коммуникационного процесса. Модель коммуникации лассуэла Химическое многоборье
Химическое многоборье 菲奥娜和史莱克
菲奥娜和史莱克 Россия и страны бывшего СССР: если интегрироваться, то с кем?
Россия и страны бывшего СССР: если интегрироваться, то с кем? «Нестандартные формы работы на уроках литературы в условиях внедрения инновационных методов»
«Нестандартные формы работы на уроках литературы в условиях внедрения инновационных методов»