ввести в систему катализатор
в) повысить температуру
г) понизить температуру
2. С наибольшей скоростью протекает реакция:
а) нейтрализации
б) горение серы в воздухе
в) растворение магния в кислоте
г) восстановление оксида меди водородом
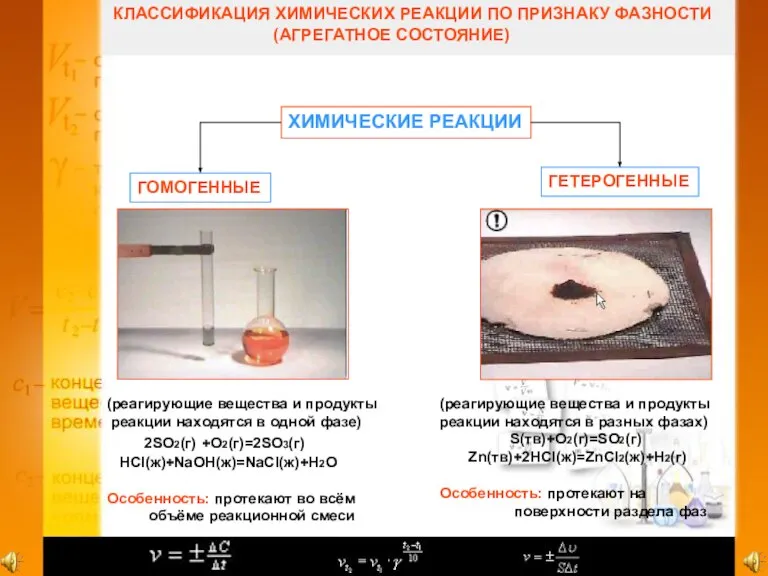
3. Укажите гомогенную реакцию.
а) CaO+H2O=Ca(OH)2
б) S+O2=SO2
в) 2CO+O2=2CO2
г) MgCO3?MgO+CO2
4. Укажите гетерогенную реакцию.
а) 2CO+O2=2CO2
б) H2+Cl2=2HCl
в) 2SO2+O2=2SO2 (кат V2O5)
г) N2O+H2=N2+H2O
5. Отметьте, какая реакция является одновременно
гомогенной и каталитической.
а) 2SO2+O2=2SO3 (кат NO2)
б) CaO+CO2=CaCO3
в) H2+Cl2=2HCl
г) N2+3H2=2NH3 (кат Fe)

![Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[B] Природа реагирующих веществ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/336159/slide-3.jpg)



 Село Новожилкино Усольского района
Село Новожилкино Усольского района Образовательные организации
Образовательные организации 2011-2012 год
2011-2012 год Презентация на тему Великий Шелковый путь
Презентация на тему Великий Шелковый путь  Герменевтика искусства
Герменевтика искусства 1.4 Преимущества успешного внедрения ИКТ
1.4 Преимущества успешного внедрения ИКТ Стандартизация. История развития
Стандартизация. История развития Энергетический обмен
Энергетический обмен Повесть о Петре и Февронии Муромских
Повесть о Петре и Февронии Муромских Контроль за исполнением управленческих решений
Контроль за исполнением управленческих решений Труд:право или обязанность?Трудовые права несовершеннолетних.
Труд:право или обязанность?Трудовые права несовершеннолетних. Изготовление обласа у Кондинских манси
Изготовление обласа у Кондинских манси Today you are going camping
Today you are going camping Час занимательной математики
Час занимательной математики БУКВА Д
БУКВА Д Мемориальный комплекс «Крепость-герой»
Мемориальный комплекс «Крепость-герой» Презентация на тему Ребусы, загадки, упражнения и вопросы
Презентация на тему Ребусы, загадки, упражнения и вопросы Аффективные психические образования
Аффективные психические образования Табличные вычисления на компьютере
Табличные вычисления на компьютере Презентация на тему Конфликтные ситуации: причины и пути их решения
Презентация на тему Конфликтные ситуации: причины и пути их решения Дорожно-строительные машины
Дорожно-строительные машины Понятия об индивидуальности и личности. Иерархия потребностей человека
Понятия об индивидуальности и личности. Иерархия потребностей человека Презентация на тему Звездное небо
Презентация на тему Звездное небо  Сергей Мясоедов ИБДА РАНХ при Президенте РФ
Сергей Мясоедов ИБДА РАНХ при Президенте РФ ТЕАТРАЛЬНОЕ ИСКУССТВО ЭПОХИ ВОЗРОЖДЕНИЯ
ТЕАТРАЛЬНОЕ ИСКУССТВО ЭПОХИ ВОЗРОЖДЕНИЯ Организация продаж. Сегмент B2C
Организация продаж. Сегмент B2C Профориентационный марафон
Профориентационный марафон Плоды и овощи.Томаты
Плоды и овощи.Томаты