внутри ядер огромными силами, во много раз превосходящими силы кулоновского отталкивания протонов. Силы, удерживающие нуклоны в ядре, называются ядерными ( рис.8)
Особенности ядерных сил:
Ядерные силы примерно в 100 раз превосходят электростатические силы и на десятки порядков превосходят силы гравитационного взаимодействия нуклонов.
2. Важной особенностью ядерных сил является их короткодействующий характер. Ядерные силы заметно проявляются, как показали опыты Резерфорда по рассеянию
a-частиц, лишь на расстояниях порядка размеров ядра (10–14–10–15 м). Ядерные силы очень быстро спадают с расстоянием. Радиус их действия порядка 0,000 000 000 000 001 метра.
Для этой сверхмалой длины, характеризующей размеры атомных ядер, ввели специальное обозначение Фм (в честь итальянского физика Э. Ферми, 1901-1954)
Все ядра имеют размеры нескольких Ферми.
Радиус ядерных сил равен размеру нуклона, поэтому ядра – концентрация и очень плотной материи. Возможно, самой плотной в земных условиях.
Ядерные силы - сильные взаимодействия.
На больших расстояниях проявляется действие сравнительно медленно убывающих кулоновских сил.
На основании опытных данных можно заключить, что протоны и нейтроны в ядре ведут себя одинаково в отношении сильного взаимодействия, т. е. ядерные силы не зависят от наличия или отсутствия у частиц электрического заряда.
ЯДЕРНЫЕ СИЛЫ
силы притяжения;
действуют между всеми нуклонами в ядре;
короткодействующие.
.
Рис.8






 Показатели качества деталей. Классификация показателей качества продукции. Определение номеклатуры показателей качества
Показатели качества деталей. Классификация показателей качества продукции. Определение номеклатуры показателей качества Кожа и ультрафиолетовые лучи
Кожа и ультрафиолетовые лучи Принципы, критерии и методы педагогического прогнозирования индивидуальной образовательной траектории
Принципы, критерии и методы педагогического прогнозирования индивидуальной образовательной траектории Студенческое самоуправление:основные мероприятия в 2011 г.
Студенческое самоуправление:основные мероприятия в 2011 г. Игры со шнуровкой
Игры со шнуровкой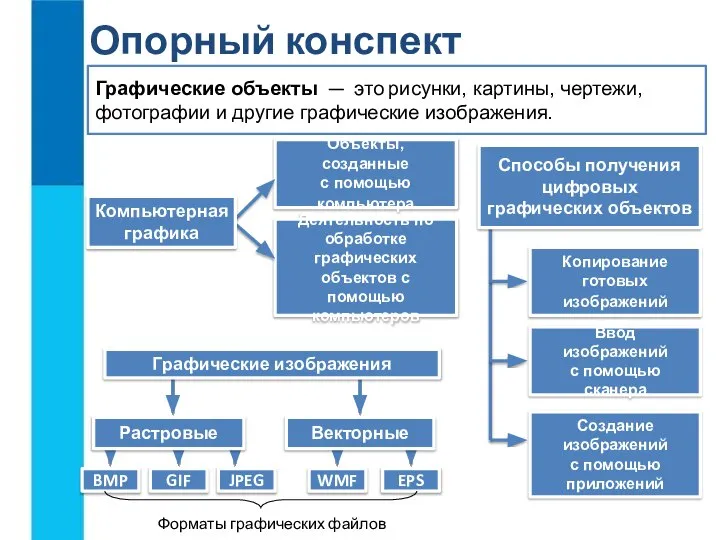 Графические объекты. Опорный конспект
Графические объекты. Опорный конспект Жизнь экосистемы. Биосфера и экосистема. Экологическая система
Жизнь экосистемы. Биосфера и экосистема. Экологическая система Руководство механики работы по проекту AUTO.RU
Руководство механики работы по проекту AUTO.RU Особенности энергосервисных контрактов в многоквартирных домах
Особенности энергосервисных контрактов в многоквартирных домах Презентация на тему Умножение и деление положительных и отрицательных чисел
Презентация на тему Умножение и деление положительных и отрицательных чисел Популяция (1)
Популяция (1) Конкурсный проект смотровой площадки на вершине горы Машук
Конкурсный проект смотровой площадки на вершине горы Машук Презентация на тему Рокоссовский Константин Константинович
Презентация на тему Рокоссовский Константин Константинович  Радианная мера углов и дуг
Радианная мера углов и дуг ДИАГРАММА «Моя квартира»
ДИАГРАММА «Моя квартира» Инфекционные осложнения после абортов
Инфекционные осложнения после абортов Гонка Чемпионов: Шумахер или Лёб? Тактика выживания бизнеса в кризис Сергей Петренко 1 апреля 2009 года. - презентация
Гонка Чемпионов: Шумахер или Лёб? Тактика выживания бизнеса в кризис Сергей Петренко 1 апреля 2009 года. - презентация Сведения о бетоне
Сведения о бетоне Право и государство
Право и государство За счет чего российские компании могут конкурировать глобально?
За счет чего российские компании могут конкурировать глобально? Cистема FATC1 климат-контроль
Cистема FATC1 климат-контроль "АНТИКРИЗИСНОЕ УПРАВЛЕНИЕ"
"АНТИКРИЗИСНОЕ УПРАВЛЕНИЕ" Александр Невский (7 класс)
Александр Невский (7 класс) Фонд обязательного медицинского страхования
Фонд обязательного медицинского страхования Ясенев Вячеслав Николаевич
Ясенев Вячеслав Николаевич Летний оздоровительный лагерь «МАЛЫШОК»
Летний оздоровительный лагерь «МАЛЫШОК» Программы сопровождения педагогических кадров Профессионал
Программы сопровождения педагогических кадров Профессионал Презентация на тему Антикоррупционная политика
Презентация на тему Антикоррупционная политика