Содержание
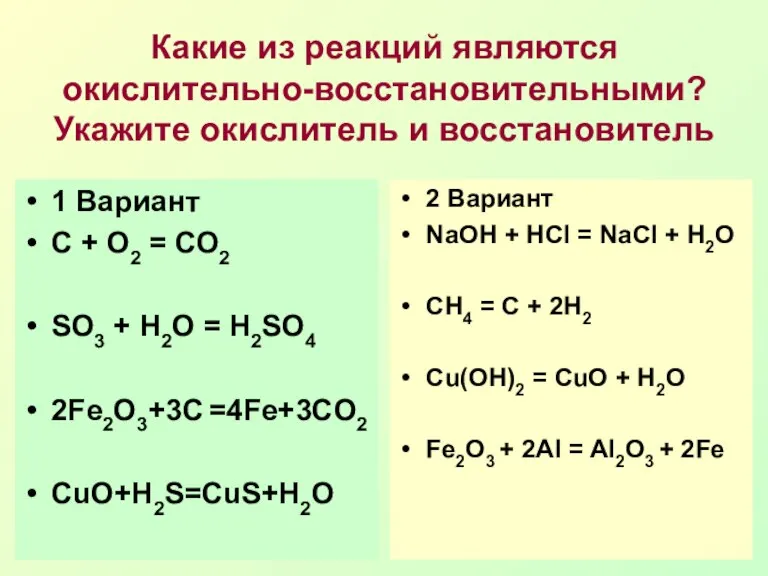
- 2. Какие из реакций являются окислительно-восстановительными? Укажите окислитель и восстановитель 1 Вариант С + О2 = СО2
- 3. 1 Вариант С0 + О20 = С+4О2-2 C0 - 4e = C+4 - ок-ие, в-ль O0
- 4. 2Fe2+3O3+3C0 = Fe0+ C+4O2 C0 - 4e = C+4- ок-ие, в-ль Fe+3 + 3e = Fe0-
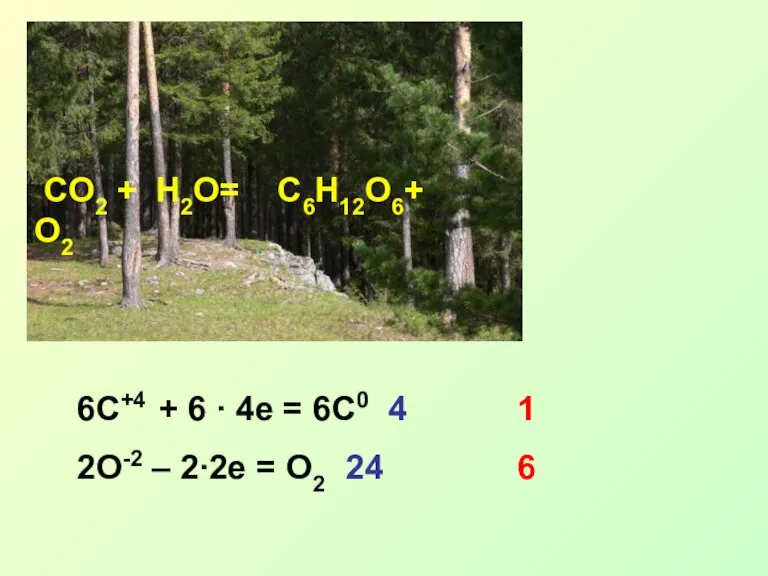
- 5. CO2 + H2O= C6H12O6+ O2 6C+4 + 6 ∙ 4e = 6C0 4 2O-2 – 2∙2e
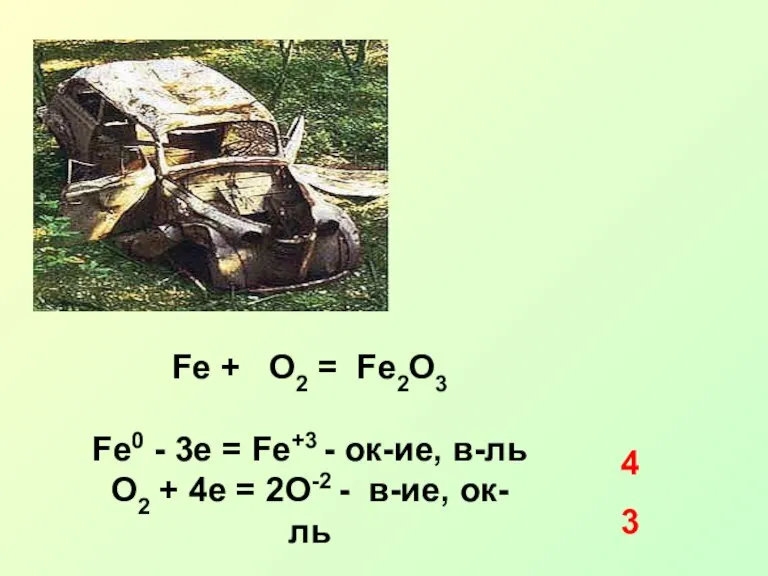
- 6. Fe + O2 = Fe2O3 Fe0 - 3e = Fe+3 - ок-ие, в-ль O2 + 4e
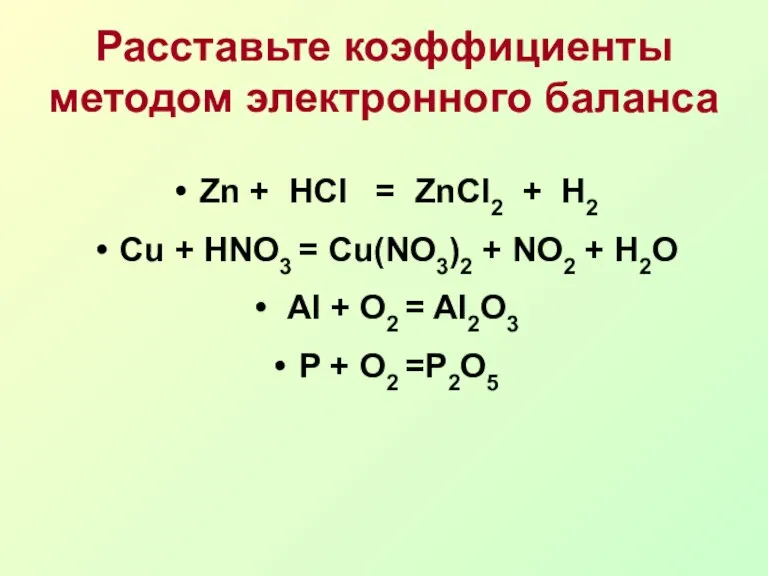
- 7. Расставьте коэффициенты методом электронного баланса Zn + HCl = ZnCl2 + H2 Cu + HNO3 =
- 9. Скачать презентацию


 Решение задач
Решение задач Microsoft® Word 2010: обучающий курс
Microsoft® Word 2010: обучающий курс Zelen Seventeen. Фавориты моих мечт. Главные цели + дополнительные
Zelen Seventeen. Фавориты моих мечт. Главные цели + дополнительные Презентация на тему Математика как Искусство
Презентация на тему Математика как Искусство  Изображения. ГОСТ 2. 305
Изображения. ГОСТ 2. 305 День независимости в Кыргызстане. 吉尔吉斯斯坦共和国于8月31日庆祝其主要州度假。
День независимости в Кыргызстане. 吉尔吉斯斯坦共和国于8月31日庆祝其主要州度假。 Presentation Title
Presentation Title  Алгоритм стереозрения
Алгоритм стереозрения Презентация на тему Законы алгебры логики
Презентация на тему Законы алгебры логики Художественное оформление, горизонтальные памятники
Художественное оформление, горизонтальные памятники Складское хозяйство и его роль в оптовой торговле
Складское хозяйство и его роль в оптовой торговле Нумизматика. Интересные монеты мира
Нумизматика. Интересные монеты мира Нормативная политическая теория и политические идеологии
Нормативная политическая теория и политические идеологии Тема : История Каменской церкви Покрова Пресвятой Богородицы
Тема : История Каменской церкви Покрова Пресвятой Богородицы Презентация на тему Влияние человека на животных
Презентация на тему Влияние человека на животных Путешествие по страницам Красной книги
Путешествие по страницам Красной книги Выполнила студентка группы ЭТР-08-2 Винникова Елена Владимировна.
Выполнила студентка группы ЭТР-08-2 Винникова Елена Владимировна. Лингвистические аспекты в образовании будущих логопедов
Лингвистические аспекты в образовании будущих логопедов Логическая структура аргументации
Логическая структура аргументации "Минутка" в детском саду
"Минутка" в детском саду Ważna decyzja
Ważna decyzja Слухоречевой праздник 9-а класс
Слухоречевой праздник 9-а класс Презентация на тему Московская Русь
Презентация на тему Московская Русь Каргопольская глиняная игрушка
Каргопольская глиняная игрушка Православное учение о человеке. Урок 9
Православное учение о человеке. Урок 9 Оңтүстік Қамыскөл Атырау облысының
Оңтүстік Қамыскөл Атырау облысының Фабрика предпринимательства - Без границ
Фабрика предпринимательства - Без границ Формы мышления
Формы мышления