Содержание
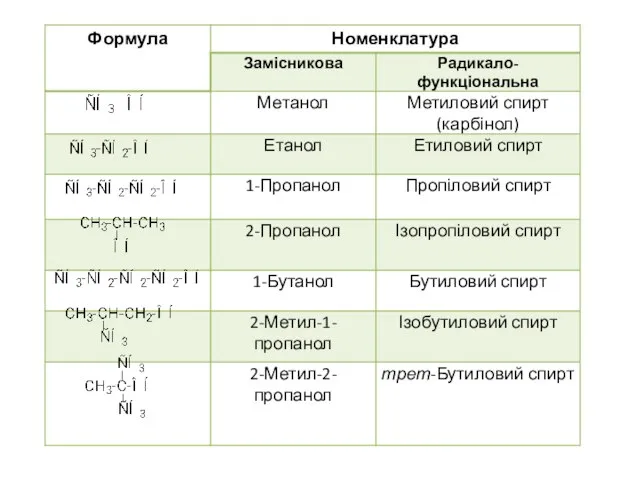
- 2. ОДНОАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНОЛИ) НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ За замісниковою номенклатурою назву одноатомних насичених спиртів утворюють від
- 4. МЕТОДИ ДОБУВАННЯ До головних промислових методів добування відносяться: гідратація алкенів, гідрування карбонільних сполук, реакція оксосинтезу, ферментативна
- 5. ПРОМИСЛОВІ МЕТОДИ ДОБУВАННЯ Гідратація алкенів 2-Пропанол Гідрування карбонільних сполук (альдегідів, кетонів, естерів) Так, альдегіди утворюють первинні
- 6. Естери також утворюють первинні спирти (реакція Буво-Блана): Етиловий естер Первинні спирти карбонової кислоти Гідрування карбон (ІІ)
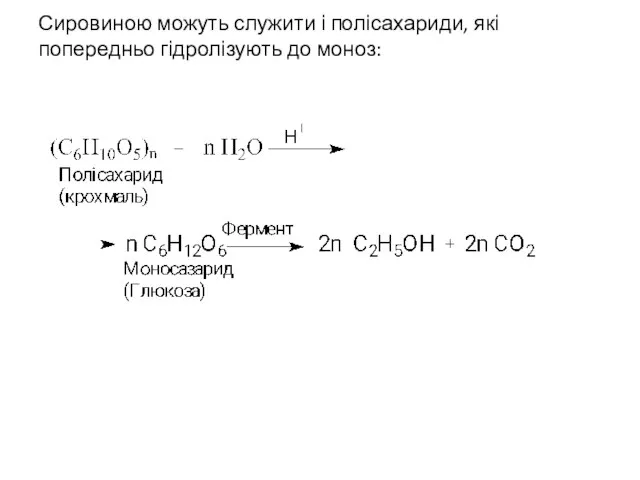
- 7. Синтез вищих спиртів Ферментативна переробка вуглеводів Ферментативне розщеплення вуглеводів (спиртове бродіння) здавна служить методом одержання етанолу:
- 8. Сировиною можуть служити і полісахариди, які попередньо гідролізують до моноз:
- 9. ЛАБОРАТОРНІ МЕТОДИ ДОБУВАННЯ Гідроліз галогеноалкілів Гідроборування – окиснення алкенів.
- 10. ФІЗИЧНІ ВЛАСТИВОСТІ Температура кипіння спиртів вища, ніж у алкілгалогенідів і алканів з тим же числом атомів
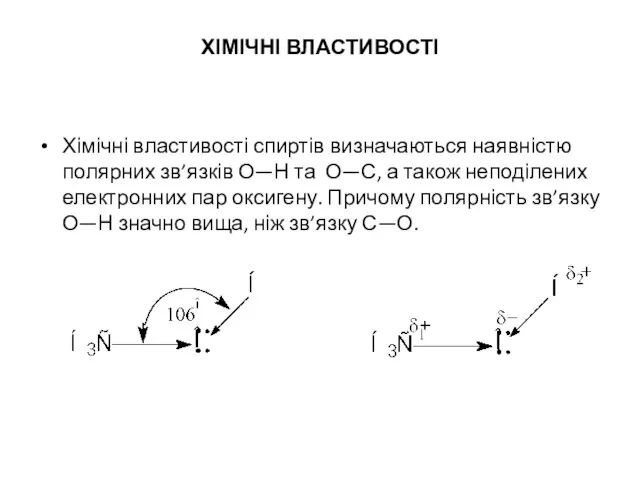
- 11. ХІМІЧНІ ВЛАСТИВОСТІ Хімічні властивості спиртів визначаються наявністю полярних зв’язків О—Н та О—С, а також неподілених електронних
- 12. Кислотно-основні властивості спиртів Зв’язок ОН у спиртах досить полярний, тому спирти дисоціюють з утворенням протонів, через
- 13. Поряд з кислотними властивостями, спирти проявляють основні властивості за рахунок наявності на атомі кисню двох неподілених
- 14. Заміщення гідроксильної групи на галоген При взаємодії спиртів з HCl, HBr тощо, відбувається заміщення НО-групи на
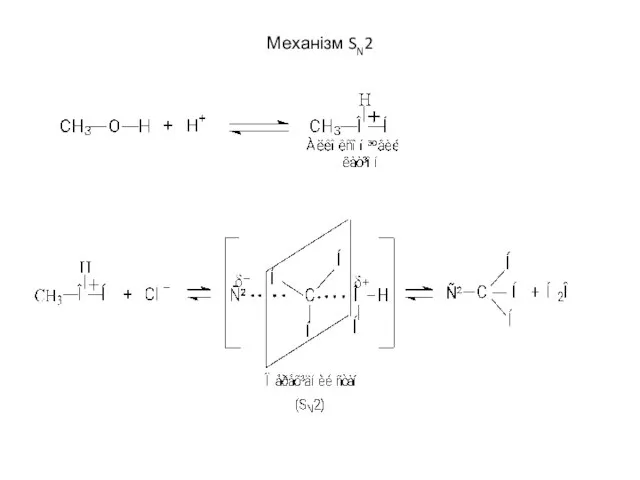
- 15. Механізм SN2
- 16. Взаємодія з галогеннуклеофілами PCl5, PCl3, SOCl2, також веде до утворення алкілгалогенідів з майже кількісним виходом:
- 17. Реакція утворення естерів (естерифікація) При взаємодії спиртів з органічними кислотами утворюються естери, які можна розглядати як
- 18. Дегідратація спиртів (реакція Е) Реакцією дегідратації зі спиртів отримують алкени та алкадієни. Дегідратація протікає при нагріванні
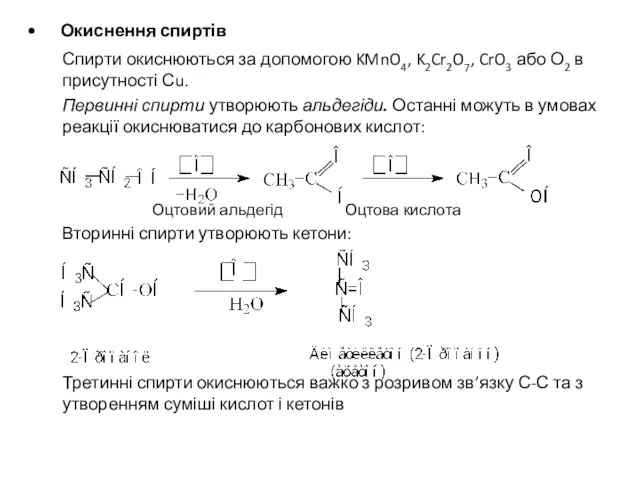
- 19. Окиснення спиртів Спирти окиснюються за допомогою KMnO4, K2Cr2O7, CrO3 або О2 в присутності Сu. Первинні спирти
- 20. ОДНОАТОМНІ НЕНАСИЧЕНІ СПИРТИ (АЛКЕНОЛИ, АЛКІНОЛИ) Ненасиченими називаються такі спирти, у яких гідроксильна ОН-група зв’язана з атомом
- 21. Найпростіший представник - вініловий спирт у вільному вигляді не існує, тому що спирти з гідроксильною групою
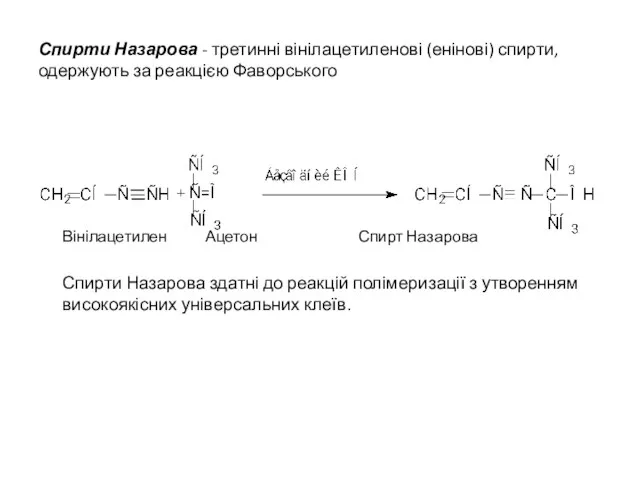
- 22. Спирти Назарова - третинні вінілацетиленові (енінові) спирти, одержують за реакцією Фаворського Вінілацетилен Ацетон Спирт Назарова Спирти
- 23. ДВОАТОМНІ НАСИЧЕНІ СПИРТИ (ГЛІКОЛІ АБО АЛКАНДІОЛИ) Двоатомні насичені спирти або гліколі - це спирти з двома
- 25. СПОСОБИ ДОБУВАННЯ Гідроліз дигалогенопохідних Гідратація органічних оксидів (епоксидів ) Окиснення алкенів водним розчином KMnO4 (реакція Вагнера).
- 26. ФІЗИЧНІ ВЛАСТИВОСТІ Гліколі мають більшу в’язкість і киплять при вищих температурах, ніж одно атомні спирти з
- 27. ХІМІЧНІ ВЛАСТИВОСТІ За своїми хімічними властивостями вони аналогічні одноатомним спиртам. Однак, наявність двох гідроксильних груп надає
- 28. З гідроксидами важких металів, наприклад (СuОН)2 такі гліколіз утворюють комплексні сполуки (хелати), у яких поряд з
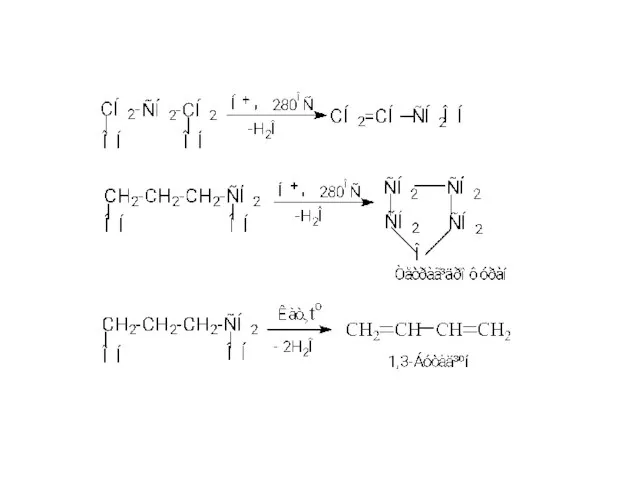
- 29. Естери утворюються при естерифікації гліколів мінеральними або органічними кислотами: Реакції дегідратації Внутрішньомолекулярна дегідратація
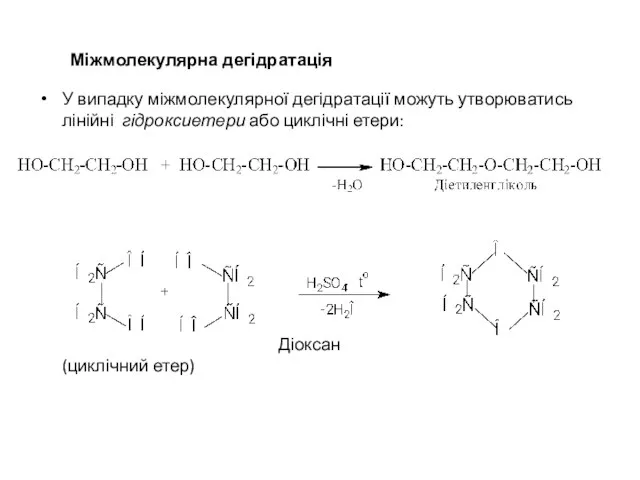
- 31. Міжмолекулярна дегідратація У випадку міжмолекулярної дегідратації можуть утворюватись лінійні гідроксиетери або циклічні етери: Діоксан (циклічний етер)
- 32. ТРИАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНТРИОЛИ) Спирти, що містять три гідроксильні групи, називаються триатомними. Їх загальна формула -
- 33. ОДЕРЖАННЯ ГЛІЦЕРОЛУ 1. Гідроліз рослинних і тваринних жирів Жири є естерами гліцеролу та вищих жирних кислот.
- 34. З пропену (головний промисловий метод одержання синтетичного гліцеролу) Через алілхлорид. Інколи застосовують приєднання до алілового спирту
- 35. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ Гліцерол за своїми властивостями нагадує гліколі. Це в’язка висококипляча рідина. Він гігроскопічний
- 36. 2. Утворення естерів Практичне значення має повний естер гліцеролу та нітратної кислоти - тринітрат гліцеролу, що
- 38. Скачать презентацию



























 Художественная культура России на рубеже 19 – 20 веков
Художественная культура России на рубеже 19 – 20 веков Поэзия Великой Отечественной войны
Поэзия Великой Отечественной войны Багатокультурність
Багатокультурність поиск новых путей:
поиск новых путей: Васильева Елена. Резюме
Васильева Елена. Резюме Dream Shop. Магазин открыток
Dream Shop. Магазин открыток Привлечение лица в качестве обвиняемого
Привлечение лица в качестве обвиняемого Воспитательная программа
Воспитательная программа «Название проекта» ФИО докладчика
«Название проекта» ФИО докладчика Система сменных модулей для грузового автотранспорта
Система сменных модулей для грузового автотранспорта Биржа
Биржа Система автоматического управления освещением зданий
Система автоматического управления освещением зданий «ЗОЛОТОЕ СЕЧЕНИЕ»
«ЗОЛОТОЕ СЕЧЕНИЕ» КАННСКИЕ ЛЬВЫ
КАННСКИЕ ЛЬВЫ УМК «Школа России»Урок русского языка по теме:«Разделительный твердый знак (ъ)»3 класс
УМК «Школа России»Урок русского языка по теме:«Разделительный твердый знак (ъ)»3 класс Фантом для занятий.
Фантом для занятий. Картинный диктант. Словарные слова на тему "Транспорт"
Картинный диктант. Словарные слова на тему "Транспорт" Подрядные работы для государственных нужд
Подрядные работы для государственных нужд ПОВОД ВЫБРАТЬ ЛУЧШЕЕ
ПОВОД ВЫБРАТЬ ЛУЧШЕЕ Правоспособность колонов
Правоспособность колонов Химическая организация клетки
Химическая организация клетки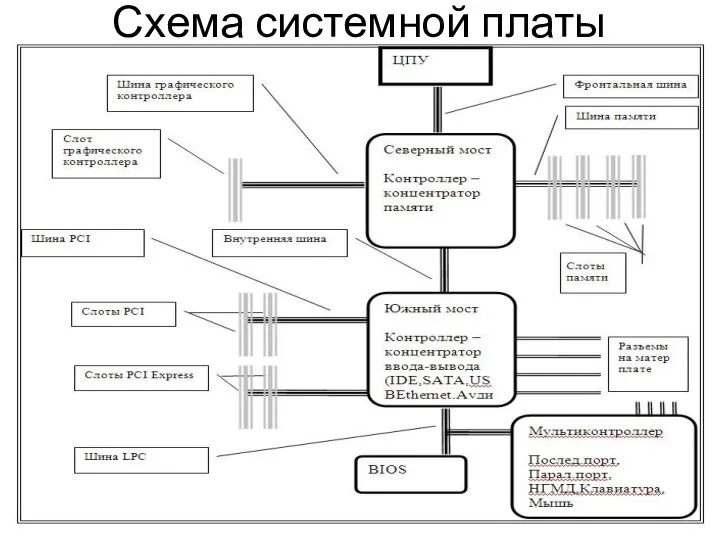 Схема системной платы
Схема системной платы roditelskoe_sobranie_27_sentyabrya_2022
roditelskoe_sobranie_27_sentyabrya_2022 Иуда Искариот Андреев
Иуда Искариот Андреев Английский, польский
Английский, польский цифровые коммуникации
цифровые коммуникации Сельское хозяйство Краснодарского края.Агропромышленный комплекс
Сельское хозяйство Краснодарского края.Агропромышленный комплекс Правовая лексика
Правовая лексика