Содержание
- 2. Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле !
- 3. Демокрит В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие
- 4. М.В. Ломоносов (1711-1765 гг.) Материя состоит из мельчайших первичных частиц, или атомов. Атомы неделимы и не
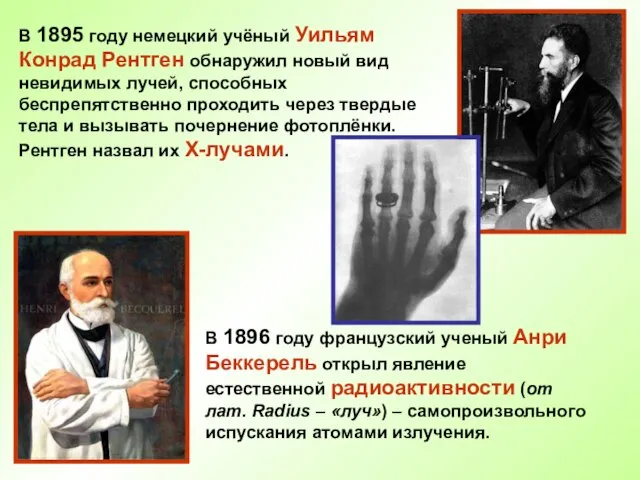
- 5. В 1895 году немецкий учёный Уильям Конрад Рентген обнаружил новый вид невидимых лучей, способных беспрепятственно проходить
- 6. В 1898 году Пьер Кюри и Мария Склодовская – Кюри, изучавшие явление радиоактивности, открыли новые элементы
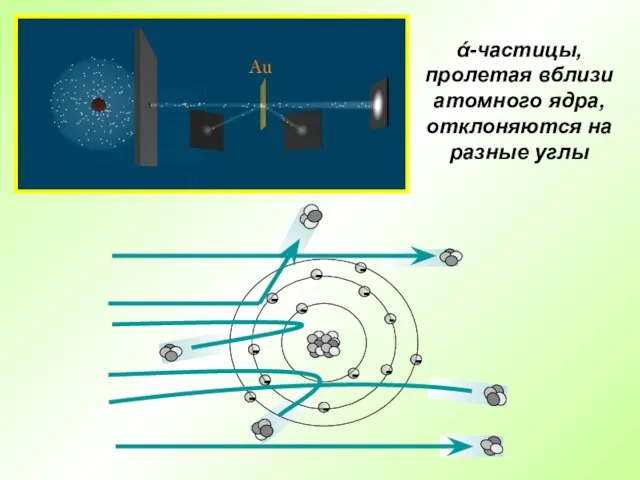
- 7. Английский физик Эрнест Резерфорд в 1909 г. открыл ядро атома Опыт Резерфорда: поток ά-частиц, излучаемый радиоактивным
- 8. ά-частицы, пролетая вблизи атомного ядра, отклоняются на разные углы
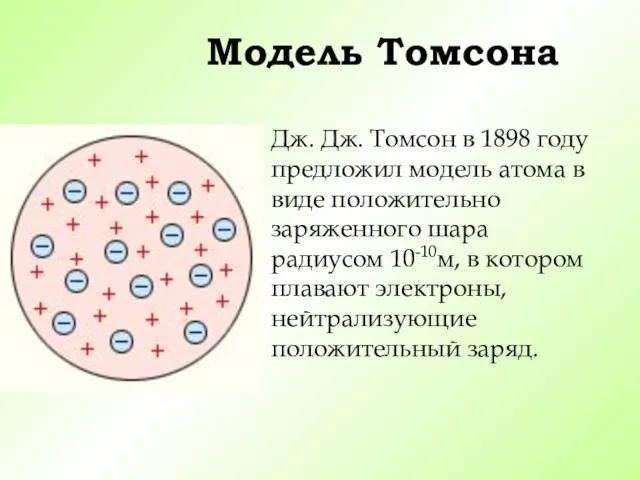
- 9. Модель Томсона Дж. Дж. Томсон в 1898 году предложил модель атома в виде положительно заряженного шара
- 10. Э. Резерфорд предложил планетарную модель атома: в центре находится положительно заряженное ядро, которое имеет достаточно малые
- 11. Родители атома. Демокрит (460 до н. э. — 370 до н. э.) Джозеф Джон Томсон (1856–1940
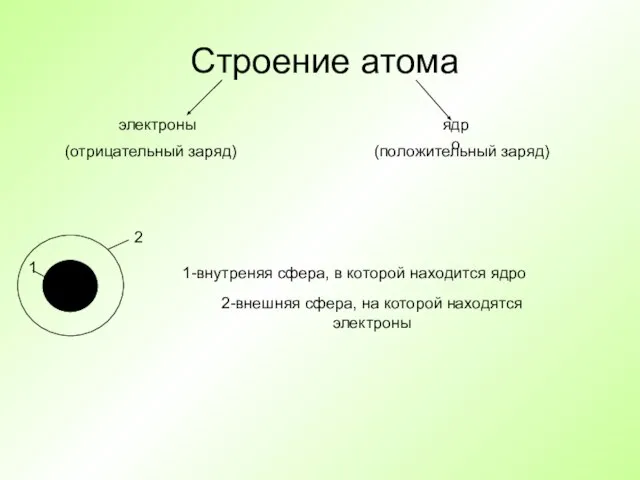
- 13. Строение атома электроны ядро 1-внутреняя сфера, в которой находится ядро 2-внешняя сфера, на которой находятся электроны
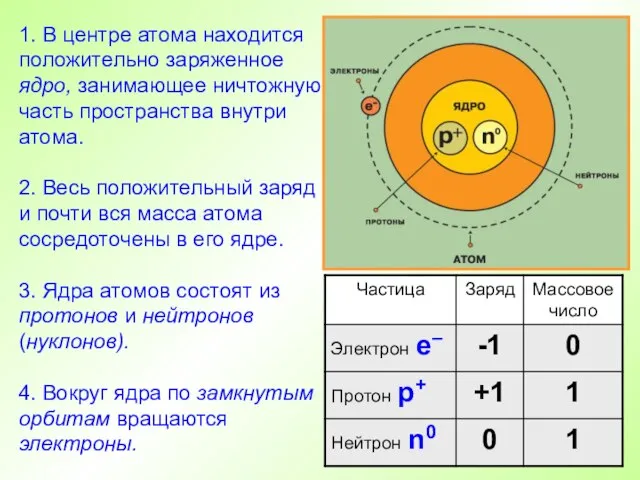
- 14. 1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома. 2. Весь
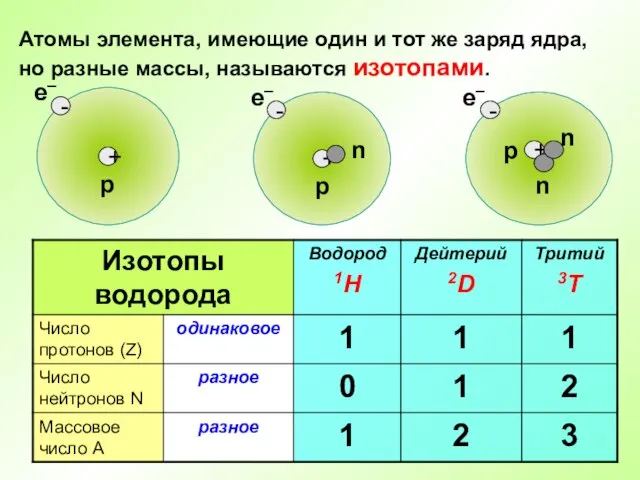
- 15. Атомы элемента, имеющие один и тот же заряд ядра, но разные массы, называются изотопами.
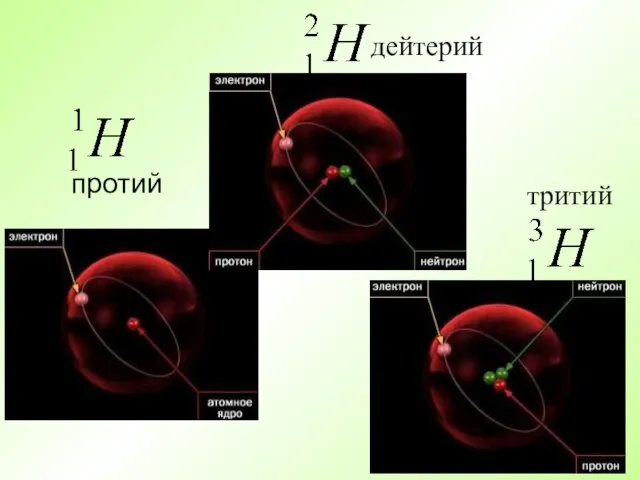
- 16. протий дейтерий тритий
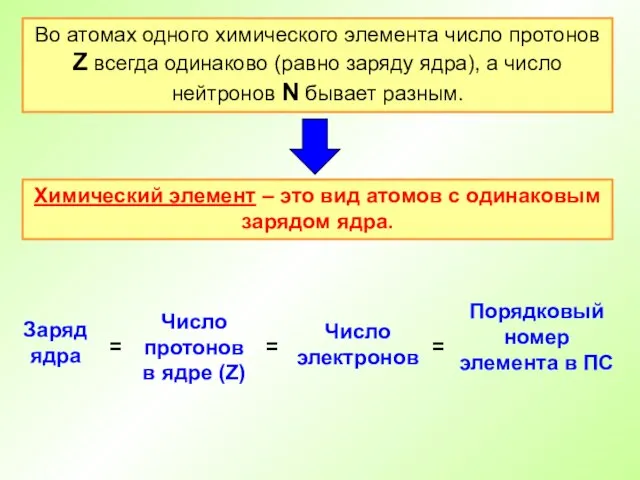
- 17. Во атомах одного химического элемента число протонов Z всегда одинаково (равно заряду ядра), а число нейтронов
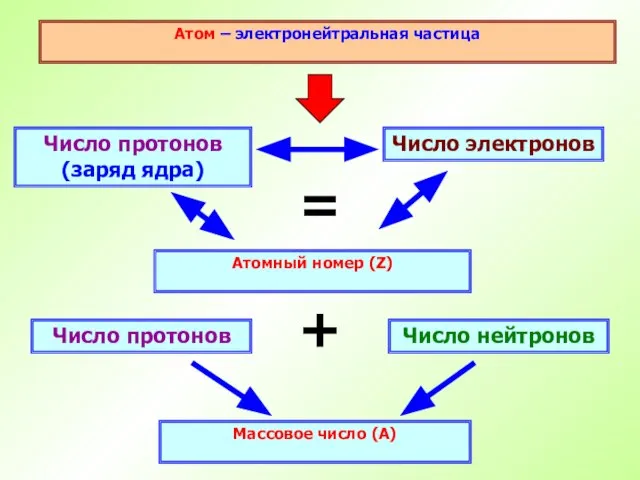
- 18. Атом – электронейтральная частица Число протонов (заряд ядра) Атомный номер (Z) Число электронов = Число нейтронов
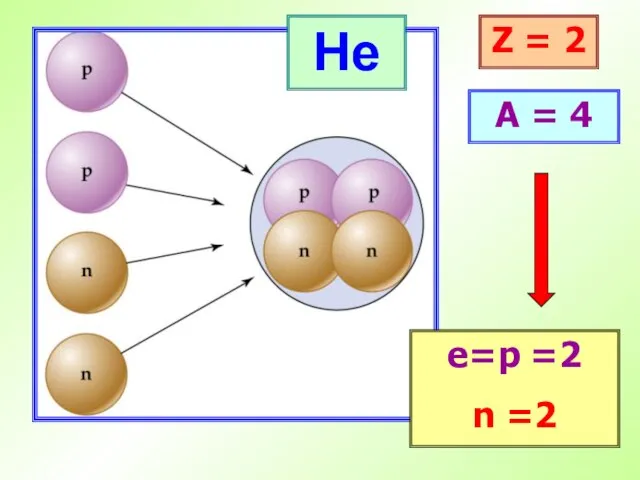
- 20. He Z = 2 A = 4 е=p =2 n =2
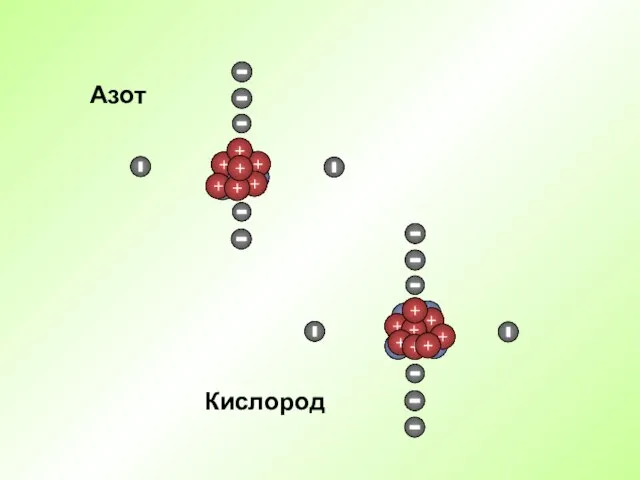
- 21. Кислород Азот
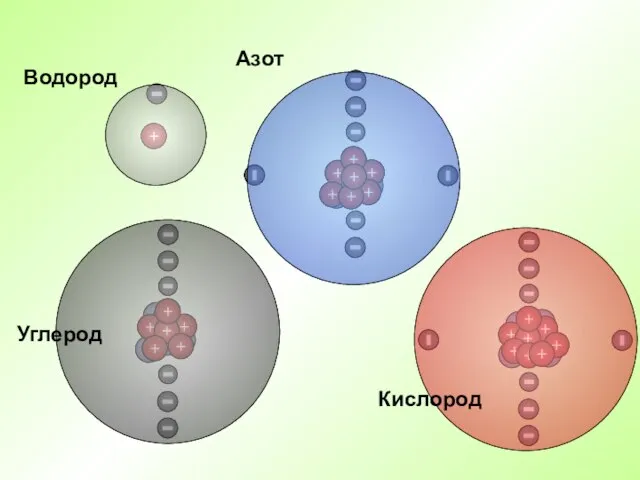
- 22. Водород Азот Кислород Углерод
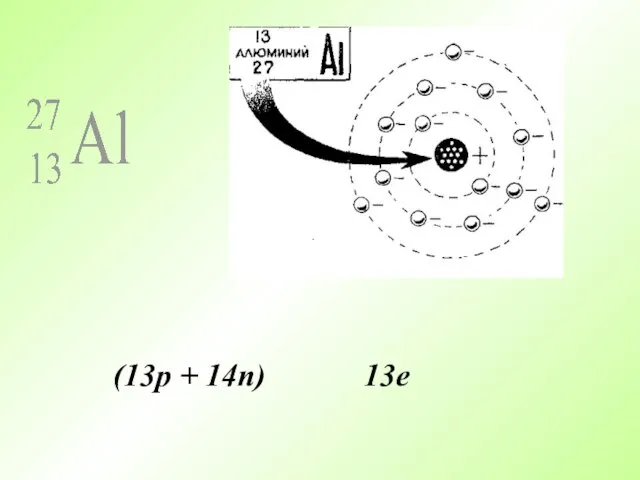
- 23. (13p + 14n) 13e
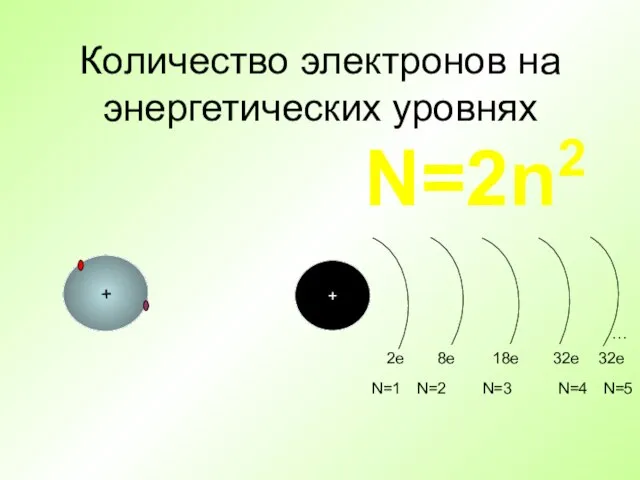
- 25. Количество электронов на энергетических уровнях + + … 2e 8e 18е 32е 32е N=1 N=2 N=3
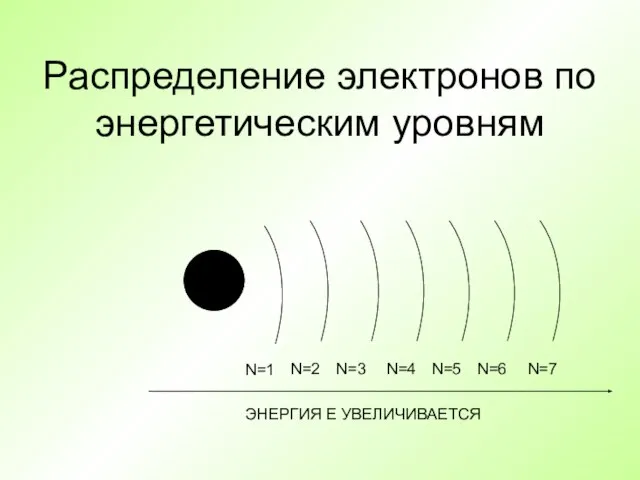
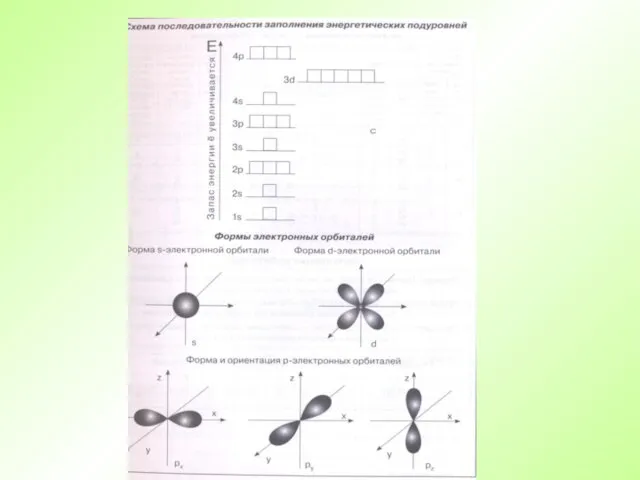
- 26. Распределение электронов по энергетическим уровням + N=1 N=2 N=3 N=4 N=5 N=6 N=7 ЭНЕРГИЯ Е УВЕЛИЧИВАЕТСЯ
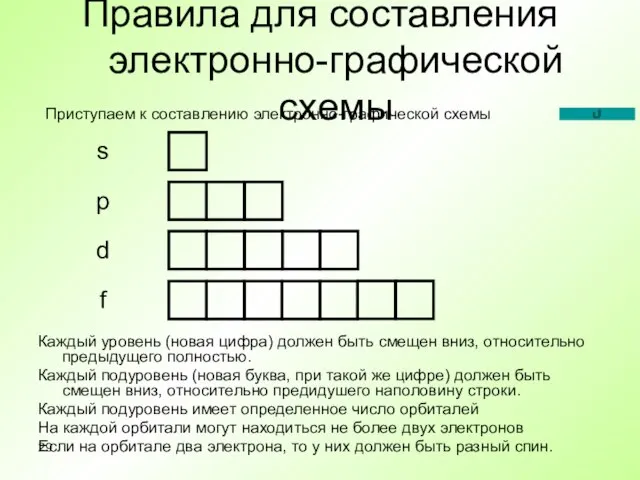
- 29. Правила для составления электронно-графической схемы Каждый уровень (новая цифра) должен быть смещен вниз, относительно предыдущего полностью.
- 31. Порядок заполнения орбиталей электронами VII – 7s5f6d7p 32 VI – 6s4f5d6p 32 V – 5s4d5p 18
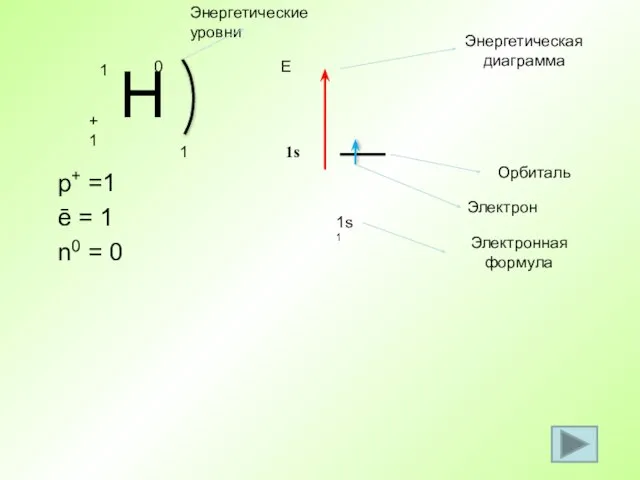
- 32. p+ =1 ē = 1 n0 = 0 1 1s1 Е 1s Энергетическая диаграмма Орбиталь Электрон
- 33. p+ =2 ē = 2 n0 = 2 2 1s2 Е 1s Электроны с разными спинами
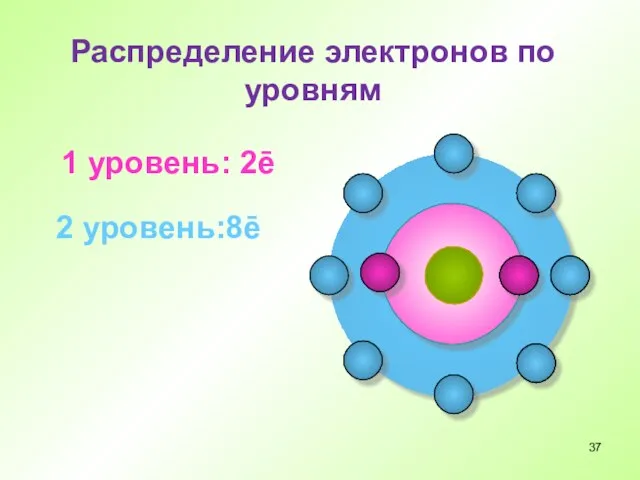
- 34. Распределение электронов по уровням 1 уровень: 2ē
- 35. p+ =3 ē = 3 n0 = 4 2 1s2 Е 1s 1 2s 2s1
- 36. p+ =7 ē =7 n0 = 7 2 1s2 Е 1s 5 2s 2s2 2p 2p3
- 37. Распределение электронов по уровням 1 уровень: 2ē 2 уровень:8ē
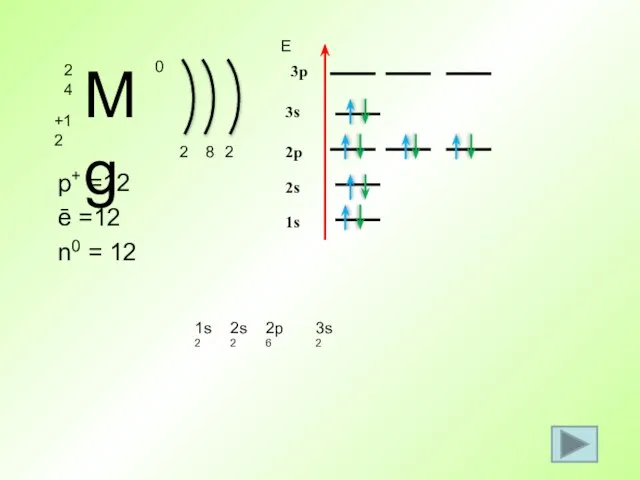
- 38. p+ =12 ē =12 n0 = 12 2 1s2 Е 1s 8 2s 2s2 2p 2p6
- 39. p+ =17 ē =17 n0 = 18 2 1s2 Е 1s 8 2s 2s2 2p 2p6
- 40. Проверка знаний Устно Письменно Далее: Электронная оболочка атома.
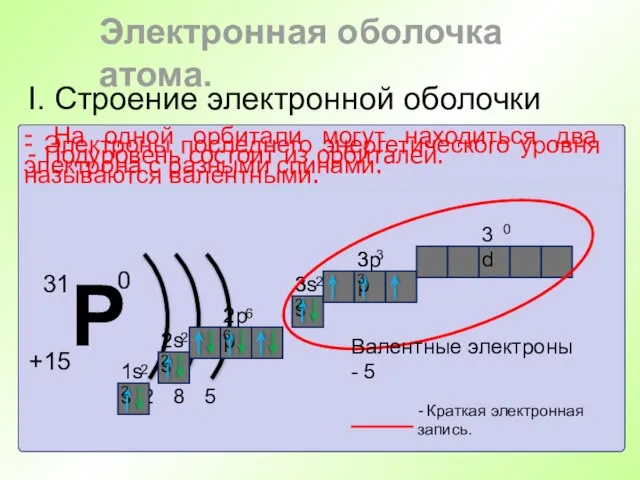
- 41. I. Строение электронной оболочки Электронная оболочка атома. - Энергетический уровень состоит из подуровней. - Подуровень состоит
- 42. I. Строение электронной оболочки - Подуровень состоит из орбиталей. - На одной орбитали могут находиться два
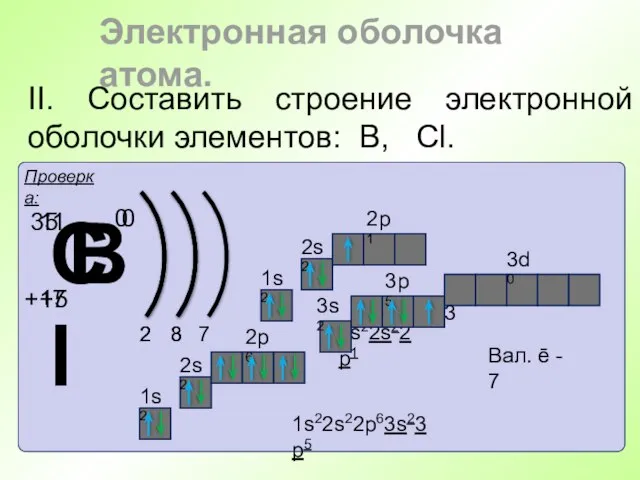
- 43. II. Составить строение электронной оболочки элементов: В, Cl. Электронная оболочка атома.
- 44. Периодический закон и периодическая система элементов Д.И. Менделеева
- 45. Открытию периодического закона предшествовало накопление знаний о веществах и свойствах. По мере открытия новых химических элементов,
- 46. В основу своей работы по классификации химических элементов Д.И. Менделеев положил два их основных и постоянных
- 47. При переходе от лития к фтору происходит закономерное ослабление металлических свойств и усиление неметаллических. При переходе
- 48. Если написать ряды один под другим так, чтобы под литием находился натрий, а под неоном –
- 49. Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
- 50. На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной
- 51. Уязвимым моментом периодического закона сразу после его открытия было объяснение причины периодического повторения свойств элементов с
- 52. Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало понятно, что
- 54. Открытый Д. И. Менделеевым закон и построенная на основе закона периодическая система элементов - это важнейшее
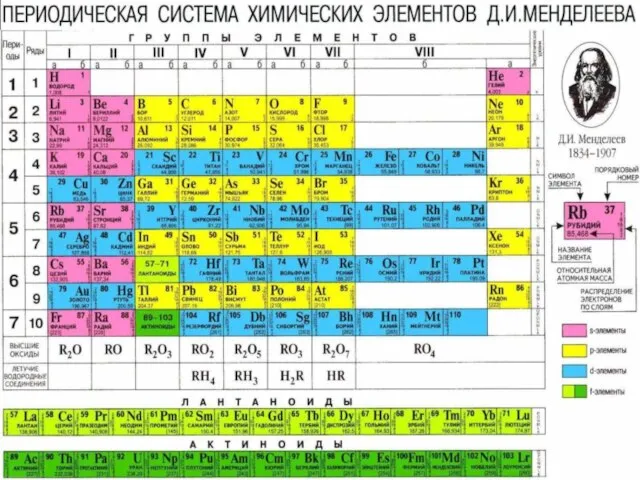
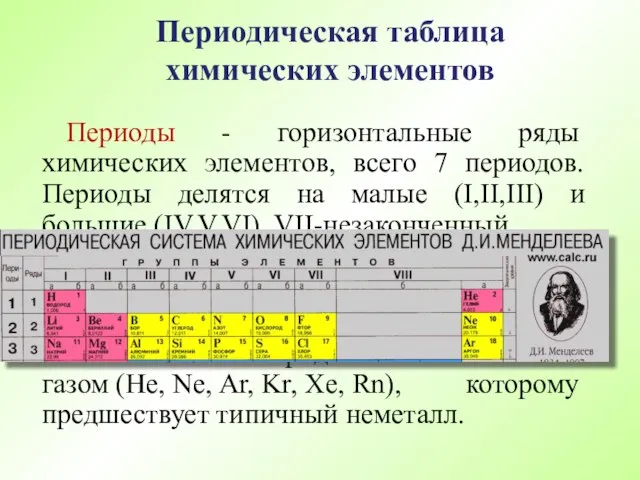
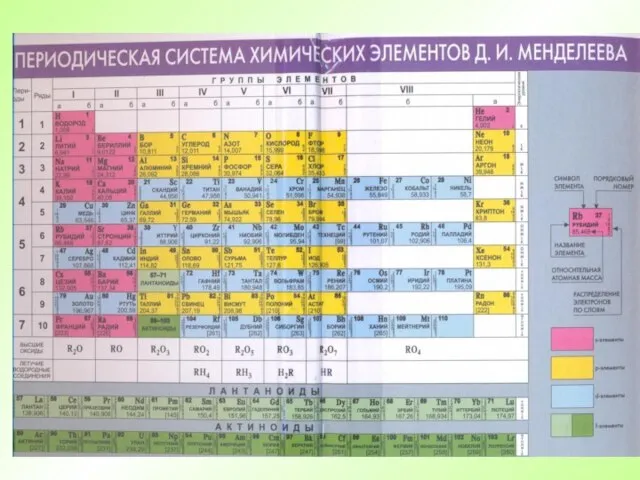
- 55. Периодическая таблица химических элементов Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на
- 56. Периодическая таблица химических элементов Группы - вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном
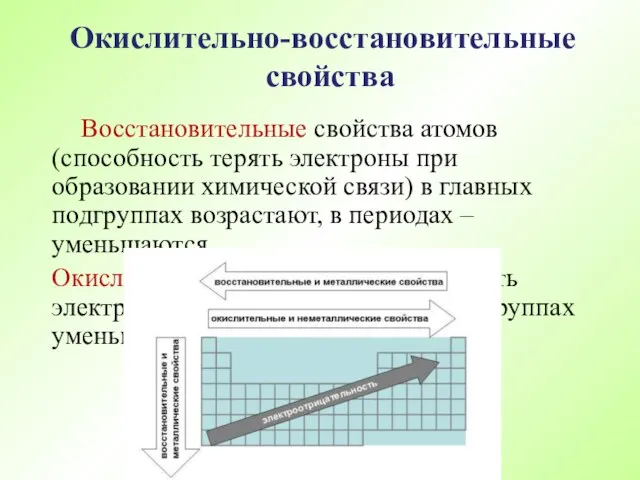
- 57. Поскольку окислительно – восстановительные свойства атомов оказывают влияние на свойства простых веществ и их соединений, то
- 58. Восстановительные свойства атомов (способность терять электроны при образовании химической связи) в главных подгруппах возрастают, в периодах
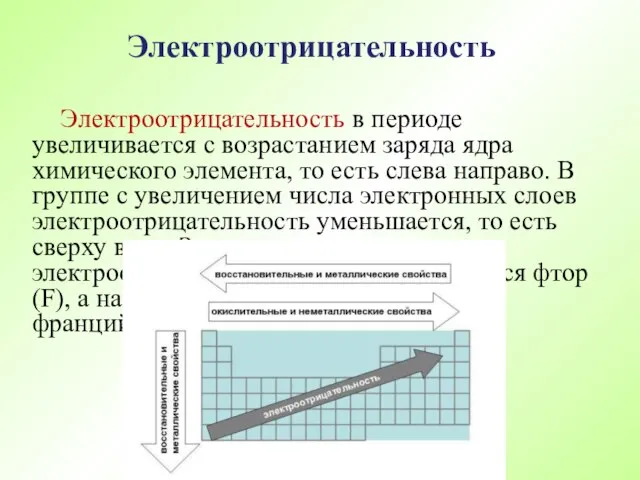
- 59. Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо. В группе
- 60. Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к. притяжение ядром электронных оболочек усиливается.
- 61. В одной и той же группе с увеличением номера периода атомные радиусы возрастают. Атомы металлов сравнительно
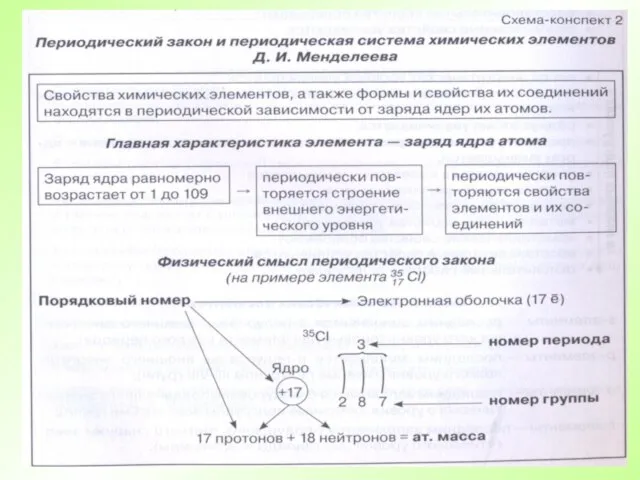
- 62. Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от зарядов атомных ядер
- 67. Значение Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии,
- 68. Памятник Д.И. Менделееву в Санкт-Петербурге
- 70. Скачать презентацию






































 ОБЛАКА (6 класс)
ОБЛАКА (6 класс) Язык программирования Pascal. Процедуры и функции
Язык программирования Pascal. Процедуры и функции Поговорим об этикете
Поговорим об этикете Всемирный Банк и МолодежьThe Young Professionals Program
Всемирный Банк и МолодежьThe Young Professionals Program Руководство Ernst&Young по составления бизнес-планов
Руководство Ernst&Young по составления бизнес-планов Формированиеруководящих органов Платформы и план работ на I квартал 2011 (представление проектарешения заседания)
Формированиеруководящих органов Платформы и план работ на I квартал 2011 (представление проектарешения заседания) Бакланова Людмила Николаевна, учитель географии высшей квалификационной категории МОУ Чайковская средняя общеобразовательная ш
Бакланова Людмила Николаевна, учитель географии высшей квалификационной категории МОУ Чайковская средняя общеобразовательная ш Русская культура. Предметы русского быта
Русская культура. Предметы русского быта Welcome to 2011:что ждет рекламодателей
Welcome to 2011:что ждет рекламодателей Наука как деятельность. Спорт как объект научного исследования
Наука как деятельность. Спорт как объект научного исследования Космос, земля, человек.
Космос, земля, человек. Плетение
Плетение Презентация на тему Русская культура
Презентация на тему Русская культура Антибактериальный гель для рук
Антибактериальный гель для рук Испанском художнике Диего Веласкесе
Испанском художнике Диего Веласкесе Использование информационных средств обучения на уроках истории и обществознания
Использование информационных средств обучения на уроках истории и обществознания DIU - Активные виды деятельности
DIU - Активные виды деятельности Неустойка. Формы неустойки
Неустойка. Формы неустойки Презентация на тему Нью-Йорк
Презентация на тему Нью-Йорк Презентация
Презентация Использование опорных схем на уроках русского языка- один из способов формирования информационных и коммуникативных компетентно
Использование опорных схем на уроках русского языка- один из способов формирования информационных и коммуникативных компетентно mdk_02
mdk_02 Идеальная бровь
Идеальная бровь Избирательная система РФ
Избирательная система РФ 2022.10.28_Презентация на Думу
2022.10.28_Презентация на Думу ЦУКУРОВ Олег Анатольевич Заместитель Генерального директора ОАО «Институт сварки России», член Технического комитета по станда
ЦУКУРОВ Олег Анатольевич Заместитель Генерального директора ОАО «Институт сварки России», член Технического комитета по станда Контрперенос и принципы работы бессознательного
Контрперенос и принципы работы бессознательного Рунические формулы на все случаи жизни
Рунические формулы на все случаи жизни