Содержание
- 2. Быть может ,эти электроны Миры где пять материков Искусство, знанья, троны, войны И память сорока веков
- 3. Цели урока: Образовательная: сформировать у учащихся представление о строении атома, продолжить формирование умений пользоваться теорией и
- 4. Бинарный тест по теме “Строение атома” Впервые электрические явления были звмечены древними греками: они обнаружили, что
- 5. Из истории развития науки о строении атома 1897 год – английский учёный Томсон открывает элементарную частицу
- 6. Модель атома Томсона До открытия атомного ядра в физике существовала модель атома Томсона. Атом считали однородно
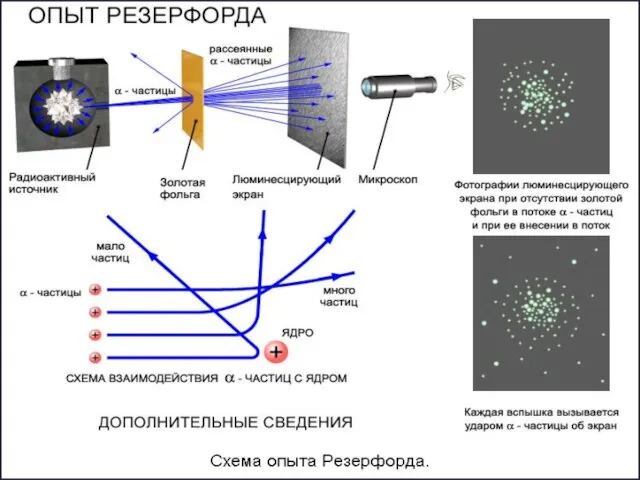
- 7. Опыт Резерфорда 1911 год –Эрнест Резерфорд проводит опыты по подтверждению “пудинговой модели” атома
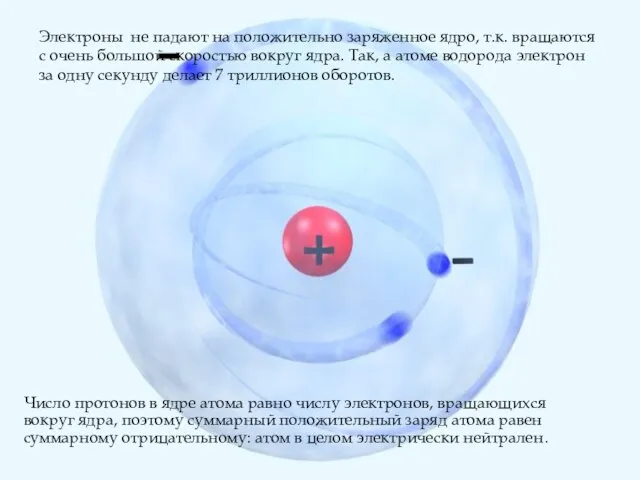
- 9. Электроны не падают на положительно заряженное ядро, т.к. вращаются с очень большой скоростью вокруг ядра. Так,
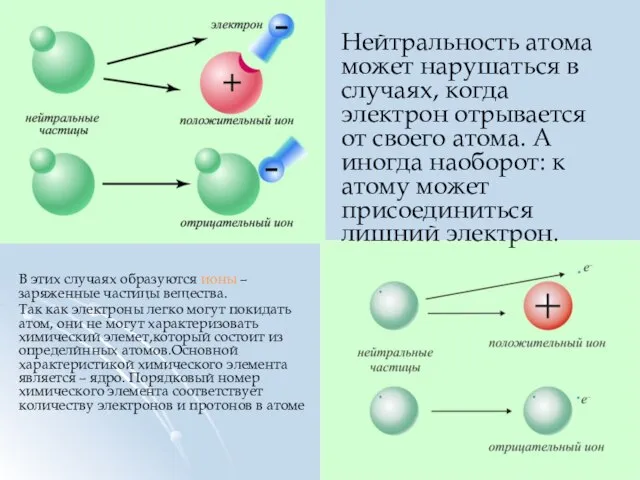
- 10. Нейтральность атома может нарушаться в случаях, когда электрон отрывается от своего атома. А иногда наоборот: к
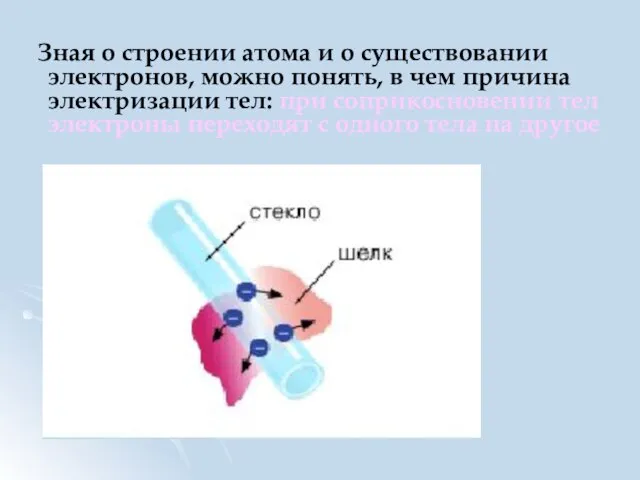
- 11. Зная о строении атома и о существовании электронов, можно понять, в чем причина электризации тел: при
- 12. Какие частицы входят в состав ядра? Почему атом электрически нейтральным? Что является главной характеристикой данного химического
- 14. Скачать презентацию







 Слайд-лекция По дисциплине «Современная методика преподавания литературы» Для студентов специальностей 050205 «Филология: Русская
Слайд-лекция По дисциплине «Современная методика преподавания литературы» Для студентов специальностей 050205 «Филология: Русская  А. Т. Твардовский (1910-1971)
А. Т. Твардовский (1910-1971) Использование ИКТ в работе классного руководителя
Использование ИКТ в работе классного руководителя Strategic Integrative International Management for Small and Medium Business Enterprises
Strategic Integrative International Management for Small and Medium Business Enterprises Англицизмы в русском языке
Англицизмы в русском языке Конкурс«Знай- наших!»
Конкурс«Знай- наших!» A normalisation example
A normalisation example Н. М. Рубцов Звезда полей
Н. М. Рубцов Звезда полей Презентация на тему Метод проектов в патриотическом воспитании детей старшего дошкольного возраста
Презентация на тему Метод проектов в патриотическом воспитании детей старшего дошкольного возраста Основные понятия информатики. Операционная система. Файл. Файловая система. Устройства ввода-вывода. Потоки. Файловый менеджер Алг
Основные понятия информатики. Операционная система. Файл. Файловая система. Устройства ввода-вывода. Потоки. Файловый менеджер Алг Документы и сведения, представляемые таможенным органам при прибытии на таможенную территорию Подготовили: студентки 3-го курса
Документы и сведения, представляемые таможенным органам при прибытии на таможенную территорию Подготовили: студентки 3-го курса  Організація роботи техніка (з безпеки дорожнього руху) – начальника контрольно-технічного пункту
Організація роботи техніка (з безпеки дорожнього руху) – начальника контрольно-технічного пункту Создание сайта. Сервисы Google
Создание сайта. Сервисы Google Тема: Проект
Тема: Проект Страхование лекция
Страхование лекция Приемы видеомонтажа. Восьмерка
Приемы видеомонтажа. Восьмерка Александр Твардовский (1910 – 1971)
Александр Твардовский (1910 – 1971) Действующие в 2010 году
Действующие в 2010 году Рефинансирование
Рефинансирование Презентация на тему English-speaking countries (Англоговорящие страны)
Презентация на тему English-speaking countries (Англоговорящие страны)  Управления охраной труда на предприятии путем привлечения профильной аутсорсинговой организации
Управления охраной труда на предприятии путем привлечения профильной аутсорсинговой организации Куда сходить и как это найти? Club Map
Куда сходить и как это найти? Club Map Кадровый состав ГПС МЧС России. Лекция 1.5
Кадровый состав ГПС МЧС России. Лекция 1.5 Развитие института корпоративных секретарей в России(проблемные вопросы)
Развитие института корпоративных секретарей в России(проблемные вопросы) Турнир знатоков
Турнир знатоков Масса тела
Масса тела Презентация на тему Пунктуационный разбор
Презентация на тему Пунктуационный разбор  Решение задач на смеси, растворы и сплавы
Решение задач на смеси, растворы и сплавы