Слайд 2Цели урока:
Изучить химические свойства альдегидов.
Познакомить учащихся с применением формальдегида и ацетальдегида

на основе их свойств.
Развивать умения характеризовать строение и химические свойства изученных органических соединений, объяснять зависимость свойств веществ от их состава и строения, выполнять химический эксперимент, соблюдая правила безопасного обращения с веществами и лабораторным оборудованием, проводить наблюдения, делать выводы.
Воспитывать бережное отношение к своему здоровью, здоровью окружающих.
Слайд 3Выполните тест
1. (2 балла) Общая формула альдегидов :
А. RCOH В. R1COR2
Б. RCOOH Г. ROH
2.

(2 балла) Функциональная группа альдегидов :
А. - ОН В. – СОН
Б. - СО Г. – СООН
3. (2 балла) Формула формальдегида :
А.НСООН В.СН3СОН
Б.НСОН Г.СН3СООН
4. (2 балла) Вещество состава СН3СОН называется :
А. Метаналь В. Уксусная кислота
Б. Этаналь Г. Ацетальдегид
Слайд 4Правильные ответы
1. А R – C=O Общая формула альдегидов
Ι
H
2.

В - С=О Функциональная группа альдегидов
Ι
Н
3. Б Н – С=О Формальдегид
Ι
Н
4. Б,Г СН3С=О Этаналь. Ацетальдегид
Ι
Н
Слайд 5Получение альдегидов
1.Окислением (дегидрированием) первичных спиртов:
в промышленности
Cu,t
СН3СН2ОН → CH3COH + H2↑
этанол

этаналь
в лаборатории (закончить уравнение самостоятельно)
t
СН3СН2ОН + CuO →
Слайд 6Получение альдегидов
1.Окисление (дегидрирование) первичных спиртов:
в промышленности
Cu,t
СН3СН2ОН → CH3COH + H2↑
этанол

этаналь
в лаборатории t
СН3СН2ОН + CuO → CH3COH + H2O+ Cu
этанол черный этаналь красный
запах зеленого
яблока 2 балла
Слайд 7Получение альдегидов
2. Реакция Кучерова (написать самостоятельно уравнение реакции)

Слайд 8Получение альдегидов
2. Реакция Кучерова:
Hg2+
СН≡СН + Н2О → СН3СОН
ацетилен уксусный альдегид
4 балла

Слайд 9Особенности строения альдегидов
π δ+ δ-
а)R - С = О б)
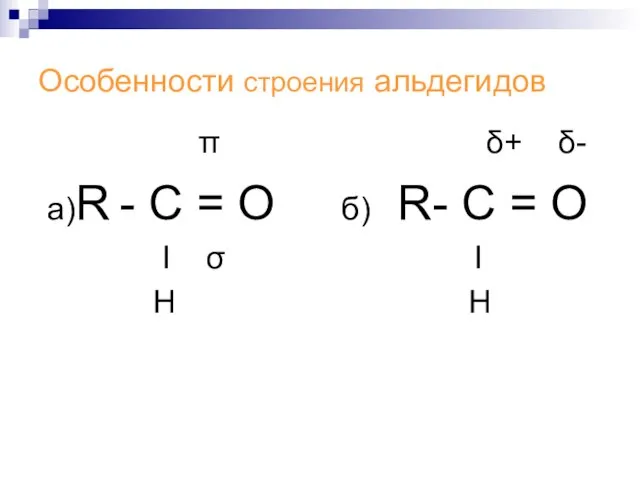
R- С = О
Ι σ Ι
Н Н
Слайд 10Физические свойства альдегидов
С1 – газ с резким запахом;
С2 – С3 – жидкости

с резким запахом;
С4 – С6 – жидкости с неприятным запахом;
>С6 – твердые, нерастворимые в воде с цветочным запахом (применяются в парфюмерии).
НСОН, СН3СОН – растворимы в воде неограниченно, температуры кипения ниже, чем у соответствующих спиртов.
Слайд 11Химические свойства альдегидов
1. Реакция восстановления
2. Реакции окисления.
Окислители: кислород [О],
![Химические свойства альдегидов 1. Реакция восстановления 2. Реакции окисления. Окислители: кислород [О],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434154/slide-10.jpg)
аммиачный раствор оксида серебра Ag2O,
свежеосажденный гидроксид меди [II] Cu(OH)2.
3. Реакции поликонденсации с фенолом С6Н5ОН
Слайд 12Реакция восстановления
Присоединение водорода к молекулам альдегидов происходит по двойной связи в

карбонильной группе (реакция гидрирования):
Ni
R – COH + H2 → R – CH2 – OH
альдегид первичный спирт
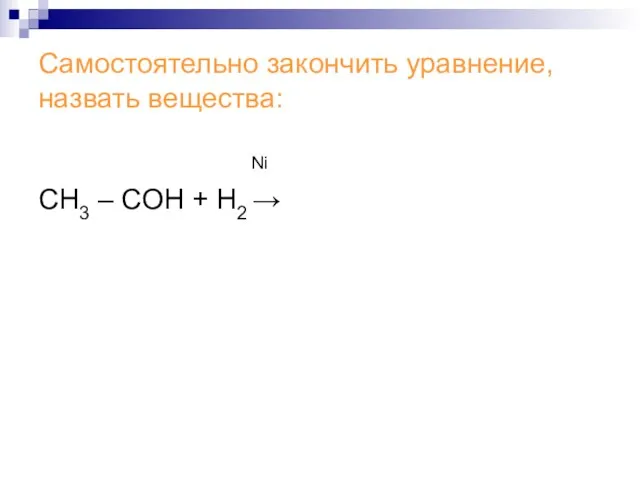
Слайд 13Самостоятельно закончить уравнение, назвать вещества:
Ni
СН3 – СОH + Н2 →
Слайд 14Самостоятельно закончить уравнение, назвать вещества:
Ni
СН3 – СОH + Н2 → CH3

– CH2 – OH
этаналь этанол
(ацетальдегид) (этиловый спирт)
(2 балла)
Слайд 15Реакции окисления
R – C = O + [O] → R –
![Реакции окисления R – C = O + [O] → R –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434154/slide-14.jpg)
C = O
Ι Ι
H OH__
альдегид карбоновая
кислота
НСООН – метановая (муравьиная) кислота
СН3СООН – этановая (уксусная) кислота
Слайд 16Самостоятельно закончить уравнение, назвать вещества:
СН3 – С = О + [О] →
![Самостоятельно закончить уравнение, назвать вещества: СН3 – С = О + [О] → Ι Н](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434154/slide-15.jpg)
Ι
Н
Слайд 17Самостоятельно закончить уравнение, назвать вещества:
СН3 – С = О + [О]
![Самостоятельно закончить уравнение, назвать вещества: СН3 – С = О + [О]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434154/slide-16.jpg)
→ СН3 – С = О
Ι Ι
Н ОН
этаналь этановая кислота
(уксусный альдегид, (уксусная кислота)
ацетальдегид)
2 балла
Слайд 18Качественные реакции на альдегиды (л.о. №10)
1. Реакция «серебряного зеркала»:
t
Н - С

= О + Ag2О → Н – С = О + 2Ag ↓
Ι Ι «серебряное
Н ОН зеркало»
метаналь метановая
(муравьиный альдегид, (муравьиная) кислота
формальдегид)
Используется для изготовления зеркал, серебрения украшений, елочных игрушек.
Слайд 19Качественные реакции на альдегиды (л.о. №10)
2. Окисление альдегидов свежеосажденным гидроксидом меди (II):
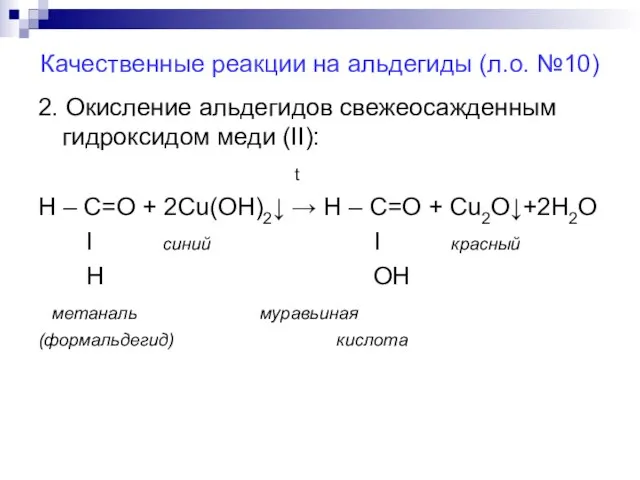
t
Н – С=О + 2Cu(ОН)2↓ → Н – С=О + Cu2O↓+2H2O
Ι синий Ι красный
H OH
метаналь муравьиная
(формальдегид) кислота
Слайд 20Реакция поликонденсации
(n+1)С6Н5ОН+nНСОН→[-CH2–C6H3OH - ]n-1+nH2O
фенол формаль- фенолформальдегидная
дегид смола
![Реакция поликонденсации (n+1)С6Н5ОН+nНСОН→[-CH2–C6H3OH - ]n-1+nH2O фенол формаль- фенолформальдегидная дегид смола](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434154/slide-19.jpg)
Слайд 21Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид) НСОН –

ядовит! Раствор формальдегида в воде (40%) называют формалином. Его используют:
в сельском хозяйстве для протравливания семян;
в кожевенной промышленности для обработки кож;
для хранения влажных биологических препаратов.
Формальдегид используют для получения кальцекса, уротропина – лекарственных веществ. Спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида используют для получения фенолформальдегидных смол, фенопластов, аминопластов.
Слайд 22Отдельные представители альдегидов и их значение
Уксусный альдегид (этаналь, ацетальдегид) СН3СОН – ядовит!

В промышленных масштабах его используют для получения уксусной кислоты, для производства различных пластмасс, ацетатного волокна и ряда других веществ.
Слайд 23Выполните тест
1. (2 балла) Продуктами восстановления альдегидов водородом (катализатор Ni) являются :
А.

Сложные эфиры В. Одноатомные спирты
Б. Карбоновые кислоты Г. Кетоны
2. (2 балла) В реакцию «серебряного зеркала» могут вступать :
А. Фенол В. Этанол
Б. Метаналь Г. Этаналь
3. (2 балла) Продуктом окисления этанола является :
А. Ацетон В. Уксусный альдегид
Б. Уксусная кислота Г. Диэтиловый эфир
4. (2 балла) Правой частью уравнения СН3СОН + 2Cu(ОН)2↓→ :
А. НСООН + Cu2O↓ + 2H2O
Б. CH3COOH + Cu2O↓ + 2H2O
Слайд 24Правильные ответы (самоконтроль)
В
Б,Г
В
Б
«5» - 26 – 23 балла
«4» - 22 –

18 баллов
«3» - 17 – 13 баллов









![Химические свойства альдегидов 1. Реакция восстановления 2. Реакции окисления. Окислители: кислород [О],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434154/slide-10.jpg)



![Реакции окисления R – C = O + [O] → R –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434154/slide-14.jpg)
![Самостоятельно закончить уравнение, назвать вещества: СН3 – С = О + [О] → Ι Н](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434154/slide-15.jpg)
![Самостоятельно закончить уравнение, назвать вещества: СН3 – С = О + [О]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434154/slide-16.jpg)


![Реакция поликонденсации (n+1)С6Н5ОН+nНСОН→[-CH2–C6H3OH - ]n-1+nH2O фенол формаль- фенолформальдегидная дегид смола](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434154/slide-19.jpg)




 Маски и каналы
Маски и каналы ЭТО
ЭТО Сенсорные сети и вездесущие вычисления
Сенсорные сети и вездесущие вычисления Ваш персональный менеджер
Ваш персональный менеджер Центр Репродукции и Генетики «ФертиМед» Комбинированный перенос эмбрионов М.Б.Аншина, Н.Л.Шамугия, Э.Ш.Абляева, А.А.Смирнова, И.И.Кал
Центр Репродукции и Генетики «ФертиМед» Комбинированный перенос эмбрионов М.Б.Аншина, Н.Л.Шамугия, Э.Ш.Абляева, А.А.Смирнова, И.И.Кал Отцы и дети
Отцы и дети Игра "Встреча с Осенью"
Игра "Встреча с Осенью" Разработка стратегии образовательного учреждения: вводные замечания
Разработка стратегии образовательного учреждения: вводные замечания Презентация к уроку русского языка.Тема «Общее представление о частях речи».
Презентация к уроку русского языка.Тема «Общее представление о частях речи». Готов к Труду и Обороне
Готов к Труду и Обороне Древний Египет Более 6000 лет назад на территории современного Египта существовало два государства: Верхний Египет занимал нижнюю ч
Древний Египет Более 6000 лет назад на территории современного Египта существовало два государства: Верхний Египет занимал нижнюю ч От специалиста к менеджеру. Что нужно узнать, чтобы успешно пройти этот путь?
От специалиста к менеджеру. Что нужно узнать, чтобы успешно пройти этот путь? О ходе реализации областной адресной программы по проведению капитального ремонта многоквартирных домов на территории Ульяновс
О ходе реализации областной адресной программы по проведению капитального ремонта многоквартирных домов на территории Ульяновс Первая помощь при травмах
Первая помощь при травмах Источники и потребители электрического тока
Источники и потребители электрического тока Математические диктанты
Математические диктанты Применение SCAD Office для расчета сооружений сложной геометрической формы на сейсмические воздействия(нормы и опыт расчетов)
Применение SCAD Office для расчета сооружений сложной геометрической формы на сейсмические воздействия(нормы и опыт расчетов) Счётная палата Российской Федерации
Счётная палата Российской Федерации Коты в мультфильмах
Коты в мультфильмах Сравнительное изучение микробиологической активности городских почв
Сравнительное изучение микробиологической активности городских почв ИННОВАЦИОННЫЙ ЦЕНТР «СКОЛКОВО»
ИННОВАЦИОННЫЙ ЦЕНТР «СКОЛКОВО» 4СРО
4СРО Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии Решение задач на тему: «Свободное падение».
Решение задач на тему: «Свободное падение». Что?
Что? Виды соревнований
Виды соревнований Кадры для цифровой экономики. Требования к участникам проекта
Кадры для цифровой экономики. Требования к участникам проекта Механическое движение. Траектория, путь, перемещение. Относительность движения. Прямолинейное равномерное движение
Механическое движение. Траектория, путь, перемещение. Относительность движения. Прямолинейное равномерное движение